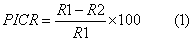Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Agrícola
versión impresa ISSN 2072-2001versión On-line ISSN 0253-5785
Ctro. Agr. vol.45 no.2 Santa Clara abr.-jun. 2018
ARTÍCULO DE INVESTIGACIÓN
Control de Rhizoctonia solani en frijol común con rizobacterias y productos naturales
Control of Rhizoctonia solani in common beans with rhizobacteria and natural products
Dienelys Hernández Pérez1, Manuel Díaz Castellanos1, Reinaldo Quiñones Ramos1, Ramón Santos Bermúdez2, Nayanci Portal González3, Lidcay Herrera Isla1
1 Facultad de Agronomía. Universidad Central "Marta Abreu" de Las Villas, Carretera a Camajuaní km 5 ½, Santa Clara, Villa Clara, Cuba, CP 54830
2 Facultad de Ingeniería Agropecuaria. Universidad Estatal Amazónica, Campus principal km 2 ½ vía a Napo, Puyo, Ecuador, CP 160150
3 Facultad de Ciencias Agrícolas. Universidad de Ciego de Ávila, Carretera a Morón km 9 ½, Ciego de Ávila, Cuba, CP 69450
E-mail: lidcayhi@uclv.edu.cu
RESUMEN
Con el objetivo de evaluar el efecto de rizobacterias y productos naturales sobre el control de la enfermedad causada por Rhizoctonia solani en frijol común, se desarrollaron experimentos in vitro y en condiciones semicontroladas. Las bacterias Pseudomonas fluorescens y Pseudomonas aeruginosa inhibieron totalmente el crecimiento in vitro de R. solani, en la evaluación del método de cultivo dual o doble capa. Bacillus subtilis y Bacillus cepacia mostraron un efecto inhibitorio menor, aunque superior al 65 %; mientras que ninguno de los tratamientos evaluados por el método de los pocillos inhibió totalmente el crecimiento del organismo patógeno. Las evaluaciones en condiciones semicontroladas mostraron que todos los tratamientos difieren estadísticamente respecto al control en cuanto a la proporción de plantas enfermas, aunque los mejores resultados se obtuvieron con la utilización de las rizobacterias, sin diferencias estadísticas respeto al control químico.
Palabras clave: Bacillus, biocontrol, Phaseolus vulgaris, Pseudomonas
ABSTRACT
In order to evaluate the effect of rhizobacteria and natural products on the control of the disease caused by Rhizoctonia solani in common beans, in vitro and semi-controlled experiments were developed. The bacteria Pseudomonas fluorescens and Pseudomonas aeruginosa totally inhibited the in vitro growth of R. solani, in the evaluation of the dual or double layer culture method. Bacillus subtilis and Bacillus cepacia showed a lower inhibitory effect, although higher than 65%; while none of the treatments evaluated by the wells method totally inhibited the growth of the pathogenic organism. The evaluations in semicontrolled conditions showed that all the treatments differed statistically with respect to the control regarding the proportion of diseased plants, although the best results were obtained with the use of the rhizobacteria, without statistical differences respect to the chemical control.
Keywords: Bacillus, biocontrol, Phaseolus vulgaris, Pseudomonas
INTRODUCCIÓN
Sobre el cultivo del frijol común influye notablemente la incidencia de enfermedades fúngicas, entre las que se destacan las causadas por hongos que habitan en el suelo, como Rhizoctonia solani que causa afectaciones considerables al cultivo (Nerey, 2010). Por eso, determinar el efecto de métodos no convencionales basados en el uso de medios biológicos y productos naturales para reducir la incidencia de estos hongos al cultivo del frijol común, constituye una prioridad.
Las bacterias que pertenecen a los géneros Pseudomonas y Bacillus se han usado en el control biológico de hongos fitopatógenos (Diaz, 2011) entre los que se encuentra R. solani, aunque existen pocos informes sobre su utilización en el frijol común. De este modo, la presente investigación se desarrolló con el objetivo de evaluar la efectividad in vitro y en condiciones semicontroladas de rizobacterias promotoras del crecimiento vegetal, y productos naturales, en el tratamiento a la semilla de frijol, para el control de la enfermedad.
MATERIALES Y MÉTODOS
La investigación se desarrolló en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias perteneciente a la Universidad Central "Marta Abreu" de Las Villas. Para los ensayos en condiciones semicontroladas se usaron semillas de frijol común del cultivar BAT-482 (Blanca), registrada en el Listado oficial de variedades comerciales (MINAGRI, 2009).
Microorganismos utilizados
-
Burkholderia cepacia (cepaCCIBP556W) procedente del Laboratorio de Microbiología del Instituto de Biotecnología de las Plantas (IBP)
-
B. subtilis (cepa ATCC 6051) procedente del Laboratorio de Microbiología, Universidad de Gent, Bélgica
-
P. aeruginosa (cepa 7NSK2) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas, Universidad de Gent, Bélgica
-
P. fluorescens (cepa CMR12) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas, Universidad de Gent, Bélgica
-
Trichoderma viride (cepa TS-85), Sclerotium rolfsii, R. solani y Macrophomina phaseolina, procedentes del Laboratorio de Microbiología Agrícola, Facultad de Ciencias Agropecuarias, UCLV
Productos naturales
-
Chitoplant ® (Quitosana 99,9 %)
Plaguicidas químicos
-
TMTD 80 % PH (Tetrametil Tiuram Disulfuro)
Para la reproducción de Bacillus subtilis se utilizó caldo nutriente, y King-B para P. fluorescens, los cuales fueron esterilizados en autoclave vertical a 121 ºC y 1,2 Kg cm-2 de presión por 15 min. Los microorganismos se mantuvieron en condiciones óptimas de crecimiento (28 ± 1 ºC durante 24 h). Estos cultivos, previa evaluación de sus concentraciones (108 ufc ml-1), fueron aprovechados como soluciones para el tratamiento de las semillas.
El recubrimiento con bacterias se realizó después de activarlas en 5 mL de caldo nutriente durante 48 h, posteriormente se multiplicaron dentro de un Erlenmeyer con 100 mL de caldo nutriente (se colocaron en una zaranda orbital Gerhardt durante 24 h a 30 ºC), luego se inoculó zeolita para cargarla con bacterias, la que fue secada al aire durante 48 h. Las semillas se cubrieron con la zeolita cargada utilizando almidón de yuca al 8 % como material adherente y después, secadas nuevamente al aire durante 48 h antes de ser sembradas.
El hongo para recubrir la semilla se multiplicó en un medio de cultivo (30 g de miel final y 3 g de levadura disueltos en un litro de agua destilada con un pH de 5,5) durante 48 h a 30 ºC en una zaranda orbital Gerhardt; a diferencia de las bacterias, el hongo no se activó. Ulteriormente, le siguió el mismo procedimiento realizado en el caso de las bacterias para el recubrimiento de las semillas.
Como organismo patógeno se trabajó R. solani obtenido del cepario del Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias, perteneciente a la Universidad Central "Marta Abreu" de Las Villas (UCLV), el mismo fue sembrado en placas de Petri (9 cm de diámetro) con PDA (Papa Dextrosa Agar), mantenido a 28 ºC durante siete días. Para su multiplicación se transfirieron discos de 1 cm de diámetro a Erlenmeyers previamente esterilizados en autoclave (120 ºC durante una hora), los cuales se incubaron a 28 ºC durante 15 días.
Efecto in vitro de bacterias antagonistas Para evaluar el efecto antagónico in vitro de B. subtilis, B. cepacia, P. fluorescens y P. aeruginosa sobre este hongo fitopatógeno del suelo se utilizaron dos métodos:
-
Cultivo Dual o Doble Capa: Se utilizó Agar Nutriente en placas de Petri (9 cm de diámetro) las cuales fueron inoculadas con los diferentes microorganismos antagónicos en forma de zigzag, incubándose a 28 ºC durante 24 h. Posteriormente se adicionó una capa de agar papa (PDA) al 2 % y se colocó un disco (0,5 cm de diámetro) de un cultivo puro de los hongos ensayados en el centro de la placa. Se realizaron evaluaciones desde las 24 h hasta las 72 h.
-
Método de los Pocillos: Las cepas bacterianas se activaron en 5 ml de caldo nutriente, las cuales se encubaron a 28 ± 1 ºC por 48 h. Luego en placas de Petri con medio agar nutriente se hicieron dos perforaciones (con un perforador de tapones de 0,5 cm de diámetro) en extremos opuestos de la placa. A estos se les añadió 0,1 ml de suspensión bacteriana, seguidamente se colocó un disco de cada hongo estudiado de 0,5 cm de diámetro en el centro de la placa, incubándose a 28 ± 1 ºC, evaluándose el crecimiento durante 24 a 72 h.
Se calculó el porcentaje de inhibición del crecimiento radial (PICR) según Bashan et al. (1996) para cada tratamiento. Como control fue utilizado un tratamiento de agua desionizada estéril en lugar de la suspensión bacteriana. Para cada cepa bacteriana se emplearon tres réplicas.
-
R1 – diámetro de crecimiento micelial del patógeno en ausencia de la bacteria
-
R2 – diámetro de crecimiento micelial del patógeno en presencia de la bacteria
Evaluaciones en condiciones semicontroladas
Se utilizaron recipientes de PVC (400 g) a los que se les agregó suelo del tipo Pardo mullido (Hernández et al., 1999) inoculado al 2 % (p/p) con R. solani. Se utilizó un diseño completamente aleatorizado con ocho tratamientos y cuatro réplicas.
Se sembraron cinco semillas de frijol común, variedad BAT- 482 (blanca) con un 100 % de germinación, por réplica. La humedad del suelo fue mantenida a partir de la adición de 230 ml de agua, por recipiente.
Se cuantificó la proporción de plantas enfermas para cada tratamiento:
-
Control absoluto (Sin tratamiento)
-
Control químico (TMTD 80 % PH, 3 g l-1) mediante la inmersión de la semilla durante 10 minutos
-
B. subtilis 1,5 x 109UFC ml-1 (recubrimiento de la semilla)
-
B. cepacia 4,9 x 109 UFC ml-1 (recubrimiento de la semilla)
-
P. aeruginosa 1,8 x 109UFC ml-1 (recubrimiento de la semilla)
-
P. fluorescens 6,6 x 109 UFC ml-1 (recubrimiento de la semilla)
-
Chitoplant ® (Quitosana 99,9 %) al 0,1 % (inmersión de la semilla)
-
T. viride (cepa TS-85) 1,2 x109 esporas (recubrimiento de la semilla)
RESULTADOS Y DISCUSIÓN
Efecto in vitro de bacterias antagonistas sobre R. solani
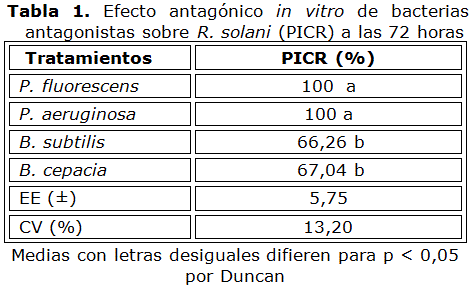
Al evaluar el efecto in vitro por el método de cultivo dual o doble capa (Tabla 1), se encontró que P. fluorescens y P. aeruginosa inhibieron totalmente el crecimiento del patógeno, mientras que B. subtilis y B. cepacia mostraron un efecto inhibitorio menor, pero superior al 65 %.
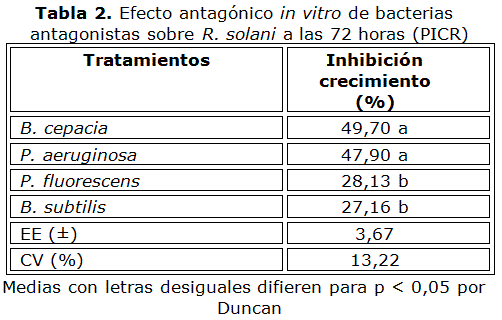
Por su parte, ninguno de los tratamientos evaluados por el método de los pocillos inhibió totalmente el crecimiento R. solani (Tabla 2), resultando B. cepacia y P. aeruginosa como las más efectivas, con valores de PICR de 49,70 y 47,90 % respectivamente.
Ramírez (2014) en estudios sobre el efecto antagonista de bacterias en el tratamiento a la semilla de frijol común contra hongos fitopatógenos que habitan en el suelo, reportó que las bacterias antagonistas ensayadas inhibieron in vitro el crecimiento micelial de S. rolfsii, M. phaseolina y R.solani. En condiciones de campo las bacterias estimularon el crecimiento de las plantas de los cultivares estudiados.
Cruz (2015) al evaluar el potencial de cepas de Bacillus spp. aisladas de la filosfera de Musa spp. como agentes de biocontrol de Mycosphaerella fijiensis Morelet, demostró que una cepa puede inhibir el crecimiento del patógeno in vitro a través de varios mecanismos. Específicamente, la cepa nativa B. pumilus CCIBP-C5 aislada de la filosfera de "FHIA-18" (AAAB) produce metabolitos con acción sobre el organismo patógeno, la respuesta de defensa de la planta y la expresión de la enfermedad.
Mavrodi et al. (2006) y Picard y Bosco (2008) señalaron que especies de Pseudomonas y otros géneros bacterianos sintetizan fenazinas e incluyen alrededor de 50 metabólicos secundarios pigmentados, los cuales ejercen efecto antifúngico. Adicionalmente, Parra et al. (2009) evaluaron la actividad antifúngica in vitro de cuatro cepas de Burkholderia cepacia contra hongos fitopatógenos y demostraron que las cuatro cepas tienen actividad antifúngica similar a T. viride porque ocasionan la inhibición total o parcial de la esporulación en hongos como Fusarium moniliforme, F. solani, Aspergillus niger y Penicillium expansum. También Álvarez et al. (2011) identificaron metabolitos de tipo lipopéptido en el filtrado de cultivo de cepas de B. amyloliquefaciens,capaces de producir similares deformaciones en el micelio de Sclerotinia sclerotiorum (de Bary).
Condiciones semicontroladas
En las evaluaciones realizadas todos los tratamientos mostraron diferencias estadísticamente significativas respecto al control absoluto respecto a la proporción de plantas enfermas, aunque los mejores resultados se obtuvieron con las bacterias estudiadas, sin diferencias estadísticas con el control químico (TMTD 80 % PH). Además, las rizobacterias resultaron superiores a los productos naturales en la protección de las plantas frente a este organismo patógeno (Figura).
Tanto los medios biológicos como los productos naturales utilizados tuvieron un efecto preventivo en la protección de las plantas de frijol contra este hongo del suelo. Arcos y Zúñiga (2015) evaluaron el efecto de rizobacterias en el cultivo de papa y reportaron que las cepas de B. subtilis (Bac17M8 y Bac17M9) y B. amyloliquefaciens, nativas de la región altiplánica del Perú y Bolivia, inoculadas a plántulas de dos cultivares de papa (Ccompis y Andina), mostraron la capacidad de inhibir la infección por R. solani. En ambos cultivares, las tres cepas de rizobacterias controlaron al fitopatógeno con una reducción del porcentaje de muerte de plántulas, y la disminución del porcentaje de tubérculos infectados, en comparación al tratamiento no inoculado.
Castillo-Reyes et al. (2015) al evaluar la efectividad in vitro de Bacillus y polifenoles de plantas nativas de México sobre R. solani encontraron que los aislamientos de Bacillusobtenidos de la rizosfera de plantas presentaron un efecto antagonista sobre R. solani. La especie más común encontrada fue B. subtilis, y en menor presencia B. pumilus y B. atrophaeus. Respecto a la quitosana, Martínez et al. (2004) refieren que este producto sirve de protección ante hongos fitopatógenos, adicionalmente, estimula el crecimiento de la planta, y funciona como un fungicida en general, protegiéndolas para que germinen con mayor efectividad.
CONCLUSIONES
-
Los tratamientos con bacterias antagonistas inhibieron in vitro el crecimiento de R. solani. Los mejores resultados se obtuvieron con el método de doble capa.
-
Las bacterias antagonistas y sustancias naturales fueron superiores al control absoluto y similares al control químico respecto a la reducción de plantas afectadas por R. solani, en condiciones semicontroladas.
BIBLIOGRAFÍA
ALVAREZ, F., CASTRO, M., PRÍNCIPE, A., BORIOLI, G., FISCHER, S., (et al.). 2011. The plant-associated Bacillus amyloliquefaciens strains MEP218 and ARP23 capable of producing the cyclic lipopeptides iturin or surfactin and fengycin are effective in biocontrol of sclerotinia stem rot disease. Journal of Applied Microbiology, 112:159-174.
ARCOS, J. and ZÚÑIGA, D. 2015. Efecto de rizobacterias en el control de Rhizoctonia solani en el cultivo de papa. Ecología Aplicada, 14 (2): 95-101.
BASHAN, J., HOLGUERÍ, G., FERRERA, R. 1996. Interacciones entre plantas y microorganismos benéficos. Terra, 14: 159-192.
CASTILLO-REYES, F., HERNÁNDEZ-CASTILLO, F., GALLEGOS-MORALES, G., FLORES-OLIVAS, A., RODRÍGUEZ-HERRERA, R. y AGUILAR, C. 2015. Efectividad in vitro de Bacillus y polifenoles de plantas nativas de México sobre Rhizoctonia solani. Revista Mexicana de Ciencias Agrícolas, 6 (3): 549-562.
CRUZ, M. 2015. Potencial de cepas de Bacillus spp. aisladas de la filosfera de Musa spp. como agentes de biocontrol de Mycosphaerella fijiensis Morelet. Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Villa Clara, Cuba, 100 p.
DÍAZ, M. 2011. Incidencia de Rhizoctonia spp., Sclerotium rolfsii Y Macrophomina phaseolina en frijol común en Villa Clara. Bases para el manejo integrado. Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Villa Clara, Cuba, 100 p.
HERNÁNDEZ, A., PÉREZ, J.M., BOSCH, D., RIVERO, L. 1999. Nueva Versión de la clasificación Genética de los Suelos de Cuba. Inst. Suelos, AGRINFOR, Ciudad Habana, Cuba, 64 p.
MARTÍNEZ, L., BERNSTEN, R., ZAMORA, M. 2004. Estrategias de mercado para el frijol Centroamericano. Agronomía Mesoamericana, 2 (15): 121-130.
MAVRODI, D., BLANKENFELDT, W. y THOMASHOW, L. 2006. Phenazine. Compounds in fluorescent Pseudomonas spp. Biosynthesis and Regulation. Annual Review of Phytopathology, 44: 417-445.
MINAGRI. 2009. Listado oficial de variedades comerciales. MINAGRI, La Habana, Cuba.
NEREY, Y., Van BENEDEN, S., FRANCA, S., JIMÉNEZ, A., CUPULL, R. (et al.). 2010. Influence of soil type and indigenous pathogenic fungí on bean hypocotyls rot caused by Rhizoctonia solani AG4 HGI in Cuba. Soil Biology & Biochemistry, 42: 797-803.
PARRA, E., CENTENO, S., ARAQUE, Y. 2009. Actividad antifúngica de Burkholderia cepacia aislada de maíz amarillo (Zea mays L.) bajo diferentes condiciones de cultivo. Revista de la Sociedad Venezolana de Microbiología, 29:103-109.
RAMÍREZ, M. 2014. Bases para el manejo integrado de hongos fitopatógenos del suelo en el frijol común (Phaseolus vulgaris L.). Tesis presentada en opción al Título Académico de Máster en Agricultura Sostenible, Mención Sanidad Vegetal. UCLV, Santa Clara, Villa Clara, Cuba.
Recibido: 05/02/2016
Aceptado: 15/03/2018