Introducción
La enfermedad diarreica aguda (EDA), también llamada gastroenteritis, constituye un importante problema de salud mundial. Según su etiología, la EDA, se clasifica en infecciosa (causada por virus, bacterias, protozoos o helmintos) y no infecciosa (por disalimentación, medicamentosa, de causa endocrina, entre otras).1
Los rotavirus (RV) son la causa principal de EDA infecciosa en niños menores de 5 años, con mayor riesgo de experimentar una infección sintomática antes de los primeros 2 años de vida.1 En el año 2016, la Organización Mundial de la Salud (OMS) estimó que ocurrieron en el mundo 215.000 muertes por RV (IC 95%: 197.000-233.000) en menores de 5 años de edad.2 La gastroenteritis causada por rotavirus (GERV) se presenta clínicamente como una diarrea acuosa y ácida que causa eritema perianal y en ocasiones fisuras. Generalmente la diarrea disminuye con el ayuno, y el vómito se presenta al inicio del curso de la enfermedad.1,2
Cuatro vacunas antirrotavíricas han sido precalificadas por la OMS: Rotateq® (Merck, Whitehouse Station, NJ), Rotarix® (GSK Biologicals, Rixensart, Belgium), Rotavac® (Bharat Biotech International Ltd) y Rotasiil® (Serum Institute SSIL). Otras vacunas se producen y administran a nivel nacional o regional.2
A la paulatina introducción de estas vacunas se atribuye un impacto en la disminución del número de visitas a servicios de urgencia, la disminución del número de ingresos por diarrea y la reducción de los casos severos de GERV alrededor del mundo. Por esto, desde 2007, la OMS recomienda incluir la vacunación contra RV en todos los programas nacionales de inmunización.3 La introducción en Cuba de una vacuna contra este patógeno es coherente con la voluntad política del país de aumentar las enfermedades inmunoprevenibles incluidas en el Programa Ampliado de Inmunización y ocupa hoy un tercer lugar de prioridad para el Sistema Nacional de Salud, antecedidas en orden de prioridad por la vacuna antineumocócica y la vacuna contra el papilomavirus.4
Para evaluar el posible impacto de esta medida preventiva, resulta necesario que los países posean una línea de base pre-vacunación de la carga de la GERV. La OMS propone la implementación de sistemas centinelas de vigilancia de la enfermedad, de base hospitalaria, metodología que permite estimar la prevalencia o incidencia de enfermedades o problemas de salud de alta frecuencia y baja letalidad, cuando no es necesario registrar todos los eventos para evidenciar su comportamiento en una población determinada.5
La presente investigación se propuso evaluar los resultados obtenidos con la implementación de un sistema de vigilancia centinela para la GERV en niños menores de 5 años en un hospital pediátrico cubano que permita obtener evidencias de la carga de la enfermedad, durante los meses comprendidos entre noviembre de 2017 hasta abril de 2018, que justifiquen la introducción de la vacuna contra RV.
Materiales y Métodos
Tipo de estudio
Este estudio sigue un enfoque de vigilancia epidemiológica de tipo centinela de casos clínicos concurrentes (prospectivo), observacional y descriptivo.
Desde el 1 de noviembre del 2017 y hasta el 30 de abril del 2018 se implementó en el Hospital Pediátrico de Centro Habana (HPCH) un sistema de vigilancia de base hospitalaria, en su fase piloto, para la identificación de casos de GERV y su caracterización según severidad, además de explorar el uso de los servicios de pacientes y describir algunas variables clínico- epidemiológicas de interés.
Se escogió este hospital por ser Centro Nacional de Referencia en EDA del Ministerio de Salud Pública y miembro de la Red Centinela de Investigación, Vigilancia y Evaluación de Impacto de Vacunas (Red VacCuba) del Instituto Finlay de Vacunas.6 La investigación se aprobó por los comité de ética y consejo científico de la institución hospitalaria. Se tuvieron en cuenta los cuatro principios básicos de la bioética: la beneficencia, la no maleficencia y el respeto a la persona y la justicia, durante la realización del estudio.
Inclusión
Se incluyeron y consideraron como casos sospechosos todos los niños hospitalizados menores de 5 años con diagnóstico de EDA al ingreso, cuyas características clínicas se correspondieran con una diarrea viral, a los que se les recogieron muestras de heces en las primeras 48 horas del ingreso. Se definió como diarrea la presencia de tres o más deposiciones con cambio en la consistencia y volumen de las heces en un período de 24 horas. Se solicitó consentimiento informado de los padres o tutores legales antes de incluir a los niños en el estudio.
Exclusión
Se excluyeron los niños en los que la gastroenteritis comenzó, al menos, 48 horas después de la admisión en el hospital.
Colección de datos clínicos y muestras para diagnóstico microbiológico
La atención clínica de los casos de EDA incluidos en el estudio se realizó de acuerdo con los protocolos de atención hospitalaria y las recomendaciones de la OMS para este tipo de paciente.7 Además, a cada caso se le aplicó un cuestionario que recogía variables clínicas, epidemiológicas y de uso de los servicios hospitalarios. Las variables de estudio de los sujetos participantes fueron: características sociodemográficas (edad, sexo, municipio y provincia de residencia), médicas (antecedentes patológicos personales, signos y síntomas clínicos de la enfermedad, estancia hospitalaria y condición de egreso hospitalario), factores de riesgo (ablactación, lactancia materna, antecedentes de vacunación y estado nutricional). Las variables epidemiológicas recogidas fueron: hacinamiento, fuente de abasto de agua, tratamiento del agua para el consumo, animales en el hogar, nivel escolar del cuidador y asistencia a círculos infantiles. Dicho cuestionario se completó prospectivamente desde el ingreso hasta el alta hospitalaria. La severidad del episodio gastroentérico fue evaluada utilizando la escala de Vesikari. Se evaluó de leve una puntuación ≤6, moderado 7-10 puntos, severo 11-15 puntos y muy severo ≥16.8
La muestra de heces se recogió en cada caso por un enfermero y se analizó por personal calificado de microbiología del hospital quien realizó la prueba de diagnóstico rápido de RV HeberFast Line Rotavirus producida por el Centro de Ingeniería Genética y Biotecnología en Cuba.9 Los casos sospechosos para quienes la prueba de diagnóstico rápido fue positiva, se consideraron como casos probables.
Posteriormente, a las muestras fecales que resultaron positivas a RV por la prueba de diagnóstico rápido, se les tomó una alícuota que se conservó en el Departamento de Microbiología a temperatura de -20ºC. Las muestras recolectadas fueron enviadas al Laboratorio Nacional de Referencia del Instituto de Medicina Tropical "Pedro Kourí" (IPK) donde todas las muestras fueron analizadas con el inmunoensayo comercial ELISA RIDASCREEN® Rotavirus, R-Biopharm AG, Darmstadt, Alemania.10 Se consideraron casos confirmados de GERV los niños cuyas muestras fueron positivas por dicho ELISA.
Todas las variables del estudio referidas previamente se analizaron estadísticamente según su naturaleza. Se utilizó media y desviación estándar para las variables cuantitativas y proporciones para las cualitativas. Las proporciones se compararon mediante la prueba chi-cuadrado o la Prueba exacta de Fisher de 2 colas, entre los casos que resultaron confirmados por RV y los que no fueron confirmados. Se ajustó un modelo de regresión logística que consideró como variable dependiente el resultado del cierre de la vigilancia (0: caso no confirmado, 1: caso confirmado). Como variables independientes se incluyeron aquellas que mostraron asociación significativa en el análisis bivariado. El efecto del tamaño se muestra mediante estimaciones de la razón de odds e intervalos de confianza al 95%. Se consideró un nivel de significación del 5% en todas las comparaciones.
Para el procesamiento estadísticos de los datos se usó IBM SPSS, versión 20.0 y R, versión 4.01, ambos para Windows.
Resultados
Captación de casos por el sistema de vigilancia
El sistema de vigilancia captó un total de 80 pacientes, de los cuales 36 (44,9%) fueron confirmados como casos de GERV y 44 (55,1%) resultaron negativos empleando el ensayo inmunoenzimático tipo ELISA RIDASCREEN®, en el Laboratorio Nacional de Referencia del IPK (Fig. 1).
Se realizó la comparación entre casos confirmados y casos descartados de GERV según variables demográficas del niño, condiciones de la vivienda y prácticas alimentarias (Tabla 1).
Tabla 1 Comparación entre casos confirmados y casos descartados de GERV según variables demográficas del niño, condiciones de la vivienda y prácticas alimentarias.
| Rotavirus Confirmado (n= 36) | Rotavirus Descartado (n=44) | Total (n=80) | |||||
|---|---|---|---|---|---|---|---|
| Variables | # | % | # | % | # | % | |
| Edad (meses) | |||||||
| 0-5 | 8 | 22,2 | 17 | 38,6 | 25 | 31,3 | |
| 6 a 11 | 7 | 19,4 | 12 | 27,3 | 19 | 23,8 | |
| 12 a 23 | 9 | 25,0 | 9 | 20,5 | 18 | 22,5 | |
| 24 a 35 | 4 | 11,1 | 3 | 6,8 | 7 | 8,8 | |
| 36 a 47 | 5 | 13,9 | 2 | 4,5 | 7 | 8,8 | |
| 48 a 59 | 3 | 8,3 | 1 | 2,3 | 4 | 5,0 | |
| Sexo | |||||||
| Femenino | 13 | 36,1 | 23 | 52,3 | 36 | 45,0 | |
| Masculino | 23 | 63,9 | 21 | 47,7 | 44 | 55,0 | |
| Asiste a círculo infantil o guarderías | |||||||
| Si | 16 | 44,4 | 8 | 18,18 | 24 | 30,0 | |
| No | 20 | 55,6 | 36 | 81,8 | 56 | 70,0 | |
| Hacinamiento | |||||||
| Sí | 12 | 27,27 | 7 | 15,9 | 19 | 23,8 | |
| No | 24 | 66,6 | 37 | 84,09 | 61 | 76,3 | |
| Lactancia materna | |||||||
| Si | 36 | 100 | 40 | 90,9 | 76 | 95 | |
| No | 0 | 0 | 4 | 9,1 | 4 | 5 | |
| Tratamiento del agua de consumo | |||||||
| Si | 35 | 97,2 | 36 | 81,8 | 71 | 88,7 | |
| No | 1 | 2,7 | 8 | 18,8 | 9 | 11,3 | |
Aspectos sociodemográficos del niño y cuidador principal
En la distribución por edades, 25 infantes eran menores de 6 meses (31,25%) mientras que los niños menores de 2 años representaron el 77,5% (62/80) (Tabla 1). La proporción de niños con edades entre 1 y 5 años fue significativamente mayor (p=0,030) en el grupo confirmado (58,3) con respecto a los no confirmados (34,1).
El sexo masculino fue el más común con 44 casos (55,1%). La madre fue el principal cuidador en el 93,8% de los casos (76/80) predominando en este caso el nivel educacional secundario (28,8%) y una edad media de 27 años (DS: ±3,8). Se captaron casos de todos los municipios de la provincia La Habana, dos casos de la provincia Mayabeque, uno de Guantánamo y otro del municipio especial Isla de la Juventud. Ninguna de estas variables sociodemográficas mostró diferencias significativas al comparar casos confirmados y no confirmados.
Factores ambientales
En 78 de los hogares se recibía agua de acueducto (97,5%), mientras dos casos (2,5%) obtenían el agua de pozos. En el 23,8% de las viviendas (19/80) se reportó más de tres convivientes por dormitorios, lo cual fue considerado como hacinamiento. En el grupo confirmado, la proporción de niños que vivían en hacinamiento fue del 33,3% mientras que en el grupo de no confirmados fue del 15,9 (p=0,060).
El 28,8% de las familias poseía mascotas o animales de corral, siendo el perro más frecuente (19/80), seguido del gato (5/80), puerco y gallinas (1/80) respectivamente. Otras cuatro familias (5%) reportaron poseer animales, pero decidieron no declarar la especie. Todos los incluidos mencionaron la presencia de vectores (cucarachas, ratones, mosquitos) en el hogar. Asistieron al círculo infantil el 44,4% de los casos confirmados y el 18,18% de los no confirmados.
Lactancia materna, estado nutricional y otros comportamientos relacionados con la alimentación
Recibieron lactancia materna los 36 casos confirmados (100%) como GERV y el 90,9% de los casos descartados (40/44), siendo esta variable estadísticamente significativa (p=0,0123). El 5% del total de niños incluidos en la vigilancia (4/80) nunca fue amamantado y solo 54 niños (67,5%) cumplieron adecuadamente la lactancia materna exclusiva en los primeros 6 meses de vida. El 75% de los casos reportó violaciones a las recomendaciones nutricionales para su edad, fundamentalmente con la introducción precoz de alimentos, lo que se consideró ablactación inadecuada. El 78,8% de los casos captados se clasificaron por su evaluación nutricional como eutróficos.
Se incluyeron en el modelo las covariables predictoras que mostraron asociación en el análisis bivariado: grupo de edad (0: si < 1 año, 1: si ≥1 año y < de 5 años), asistir a círculo infantil, guardería o casa de cuidador (0: si no asiste y 1: si asiste) y hacinamiento (0: si índice de hacinamiento<3, 1: si índice de hacinamiento ≥3). En la Tabla 2 se pueden consultar las estimaciones obtenidas al ajustar el modelo.
Tabla 2 Análisis multivariado de las características de los pacientes incluidos en el estudio que resultaron asociadas con la hospitalización por rotavirus en el análisis bivariado.
| Intervalo de confianza al 95% | ||||
|---|---|---|---|---|
| Variable | Razón de Odd | Límite inferior | Límite superior | P valor |
| Asiste a círculo infantil, guardería o casa cuidadora | 4,03 | 1,42 | 11,46 | 0,009 |
| Hacinamiento | 3,10 | 1,01 | 9,50 | 0,048 |
Descripción y evolución clínica del cuadro gastroentérico y clasificación de la severidad según escala de Vesikari
Las características clínicas del cuadro gastroentérico, se muestran en la Tabla 3. En el 43,8% de los niños, el cuadro gastroentérico comenzó con la presencia de un solo síntoma (35/80), siendo la diarrea el más representativo con 32,5% (26/80). El 56,2% (44/80) de los niños debutaron con más de un síntoma, donde la combinación de diarrea y vómitos fue la más común para el 23,8% (19/80). En los casos de RV confirmados predominó la fiebre como síntoma inicial (66,7%) seguido de la diarrea y el vómito (63,2%). El 52,9% de estos casos presentó la clásica triada de diarrea, vómitos y fiebre. La distribución de estas manifestaciones en el debut clínico no presentó significación estadística.
Durante el ingreso hospitalario el 100% de los pacientes presentó diarreas, el 68,8% vómitos y el 55% fiebre. Se constató desbalance hidroelectrolítico en el 67,5% de los pacientes clasificándose la deshidratación de leve en el 53,8%, moderada en el 11,3% y severa en el 2,5%, así como en el 11,3% de los casos se presentó acidosis metabólica. El 78,8% presentó eritema perianal y el 8,8% fisura anal. La variable vómitos presentó diferencias significativas constituyendo un signo predominante en los casos confirmados. (p=0,002).
Tabla 3 Comparación entre casos confirmados y casos descartados de GERV según síntomas y signos clínicos antes y durante el ingreso.
| Rotavirus Confirmado (n= 36) | Rotavirus Descartado (n=44) | Total (n=80) | |||||
|---|---|---|---|---|---|---|---|
| Síntomas y signos | # | % | # | % | # | % | P valor |
| Manifestaciones clínicas al debut | |||||||
| Diarrea | 9 | 34,6 | 17 | 65,4 | 26 | 32,5 | |
| Diarrea y fiebre | 1 | 11,1 | 8 | 88,9 | 9 | 11,3 | |
| Diarrea y vómitos | 12 | 63,2 | 7 | 36,8 | 19 | 23,8 | |
| Diarrea, vómitos y fiebre | 9 | 52,9 | 8 | 47,1 | 17 | 21,3 | 0,320 |
| Fiebre | 2 | 66,7 | 1 | 33,3 | 3 | 3,8 | |
| Vómitos | 3 | 50,0 | 3 | 50,0 | 6 | 7,5 | |
| Manifestaciones clínicas durante ingreso hospitalario | |||||||
| Diarrea | 36 | 45,0 | 44 | 55,0 | 80 | 100,0 | 1 |
| Vómitos | 31 | 56,4 | 24 | 43,6 | 55 | 68,8 | 0,002 |
| Fiebre | 20 | 45,5 | 24 | 54,5 | 44 | 55,0 | 0,928 |
| Acidosis metabólica | 2 | 22,2 | 7 | 77,8 | 9 | 11,3 | 0,132 |
| Eritema perianal | 27 | 42,9 | 36 | 57,1 | 63 | 78,8 | 0,459 |
| Fisura anal | 2 | 28,6 | 5 | 71,4 | 7 | 8,8 | 0,351 |
| IRA concomitante | 8 | 33,3 | 16 | 66,7 | 24 | 30,0 | 0,166 |
| Deshidratación | 26 | 48,1 | 28 | 51,9 | 54 | 67,5 | 0,320 |
Al ser evaluados utilizando la escala de Vesikari (Tabla 4) el 77,8% de los casos confirmados a RV (28/36) presentaron un cuadro de gastroenteritis severa, mientas que en el grupo no confirmado fue del 43,2%. Como se muestra en la Tabla 4, resultó esta una diferencia significativa al comparar con los casos no confirmados (p=0,0066). Para los casos confirmados, el número máximo de deposiciones en 24 horas fue 16, de vómitos fue 15 y la máxima temperatura alcanzada fue de 40ºC.
Tabla 4 Severidad de la gastroenteritis en casos confirmados y no confirmados de GERV.
| Rotavirus Confirmado (n= 36) | Rotavirus Descartado (n=44) | Total (n=80) | |||||
|---|---|---|---|---|---|---|---|
| Clasificación Vesikari | # | % | # | % | # | % | P valor |
| Leve | 2 | 5,6 | 9 | 20,5 | 11 | 13,8 | |
| Moderado | 6 | 16,7 | 16 | 36,4 | 22 | 27,5 | 0,0066 |
| Severo | 28 | 77,8 | 19 | 43,2 | 47 | 58,8 | |
Durante la estancia en el hospital, el 90% de los pacientes recibió terapia de rehidratación oral y al 57,5% se le administró líquidos por vía parenteral. La administración de sulfato de zinc se indicó en el 93,8% de los casos. También se encontró el uso de antipiréticos (47,5%) y antieméticos (1,25%) en los casos estudiados. Se administraron antibióticos (azitromicina en suspensión por vía oral y cefotaxima sódica y ceftriaxona por vía parenteral) a tres pacientes (3,75%).
Uso de los servicios
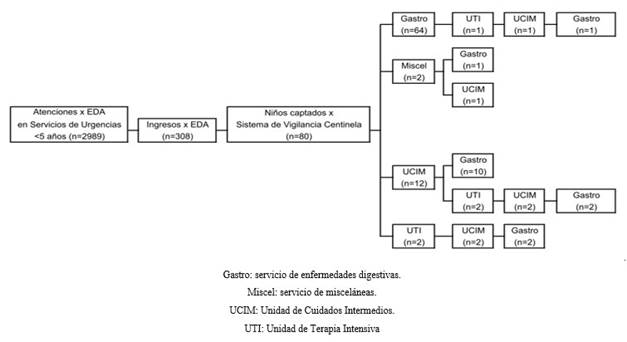
La Figura 2 muestra el flujo de atención y uso de los servicios de los pacientes captados por el sistema de vigilancia.
El 80% de los casos (64/80) ingresó en el servicio de gastroenterología, de ellos un paciente necesitó ser trasladado a la Unidad de Cuidados Intensivos (1,7%), mientras el resto (98,3%) se mantuvo en el servicio de gastroenterología. Adicionalmente el 1,8% de los casos tuvo su ingreso primario en servicios de atención al grave (cuidados intensivos o intermedios) y el 2% de los casos (2/80) ingresó inicialmente en el servicio de miscelánea por ausencia de camas en los servicios de gastroenterología o cuidados intensivos a donde fueron trasladados posteriormente. El 100% de los casos evolucionó hacia la mejoría y fue egresado desde el servicio de gastroenterología. La media de estadía hospitalaria fue de 3,8 días (IC 95%:3,4-4,2) no encontrándose diferencias significativas entre los casos confirmados y no confirmados (p= 0,293).
Indicadores de carga de uso de los servicios hospitalarios
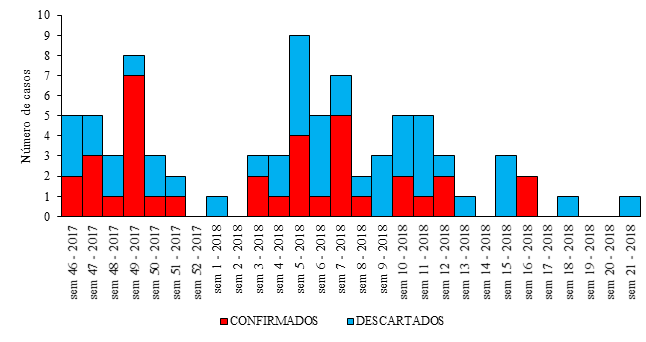
Fue analizada la carga que representa para el hospital el número de atenciones en el cuerpo de guardia y el número de casos ingresados por EDA y de ellas, las GERV (Tabla 5). En este período los ingresos hospitalarios por EDA representaron el 10,3% del total de solicitudes de atención en cuerpo de guardia. Del total de ingresos por EDA el 26% se clasifica como de etiología infecciosa de posible causa viral siendo el 45% de ellas confirmadas por RV. El mes de diciembre mostró el mayor porcentaje de casos confirmados en el período estudiado.
Tabla 5 Uso de los servicios por menores de 5 años con EDA.
| Mes | Atenciones médicas por EDA en cuerpo de guardia (a) | Ingresos en EDA (b) | % (c=b/a*100) | Captados por el sistema de vigilancia (d) | % (e=d/b*100) | Casos Confirmados (f) | % (e=f/d*100) |
|---|---|---|---|---|---|---|---|
| Noviembre 2017 | 911 | 89 | 9,8 | 10 | 11,2 | 5 | 50,0 |
| Diciembre 2017 | 552 | 47 | 8,5 | 16 | 34,0 | 10 | 62,5 |
| Enero 2018 | 554 | 59 | 10,6 | 12 | 20,3 | 6 | 50,0 |
| Febrero 2018 | 478 | 49 | 10,3 | 20 | 40,8 | 8 | 40,0 |
| Marzo 2018 | 311 | 38 | 12,2 | 16 | 42,1 | 5 | 31,3 |
| Abril 2018 | 178 | 26 | 14,6 | 6 | 23,1 | 2 | 33,3 |
| Total | 2984 | 308 | 10,3 | 80 | 26,0 | 36 | 45 |
Discusión
El estudio realizado brinda nuevas evidencias sobre la carga de enfermedad de la GERV como causa de ingreso y uso de los servicios en un hospital pediátrico. Estos resultados pueden ser de utilidad como línea de base para una futura evaluación de la efectividad e impacto de la introducción de una vacuna contra el RV en Cuba. Hasta donde conocemos, es el primer reporte del empleo en Cuba de la escala de Vesikari para clasificar la severidad de la GERV.
No fue posible con la investigación realizada inferir estacionalidad, pues el período estudiado se extendió solo por 6 meses, que coincidieron con la etapa de seca o invierno asociada con un alza de RV en Cuba y a nivel mundial.11) Internacionalmente, la existencia o no de patrones de estacionalidad en la GERV es un tema abierto y controversial.12,13 Para el caso cubano resulta necesario mantener un sistema de vigilancia de la circulación del patógeno durante todo el año y establecer una línea de base que permita, una vez introducida la vacuna, la evaluación de su efecto en la dinámica estacional y comprender mejor qué otros factores influyen en la posible estacionalidad de esta enfermedad en Cuba.
El porcentaje de casos confirmados de GERV encontrados en esta investigación se encuentra dentro del rango de los reportados por estudios previos en el país, que sitúan la confirmación del virus entre el 8,2%- 64,2% de los casos estudiados.11,14,15 En la presente investigación, se atribuyó al RV ser el agente causal de uno de cada cuatro ingresos de niños menores de 5 años.
Los grupos de edades incluidos para desarrollar la vigilancia de RV se correspondieron con lo descrito internacionalmente, con predominio de los menores de 5 años y mayor vulnerabilidad para los niños entre 1-12 meses.7,13 Igual tendencia se encuentra en estudios previos realizados en Cuba.11,14,15,16,17 Por tanto, el predominio de niños menores de 1 año entre los captados es un resultado esperado. El diagnóstico positivo de RV en niños en esta etapa de la vida apoya la importancia de la inmunización temprana.11
La mayor representación de los municipios de Centro Habana, Habana del Este y Habana Vieja entre los casos captados, se explica al ser el HPCH la unidad establecida por la regionalización de los servicios para estos municipios. Cerro y Diez de Octubre a pesar de tener establecidos al Hospital Pediátrico del Cerro como hospital de referencia, cuentan con consejos populares que se encuentran geográficamente cercanos al hospital donde se realizó el estudio. Otras posibles causas pudieran ser que la red de transporte urbano de la ciudad facilita a esas poblaciones el acceso a este hospital, así como el prestigio del mismo como Centro de Referencia para las enfermedades diarreicas, lo cual pudo influir en la decisión de los padres de otros municipios de la capital y de Mayabeque de acudir con sus niños a solicitar los servicios de la institución citada.
Estudios realizados por otros investigadores han demostrado que el bajo peso al nacer, la lactancia materna, el consumo de agua no potable, la higiene doméstica inadecuada, la presencia de animales domésticos y el bajo nivel de instrucción de los padres, son factores de riesgo que incrementan los índices de morbilidad ambulatoria y hospitalaria para EDA.13,18,19,20,21,22,23
En la investigación se reafirmó que la asistencia a círculos infantiles eleva el riesgo de transmisión de las enfermedades diarreicas, pues la trasmisión fecal-oral se exacerba cuando existe hacinamiento y el lavado de las manos o la higiene de los utensilios de uso común se descuida.21)
Al analizar la clasificación de la severidad de la GERV esta fue mayor en los pacientes con diagnóstico confirmado de RV. A pesar de que existieron casos clasificados de gastroenteritis moderados y severos, no se reportó ningún fallecido. La escala de Vesikari es reconocida actualmente como el sistema de puntuación más preciso para evaluar la gravedad clínica de la EDA por RV. La OMS recomienda su uso en los ensayos clínicos de vacunas en países en desarrollo desde el 2008. Incluye siete parámetros en su sistema de evaluación: diarrea, vómitos, fiebre, deshidratación, la duración de la diarrea y de los vómitos, así como el tipo de tratamiento. Este sistema permite una puntuación de gravedad clínica entre 0 y 20 puntos. No hemos encontrado estudios previos que documenten el uso de la escala de Vesikari en Cuba, por lo que este parece ser el primer reporte en el país. La presencia de vómitos continúa siendo una manifestación clínica que distingue a esta enfermedad desde el inicio del cuadro clínico.1,11
El número de atenciones por EDA en cuerpo de guardia, las proporciones de casos captados del total de ingresos por EDA y casos confirmados del total de los captados, se comportaron en porcentajes ligeramente inferiores a lo reportado en otros países del mundo,22 pero continúan siendo una importante carga de morbilidad y uso de los servicios al superar el 25%. A pesar del impacto positivo de otras medidas preventivas sobre la morbilidad por EDA en Cuba,11) no se debe minimizar la carga de enfermedad atribuible al RV, ni desestimar la introducción de vacunas para disminuir el impacto de esta enfermedad en la población infantil.23
Los datos sugieren que la vigilancia de la diarrea por RV en Cuba debe mantenerse y extenderse a otros hospitales provinciales que ingresen un mayor número de casos. La disponibilidad de un medio diagnóstico rápido de RV de producción nacional representa una fortaleza y es aconsejable su uso para este objetivo de vigilancia ampliada. La confirmación final de los casos debe continuar realizándose a través de un ELISA10 a todos los casos probables y a un 10% de los casos negativos.
Conclusiones
Los sistemas de vigilancia de la gastroenteritis por RV en la etapa pre-introducción de una vacuna resultan imprescindibles para monitorear el impacto de la futura introducción de vacunas contra la enfermedad causada por este patógeno. Los resultados mostrados validan la funcionalidad de la Red VacCuba y del sistema de vigilancia centinela creado, además de brindar nuevas evidencias sobre la carga de la enfermedad y la utilización de los servicios, en un hospital pediátrico cubano, debido a la GERV.