Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.34 n.2 Ciudad de la Habana Mayo-ago. 2000
Instituto de Farmacia y Alimentos. Universidad de La Habana
Estabilidad de los supositorios de quitina
Yania Suárez Pérez,1 Ofelia Bilbao Revoredo,2 Hilda María González San Miguel,2 Olga M. Nieto Acosta 2 y Ángel L. Azoy Carralero3RESUMEN
Los supositorios de quitina constituyen una nueva opción en la terapéutica anorrectal, cuya estabilidad debe ser evaluada. Se analizó el comportamiento de 3 lotes de supositorios elaborados a escala piloto, almacenados en tiras de aluminio termosellable, a 3 temperaturas diferentes, por un período de 2 a. Se realizaron comprobaciones periódicas de las propiedades organolépticas, de los parámetros peso y tiempo de liquefacción, así como del contenido de quitina, con la combinación de una técnica gravimétrica y la espectroscopia infrarroja (IR). Se investigó la estabilidad desde el punto de vista microbiológico mediante conteo diferencial. Los resultados fueron satisfactorios para cada parámetro evaluado, ya que se encontraron dentro de los límites, aun transcurridos 2 a de elaborado el producto, para cada una de las temperaturas de almacenamiento ensayadas.Descriptores DeCS: QUITINA /análisis; SUPOSITORIOS; ESTABILIDAD DE MEDICAMENTOS; ALMACENAJE DE MEDICAMENTOS.
En los últimos años se ha incrementado notablemente el estudio de los biomateriales, destacándose la utilización de sustancias poliméricas naturales y sintéticas en diversas ramas de la ciencia y la técnica. La quitina es un polímero natural de potente efecto como agente acelerador de la cicatrización,1 para el cual se reportan resultados satisfactorios en el tratamiento de diversas afecciones con pérdida de la cobertura cutánea.2-4
En el presente trabajo se trata por primera vez la introducción de la quitina cubana en la forma farmacéutica supositorio, destinada al tratamiento de afecciones anorrectales; por lo que hemos dirigido nuestra investigación hacia la comprobación de la posible interacción quitina-excipiente.
En la actualidad, las exigencias a una nueva forma farmacéutica incluyen los estudios de estabilidad como requisito indispensable para el registro y venta de medicamentos.5 Los supositorios deben ser química, física y microbiológicamente estables al menos durante 2 años a temperatura de refrigeración, según recomienda la mayoría de los autores.6,7
La quitina en forma de polvo resulta extremadamente estable. Los estudios realizados por hidrólisis ácida del polímero reportados en la literatura, proponen un tiempo de vencimiento superior a los 5 a, y plantean como productos de la hidrólisis total: quitosana, N acetilglucosamina, D glucosamina y ácido acético (Nieto OM. Quitina. Su estudio y utilización como fármaco acelerador de la cicatrización. Tesis presentada en opción al título de Doctor en Ciencias Farmacéuticas. Facultad de Farmacia y Alimentos. Universidad de La Habana.1993).Considerando las propiedades físico-químicas de la quitina, especialmente su limitada solubilidad y reactividad,8 se dificulta su análisis cuantitativo.
Los métodos reportados en la bibliografía carecen de valor desde el punto de vista práctico para el control químico de este fármaco y su seguimiento, una vez introducido en una forma dosificada por constituir técnicas indirectas basadas en la estimación de alguno de los productos de hidrólisis.9-11 La gravimetría directa ha sido propuesta como una adecuada opción para realizar el control de calidad del ungüento de quitina al 5 % (Bilbao O. Evaluación de quitina en preparaciones farmacéuticas. Tesis presentada en opción al título de Doctor en Ciencias Farmacéuticas. Facultad de Farmacia y Alimentos. Universidad de La Habana. 1993). Sin embargo, esta técnica carece de la especificidad y sensibilidad exigida para su aplicación en estudios de estabilidad, por lo cual se complementa con la espectroscopia IR, según la metodología propuesta para el estudio de estabilidad de los supositorios de quitina 200 mg (Suárez Y. Supositorios de quitina, nueva opción en la terapéutica rectal. Tesis presentada en opción al título de Master en Tecnología y Control de Medicamentos. Instituto de Farmacia y Alimentos. Universidad de La Habana.1996).
MÉTODOS
Equipos
- Balanza analítica Mettler ER-60A.
- Baño termostatado MLW.
- Estufa MLW.
- Espectrofotómetro IR analítico ATI Mattson Modelo Genesis Series FTIR.
Reactivos
Quitina materia prima de calidad farmacéutica suministrada por la Empresa "Mario Muñoz", lote: 940518.
- Etanol 96 % pa.
- Hidróxido de potasio pa.
- Bromuro de potasio, calidad espectroscópica.
Condiciones del estudio de estabilidad
Se almacenaron supositorios de 3 lotes (5001, 5002, 5003) elaborados a escala piloto a temperatura ambiente, en local climatizado (20-25 °C) y en refrigeración (8-15 °C), envasados en tiras de aluminio termosellable por 7 supositorios. El estudio se realizó durante 2 años, a partir de la elaboración. Se evaluaron periódicamente, a los 6, 12 y 24 meses, además a tiempo cero (sólo para ambiente climatizado), los parámetros siguientes: olor, color, condición de la superficie, textura y forma.Estabilidad tecnológica
Peso: se pesaron individualmente 10 supositorios en balanza analítica y se determinó la media (Tiempo de liquefacción: se realizó el ensayo por triplicado en el equipo Erweka acoplado al baño termostatado que se ajustó a 37 ± 0,5 °C. Se determinó ![]() y DE.
y DE.
Estabilidad química
Determinación del contenido de quitina por gravimetría directa: se aplicó la misma técnica gravimétrica directa utilizada para el control de calidad (Suárez Y. Op.cit). Se separó mecánicamente la quitina del excipiente previamente saponificado, a continuación se lavó el residuo sólido con solución hidroalcohólica y se secó hasta obtener peso constante a 105 ± 0,5 °C en la estufa. El contenido del fármaco se estimó por diferencia de peso.Expectroscopia IR: se determinó el espectro IR al residuo sólido seco que se obtuvo por gravimetría, se dispersó éste en fase sólida de bromuro de potasio. Estos espectros se compararon a lo largo del estudio entre sí.
Estabilidad microbiológica
Conteo microbiológico y diferencial: se procedió según la NC-26:121 de 198512 para medicamentos no estériles, que estableció no más de 100 microorganismos por gramo de supositorio y ausencia total de microorganismos patógenos. Los análisis se realizaron a los supositorios de los 3 lotes almacenados a temperatura ambiente, en el Departamento de Microbiología del Centro de Investigación y Desarrollo de Medicamentos.Procesamiento estadístico
Se utilizó el paquete estadístico Statistica para la evaluación del comportamiento de las variables peso, tiempo de liquefacción y contenido de quitina; considerando sus interacciones con el lote, la temperatura de almacenamiento y el tiempo, respectivamente.Para las variables continuas: peso y contenido de quitina se aplicó análisis confirmatorio para detectar diferencias estadísticas de p < 0,05 mediante pruebas de normalidad y homogeneidad de varianzas. Para el tiempo de liquefacción que resultó ser una variable discreta, se seleccionaron las pruebas de Kruskal-Wallis para el factor temperatura y la prueba de Friedman para el efecto del tiempo de almacenamiento.
RESULTADOS
La tabla 1 muestra los valores promedio obtenidos en la evaluación del peso, tiempo de liquefacción y contenido de principio activo cuantificado por gravimetría para cada lote y temperatura de almacenamiento estudiada (tabla 1).
| | | | ||||||||
| | | | ||||||||
| | | | | | | | | | ||
| Tiempo (mes) | | | | | | | | | | |
| | ||||||||||
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | ||||||||||
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | ||||||||||
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
Para el peso de los supositorios se detectaron por la prueba de Duncan diferencias significativas (p < 0,05) entre los 3 lotes. Sin embargo, el peso dentro de cada lote manifestó el mismo comportamiento en el tiempo y tampoco varió apreciablemente con la temperatura de almacenamiento, por lo que este parámetro resultó estable en las diferentes condiciones ensayadas durante los 24 meses de estudio.
El tiempo de liquefacción mostró para cada temperatura un comportamiento similar entre lotes, manifestando cierta tendencia al aumento. El análisis de varianza realizado por las pruebas Kruskal-Wallis, dio que las diferencias para este parámetro entre las temperaturas de almacenamiento fueron significativas. De igual forma, las diferencias resultaron estadísticamente significativas para las prueba Friedman con respecto al factor tiempo de almacenamiento (fig. 1).
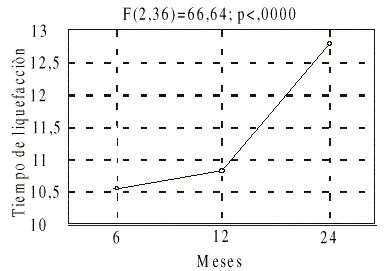
FIG.1. Efecto del tiempo de almacenamiento en el tiempo de liquefacción.
Sin embargo, según estos resultados el producto puede permanecer 24 meses en cualquiera de las temperaturas analizadas para su almacenamiento, independientemente del efecto causado sobre el tiempo de liquefacción. Se deben establecer 2 a como límite para el vencimiento, en aras de ofrecer un mayor margen de seguridad con respecto a la liquefacción, aunque otros autores refieren 30 min como límite.
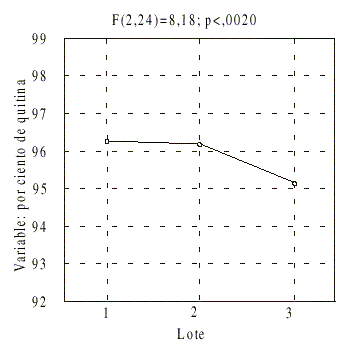
En relación con el contenido de quitina, mediante el análisis confirmatorio de los datos, se comprobó que el único factor del diseño que provocó diferencias significativas (p < 0,05) fue el lote, al conocer por la prueba de Duncan que las diferencias fueron del lote 5004 con respecto al resto (fig. 2).
Además se verificó que no existieron diferencias significativas para cada lote en el tiempo (fig. 3).
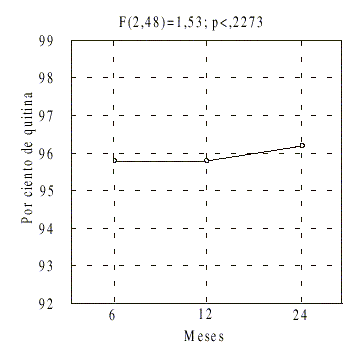
FIG.3. Efecto del tiempo de almacenamiento en el contenido de quitina.
Estos resultados fueron corroborados con el análisis cualitativo por espectrofotometría IR de los residuos procesados por gravimetría. Los espectros de los 3 lotes almacenados a temperatura ambiente transcurridos 2 a desde el momento de su producción, coincidieron plenamente en cuanto a localización e intensidad de las bandas características de los grupos funcionales (fig. 4).
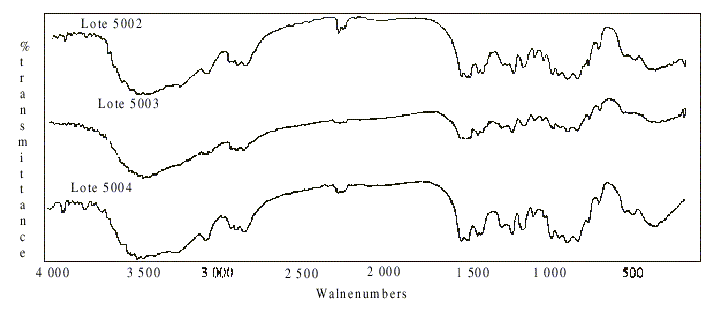
FIG.4. Espectros IR de los lotes 5002, 5003 y 5004 almacenados a temperatura ambiente 24 meses.
En la tabla 2 se presenta el conteo microbiológico aplicado a los 3 lotes almacenados a temperatura ambiente, llevados a cabo a los 6, 12 y 24 meses. Se demostró que también desde el punto de vista microbiológico el producto fue estable (tabla 2).
| Ensayo | | | | |
| Bacterias | | | | |
| | | | | |
| | | | | |
| Enterobacterias | | | | |
| | | | | |
| | | | | |
| Hongos | | | | |
| | | | | |
| | | | | |
| Microorganismo | | | | |
| aislado | | | | |
| | | | | |
| Resultados | | | | |
| | | | | |
| | | | |
DISCUSIÓN
Los supositorios de quitina 200 mg fueron estables desde el punto de vista fisico-mecánico. No se percibieron olores desagradables, cambios de coloración ni pérdida de la consistencia, incluso en aquellos supositorios almacenados a temperatura ambiente.No se manifestaron en ningún caso marcadas diferencias para los resultados entre lotes respecto al peso, lo cual fue indicativo de adecuada reproducibilidad durante el proceso de producción. El retardo observado en general para el tiempo de liquefacción fue mayor a medida que disminuyó la temperatura. Para los supositorios colocados a temperatura ambiente, al cabo del los 2 a, el tiempo de liquefacción osciló entre 11 y 12 min, valores inferiores al límite estipulado para las bases oleaginosas de 15 min. A medida que disminuyó la temperatura, se produjo una tendencia al endurecimiento de los supositorios, y resultó mayor el tiempo requerido para que ocurriera la liquefacción de éstos. La temperatura de refrigeración causó un endurecimiento tal, que al pasar 2 a los tiempos promedio se encontraron entre 13,5 y 14 min, valores muy próximos a los 15 min planteados como límite por algunos autores. Los supositorios almacenados en ambiente climatizado, presentaron tiempos de liquefacción intermedio, como era de esperar.
La menor cantidad de fármaco en el lote 5004 pudo ser atribuida a la pesada durante la elaboración. Esta disminución no afecta significativamente la calidad del producto, pues no afectó el peso ni la liquefacción, de modo que careció de interés. De manera que el contenido de quitina osciló ligeramente dentro del rango correcto de dosificación. Es bien conocido que la gravimetría carece de la especificidad requerida para su aplicación en estudios de estabilidad, pero al determinar los espectros IR a los residuos insolubles, pudimos descartar la posibilidad de degradación química por comparación de los resultados de cada muestreo en el tiempo.
La estabilidad de la quitina en el tiempo independientemente de la temperatura de almacenamiento, constituyó un resultado valioso y a la vez esperado, teniendo en cuenta los estudios de estabilidad realizados por Nieto en 1993 al polvo de quitina y la escasa posibilidad de interacción química quitina-excipiente.
Con la combinación de la gravimetría directa con la espectroscopia IR, garantizamos que los valores obtenidos en la cuantificación fueron debidos únicamente al fármaco inalterado presente en los supositorios.
La estabilidad química de esta nueva formulación también quedó confirmada. A pesar de las diferencias observadas para el contenido de principio activo entre lotes, todos los resultados se encontraron dentro del rango aceptable de 90 a 110 %.
Las tiras de aluminio termosellable que fueron utilizadas como envase, ofrecieron adecuada protección al supositorio. Los almacenados a temperatura ambiente cumplieron las exigencias para medicamentos no estériles. Por tal motivo pudiera considerarse adecuada esta temperatura para la conservación de este nuevo producto.
SUMMARY
Chitin suppositories are a new option in anorectal threapeutics, whose stability should be evaluated. The behaviour of 3 lots of suppositories made at a pilot scale and stored at 3 different temperatures by a period of 2 years was analyzed. Periodical checkings of the organoleptic properties, of the weight and liquefaction time parameters, as well as of the content of chitin were carried out by combining a gravimetric technique and infrared spectroscopy . The stability was investigated from the microbiological point of view by a differential count. The results were statisfactory for each evaluated parameter, since they were still within the limits for each of the assayed storage temperatures 2 years later.Subject headings: CHITIN/analysis; SUPPOSITORIES; DRUG STABILITY; DRUG STORAGE.
REFERENCIAS BIBLIOGRÁFICAS
- Muzzarelli RAA. Chitin. University of Ancona. Ancona: Pergamon;1977:9-26.
- Allan G, Altman L, Bensinger R, Ghosh D, Hirabayashi y, Neogi A, et al. Biomedical applications of chitin and chitosan. Chitin, chitosan and related enzymes. Part II. New York: Academic Press; 1984: 113-9.
- Balassa L, Prudden J. Applications of chitin and chitosan in wound healing acceleration. Proc.of the lst. Int Conf. On chitin/ chitosan. Muzzarelli and Pariser, 1984: 296-305.
- Prudden J, Migel O, Honson P. The discovery of a potent pure chemical wound healing accelerator. Am J Surg 1970 119:560-4.
- Valdés-Santurio JR. La estabilidad de los productos farmacéuticos IMEFA 1998;4 (5): 1-6.
- Lachamn L, Lieberman H, Kaning J. The theory and practice of industrial pharmacy. 3 ed. Philadelphia: Lea and Febiger; 1986:564-88.
- Iraizoz A, Bilbao O, Barrios MA. Conferencias de tecnología farmacéutica II. La Habana:Universidad, 1990:74-92.
- Galperin M. Sustancias poliméricas de organismos marinos: la quitina y la quitosana. Manuf Chemist 1984;55(9):73-5.
- Holan Z, Votubra J, Vlasakova V. New method of chitin determination based on deacetylation and gas liquid cromatographic assay of liberated acetic acid. J Chromatogr 1981; 190(2):67-76.
- López de Alba PL, López Martínez L, Guzman M. Determinación espectrofotométrica de la pureza de la quitosana mediante reacción con ninhidrina. An Chim 1990;86(7):801-4.
- Agullo E, Jeanneret B, Sadi S, Popovich L. Determinación polarográfica de quitina y quitosano. Cuantificación de quitina en artrópodos marinos. An Asoc Quim Argent 1988;76(5):347-54.
- Norma Cubana NC-26/121. Conteo microbiológico para medicamentos no estériles. 1985.
M. Yania Suárez Pérez. Instituto de Farmacia y Alimentos. Universidad de La Habana. Ave 23 No. 21425 entre 214 y 222, La Coronela, municipio La Lisa, Ciudad de La Habana, Cuba.
1 Máster en Tecnología y Control de Medicamentos.
2 Doctor en Ciencias Farmacéuticas.
3 Licenciado en Matemáticas.