Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.45 n.2 Ciudad de la Habana abr.-jun. 2011
PRODUCTOS NATURALES
Actividad antibacteriana de terpenoides y alcaloides aislados de tres plantas colombianas
Antibacterial activity of terpenes and alkaloids isolated from three Colombian plants
Luis Enrique Cuca SuárezI; Carlos Andrés Coy BarreraI; Ericsson David Coy BarreraII; José Manuel Lozano MorenoIII
IDoctor en Ciencias Químicas. Laboratorio de Investigación en Productos Naturales Vegetales. Facultad de Ciencias. Departamento de Química. Universidad Nacional de Colombia. Bogotá D.C., Colombia.
IIDoctor en Ciencias Químicas. Facultad de Ciencias Básicas, Universidad Militar Nueva Granada, Campus Universitario Rio Grande. Cundinamarca, Colombia.
IIIDoctor en Ciencias Farmaceúticas. Departamento de Farmacia. Facultad de Ciencias. Universidad Nacional de Colombia. Bogotá D.C., Colombia.
RESUMEN
El potencial antibacteriano de 14 compuestos obtenidos de 3 especies nativas colombianas (Pleurothyrium cinereum [van der Werff], Esenbeckia alata [Karst & Triana], y Raputia heptaphylla [Pittier]) fue evaluado mediante la inhibición del crecimiento bacteriano por el método de difusión en agar contra 4 cepas bacterianas: Enterococcus faecalis 29212, Staphylococcus aureus 6539, Escherichia coli 25922 y Salmonella tiphymurium 14028s. Los compuestos evaluados mostraron actividad frente a las cepas a diferentes niveles, observando una tendencia y selectividad según el núcleo base. El alcaloide 4-metoxi-1-metil-quinolin-2-(1H)-ona (8) fue el compuesto que presentó la mayor actividad.
Palabras clave: Actividad antibacteriana, Lauraceae, Rutaceae, alcaloides, terpenos.
ABSTRACT
The antibacterial potential of 14 compounds obtained from three native Colombian species( [Pleurothyrium cinereum [van der Werff], Esenbeckia alata [Karst & Triana], Reputia heptaphylla [Pittier]) was assessed by agar diffusion method versus four bacterial species: Enterococcus faecalis 29212, Staphylococcus aureus 6539, Escherichia coli 25922 and Salmonella tiphymurium 14028s. The assessed compounds showed activity versus strains at different levels, maintaining a trend and selectivity according the base nucleus. The 4-methoxi-1-methyl-quinolin-2-(1H) alkaloid, other (8) was the compound with the highest activity.
Key words: Antibacterial activity, Lauraceae, Rutaceae, alkaloids, terpenes.
INTRODUCCIÓN
En la actualidad, el hecho que los microorganismos autopromuevan resistencia a distintos antibióticos está estrechamente relacionado a su uso indiscriminado. Por ello, se hace necesaria la constante búsqueda de nuevas entidades químicas que puedan actuar, ya sea, directamente sobre los microorganismos o por inhibición de los mecanismos de resistencia de estos, sobre todo aquellas bacterias con importancia clínica. Las plantas medicinales representan una fuente muy importante para encontrar esta clase de compuestos.1 Cerca de 1340 plantas son posibles fuentes de agentes antibacterianos de un número aproximado de 25000 a nivel mundial.2 Como parte de la investigación enfocada a la búsqueda de sustancias bioactivas de la flora colombiana, en el presente trabajo, un grupo de 14 compuestos [thalicminina (1), pleurotirina (2), y acido kaurenóico (3) aislados de Pleurothyrium cinereum (Lauraceae); skimmianina (4), dictamnina (5), 3-metoxi-1-metil-(1H)-indol (6), 3-(benzo[1,3]dioxo-5-il)-N-fenetilacrilamida (7), 4-metoxi-1-metil-quinolin-2-(1H)-ona (8), ácido betulínico (9), lupeol (10), aislados de Esenbeckia alata (Rutaceae); y kokusaginina (11), flindersiamina (12), N-metil-8-metoxi-flindersina (13), N-metilflindersina (14), aislados de Raputia heptaphylla (Rutaceae)] fueron evaluados contra cepas de bacterias estándar grampositivas: Enterococcus faecalis 29212 y Staphylococcus aureus 6539 y gramnegativas: Escherichia coli 25922 y Salmonella tiphymurium 14028s, mediante el método de difusión en agar, bajo modificación del método previamente reportado.3 Las cepas bacterianas fueron utilizadas como modelo de patógenos humanos de alta incidencia en el país.
MÉTODOS
Materiales y equipos
Los espectros RMN 1H, RMN 13C y HMBC se tomaron en un espectrómetro BRUKER Avance 400, empleando CDCl3 como solvente; los desplazamientos químicos (d) se referenciaron a TMS como patrón interno (1H 400 MHz y 13C 100 MHz). Los espectros IR fueron tomados con KBr en un espectrómetro Perkin-FT-IR-Pannagon-500 serie 1000. Los espectros de masas por impacto electrónico (EM-IE) se tomaron en un instrumento Finnigan SSQ 710 a 70 eV. La cromatografía en columna (CC) se realizó utilizando sílica gel (Merck, 40-63 µm) y la cromatografía en capa delgada (CCD) empleando cromatoplacas Merck de sílica gel HF254 de 0,3 mm de espesor; los solventes utilizados se destilaron antes de su utilización, y fueron éter de petróleo (EdP), acetato de isopropilo (AcOIPr), metanol (MeOH), hexano (Hex), tolueno (Tol) y acetato de etilo (AcOEt).
Materiales vegetales
Las muestras de Pleurothyrium cinereum (van der Werff), Esenbeckia alata (Karst & Triana) y Raputia heptaphylla (Pittier) fueron colectadas en el 2005 en los municipios de Tumaco (departamento de Nariño), Colosó (Departamento de Sucre) y Albán (Departamento de Cundinamarca), respectivamente. Los especímenes se identificaron por los biólogos Ayda Lucía Patiño, Zaleth Cordero y Olimpo García, respectivamente. Una muestra de cada espécimen se depositó en el Herbario Nacional Colombiano, del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia bajo los números de colección COL518334 (P.cinereum), COL481090 (E. alata) y COL511102 (R. heptaphylla).
Extracción y aslamiento
Los materiales vegetales (hojas y corteza), secos y molidos, se sometieron a extracción por percolación con etanol al 96 % a temperatura ambiente, partiendo de 250 g de hojas de P. cinereum; 750 g de hojas y 800 g de corteza de E. alata; y 1,9 kg de hojas y 450 g de corteza de R. heptaphylla. El solvente fue independientemente retirado a presión reducida, obteniendo los correspondientes extractos etanólicos denominados PcH (21 g), EaH (70 g), EaC (96 g), RhH (80 g), y RhC (35 g). Los procesos detallados de fraccionamiento, purificación e identificación de los compuestos 1-3 aislados del extracto PcH, 4 y 10 de EaH, y 12-14 de RhH han sido previamente reportados.4-6 Adicionalmente, el extracto EaH se sometió a fraccionamiento sólido-líquido en un equipo Soxhlet, utilizando solventes en polaridad creciente: EdP (42 g), CHCl3 (3,4 g), AcOEt (8,5 g). Luego de purificaciones sucesivas por CC en gel de sílice con los extractos etanólicos, se aislaron los compuestos 5-77-9 de la fracción soluble en CHCl3, y 8-910,11 de la fracción AcOEt. El compuesto 117 se obtuvo del extracto RhC, luego de realizar un procedimiento de extracción ácido-base asistido por ultrasonido,12 con posterior purificación por CC sobre gel de sílice.
Medios para cultivo bacteriano y otros reactivos
Para los cultivos y subcultivos de las cepas grampositivas se utilizó caldo de tripticasa de soya (TSB; Difco Laboratories, Detroit, MI, USA). En los cultivos y subcultivos de las cepas gramnegativas se empleó base Luria Broth (LB; Gibco, Cerdanyola del valle, Barcelona, España). Para realizar la dispersión bacteriana en los ensayos de difusión radial se empleó medio dispersivo bajo en nutrientes preparado con 10 g de agarosa de baja electro endosmosis (Sigma Chem. Co, St. Louis, MO, USA), Tween-20 al 0,02 (v/v) (Merck, Darmstadt, Alemania) y 0,3 g de TSB (tripticasa de soya) (Difco Laboratories, Detroit, MI, USA) para un volumen final de un litro de solución. En la detección del crecimiento bacteriano se empleó un medio nutritivo revelador en una sobrecapa mediante la mezcla de los siguientes componentes: 20 g de agar-agar (Difco Laboratories, Detroit, MI. USA), tween-20 al 0,02 (v/v) (Merck, Darmstadt, Alemania) y 10 g de tripticasa de soya (TSB), buffer fosfato salino (PBS) pH 7,2-7,4 se preparó de la siguiente manera: 0,2 g KH2PO4, 32 g NaCl, 0,8 g de KCl, 4,6 de Na2HPO4 para un volumen de 1 L de solución. Como controles positivos se utilizaron los antibióticos ampicilina (A) 50,8 mg/mL, (Binotal; Bayer® Alemania), sulfato de kanamicina (K) 10,25 mg/mL (Gibco, Cerdanyola del valle, Barcelona, España), tetraciclina monohidratada (T) 4,12 mg/mL (Sigma Chem. Co, St. Louis, MO, USA).
Ensayo de atividad atibacteriana
La actividad antibacteriana se evaluó frente a cepas de bacterias grampositivas: Staphylococcus aureus ATCC 6538 y Enterococcuss faecalis ATCC 29212 y gramnegativas: Escherichia coli ATCC 25922 y Salmonella tiphymurium ATCC 14028s, aportadas para este estudio por el Profesor E. A. Groisman del Departamento de Microbiología Molecular de la Universidad de Washington, St. Louis, MO, USA. La actividad antibacteriana del compuesto se evaluó por la técnica de difusión radial adaptada de la metodología previamente publicada por Lehrer y otros3 y se realizó en la Fundación Instituto de Inmunología de Colombia (FIDIC), según el protocolo reportado previamente,10,13 obteniendo los respectivos % de inhibición de crecimiento bacteriano.
RESULTADOS
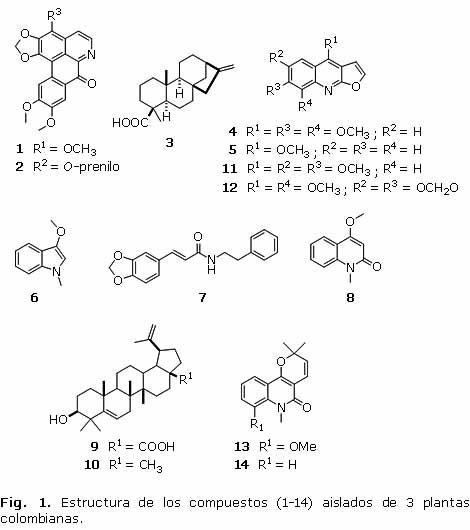
En la figura 1 se presentan las estructuras de los compuestos evaluados, los cuales fueron elucidados mediante el uso integrado de técnicas espectroscópicas [IR, EM, RMN 1H y 13C (1D y 2D)], correspondientes a 2 alcaloides aporfínicos (1-2), un diterpeno de núcleo kaurano (3), 4 alcaloides furoquinolínicos (4-5 y 11-12), 1 alcaloide indólico (6), 1 acrilamida (7), 1 alcaloide quinolónico (8), 2 triterpenos pentacíclicos (9-10), y 2 alcaloides piranoquinolónicos (13-14).
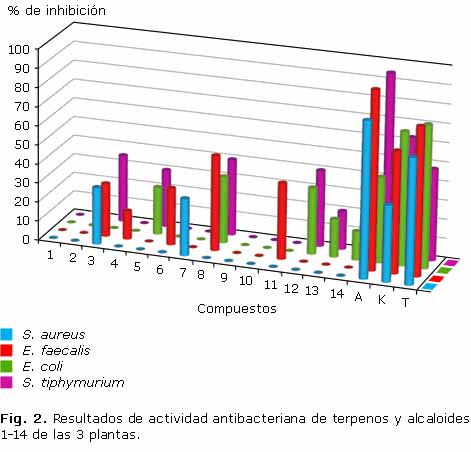
En la figura 2 se exponen los resultados del ensayo de inhibición de crecimiento de las cepas bacterianas evaluadas por el método de difusión en agar. De los 14 compuestos utilizados en este ensayo, los alcaloides de tipo oxoaporfínico (1-2) y los triterpenos pentacíclicos (9-10) no presentaron actividad contra las cepas evaluadas. Contrariamente, el diterpeno (3), los alcaloides quinolínicos (4-5, 8, y 11-14), el alcaloide indólico (6) y la acrilamida (7) presentaron actividad contra las cepas bacterianas a diferentes niveles.
DISCUSIÓN
Los 14 compuestos evaluados se aislaron previamente a partir de los extractos etanólicos obtenidos de las especies Pleurothyrium cinereum (van der Werff) (Lauraceae), Esenbeckia alata (Karst & Triana) (Rutaceae) y Raputia heptaphylla (Pittier) (Rutaceae),4-6 mediante métodos cromatográficos convencionales (CC, CCD preparativo), cuyas estructuras químicas (fig. 1) se determinaron por el uso combinado de técnicas espectroscópicas (RMN en 1D y 2D, IR, y EM) y por comparación con los datos reportados en la literatura.4-6
Varias de las especies de las familias Lauraceae y Rutaceae se utilizaron a nivel tradicional para el tratamiento de diversas infecciones,1,14 lo cual ha generado un aumento en el interés por determinar el(los) metabolito(s) responsable(s) de la actividad. En el presente caso, los compuestos obtenidos de estas 3 especies mostraron disposición hacia la actividad antibacteriana, aunque más baja que los controles positivos utilizados, presentando una clara tendencia en la selectividad por parte de algunos de los núcleos. Por ejemplo, los alcaloides quinolínicos (5 y 12-14) presentaron una actividad preferente con respecto a la inhibición de crecimiento de las cepas bacterianas gramnegativas. Sin embargo, se puede observar que, aunque la skimmianina (4) y la kokusaginina (11), son alcaloides furoquinolínicos, como la dictamina (5), la actividad fue selectiva hacia la cepa bacteriana S. faecalis (grampositiva), lo cual permite sugerir que la presencia de los 2 grupos metoxilo adicionales en el anillo quinolínico sería responsable de este hecho.
Adicionalmente, se observa que las furanoquinolinas presentan un mayor efecto inhibitorio que las piranoquinolinas, como es el caso de los compuestos 5 y 12-14. Para el caso de la acrilamida (7), presentó un efecto antibacteriano únicamente contra la cepa S. aureus, cuya característica de selectividad es compartida con los compuestos 4, 6 y 11 que fueron preferentemente activos contra E. faecalis, y 14 contra E. coli, lo cual resulta interesante desde el punto de vista farmacológico y clínico. Caso contrario, ocurrió con el diterpeno (3) y el alcaloide quinolónico (8), los cuales fueron activos tanto a cepas grampositivas como a gramnegativas, lo que indica una tendencia de amplio espectro. Los alcaloides de tipo oxoaporfínico (1-2) y los triterpenos pentacíclicos (9-10) no fueron activos en las condiciones del ensayo.
Teniendo en cuenta estudios anteriores de actividad antibacteriana con especies de la familia Lauraceae, se resaltan los estudios realizados a las especies del género Lindera,15,16 donde se ha encontrado que los aceites esenciales (constituidos principalmente por monoterpenos y sus derivados) poseen una actividad antibacteriana relevante, destacando la actividad de la especie Lindera strychnifolia, cuyo aceite esencial mostró concentraciones mínimas inhibitorias (CMI's) de 0,01, 6,25, y 3,13 mg/mL contra cepas de S. aureus, E. coli y S. typhimurium, respectivamente.15 Así mismo, ácidos endiándricos (denominados como ácidos beilschmiédicos-A, -B y -C) obtenidos de la corteza de Beilschmiedia anacardioides (Lauraceae), mostraron efectos antibacterianos, cuya actividad representativa fue dada por el ácido beilschmiédico-C, con una CMI de 22,7 µM contra S. faecalis.17 Adicionalmente, alcaloides aislados de especies de la familia Rutaceae han mostrado igualmente propiedades antibacterianas. Un ejemplo importante se tiene para el caso de especies del género Toddalia (Rutaceae), específicamente de la especie Toddalia aculeata,18 cuyos alcaloides del tipo 2-quinolona mostraron inhibición de crecimiento bacteriano con porcentajes alrededor de 70 % contra E. coli a 16 mg/mL, lo cual está acorde con lo encontrado para los alcaloides 8, 13 y 14; y de la especie Toddalia asiática,19 de la cual se obtuvo la flindersina, un alcaloide piranoquinolónico (precursor biosintético de los alcaloides 13 y 14), el cual presentó MIC's muy significativos con valores de 62,5, >250, y 31,25 µg/mL contra S. aureus, E. coli y E. faecalis, respectivamente. Por otro lado, aunque los alcaloides furanoquinolínicos presentan una baja actividad, nuestros resultados mostraron que el alcaloide skimmianina (4) presentó actividad contra S. typhimurium y E. coli, pese a que reportes previos mostraron lo contrario.20
Todos estos resultados permiten establecer que los compuestos que presentaron actividad, servirían como cabezas de serie para posteriores estudios de relación estructura-actividad con el fin de realizar una optimización estructural que conlleve a la obtención de sustancias más activas. No obstante, se requieren estudios adicionales enfocados al esclarecimiento de la forma de acción de estos compuestos en las bacterias con la intención de alcanzar conclusiones inambiguas.
AGRADECIMIENTOS
Agradecemos al Departamento de Química de la Universidad Nacional de Colombia, sede Bogotá, a la División de Investigaciones de Bogotá (DIB) (Código de Proyecto No. 8003383, de 2009), y al Instituto Francisco José de Caldas-Colciencias, por la financiación de este trabajo. Agradecemos también al Laboratorio de Resonancia Magnética Nuclear de la Universidad Nacional de Colombia, por el registro de los espectros RMN.
REFERENCIAS BIBLIOGRÁFICAS
1. Gibbons S. Anti-staphylococcal plants. Nat Prod Rep. 2004;21:263-77.
2. Cowan MM. Plant products as antimicrobial agents. Clin Microbiol Rev. 1999;12:564-82.
3. Lehrer R, Rosenman M, Jackson R, Einsenhauer P. Ultrasensitive assays for endogenous antimicrobial polypeptides. J Immunol Meth. 1991;137:167-73.
4. Coy ED, Cuca, LE. Nuevo alcaloide oxoaporfínico y otros constituyentes químicos aislados de Pleurothyrium cinereum (Lauraceae). Rev Colomb Quim. 2008;37:127-34.
5. Cuca LE, Coy CA. Metabolites Isolated from Esenbeckia alata (Karst & Triana) Rutaceae. Biochem Syst Ecol. 2007;35:386-8.
6. Coy CA, Cuca LE, Delgado LG, Muñoz DL, Robledo S, Granados,D. Estudio de la actividad leishmanicida e inmunomoduladora de extractos y compuestos de origen vegetal (especies colombianas). Biomédica. 2010;30(Suppl. 1):75-6.
7. Bhattacharya J, Serur LM, Cheriyan UO. Isolation of alkaloids of Monnieria trifolia. J Nat Prod. 1984;47:379-81.
8. Selvakumar N, Redi B-Y, Azhagan AM, Kher MK, Babu JM, Iqbal J. A direct entry to the 1-methoxyindole skeleton and to the corresponding indoles by a novel rearrangement: general syntheses of substituted 1-methoxyindoles. Tetrahedron Lett. 2003;44:7065-9.
9. Bohlman F, Zdero C, King RM, Robinson H. Phenylethylamide aus Critoniella acuminata. Planta Med. 1984;50:187-8.
10. Cuca LE, Patarroyo ME, Lozano JM, Delle Monache F. Biological activity of secondary metabolites from Peltostigma guatemalensis. Nat Prod Res. 2009;23:370-4.
11. Mahato S, Kundu A. 13C NMR spectra of pentacyclic triterpenoids a compilation and some salient features. Phytochemistry. 1994;37:1517-75.
12. Li H, Chen B, Yao S. Application of ultrasonic technique for extracting chlorogenic acid from Eucommia ulmodies Oliv. (E. ulmodies). Ultrason Sonochem. 2005;12:295-300.
13. Cuca LE, Bernal FA, Coy CA, Coy ED. Essential oil composition and antimicrobial activity of fruits of Iryanthera ulei W. from Colombia. J Chil Chem Soc. 2009;54:363-5.
14. Evans WC, Trease WC. Pharmacognosy. 14. ed. London: W. B. Sanders Company LTD; 1996. p. 37, 253, 340, 341, 496.
15. Yan R, Yang Y, Zeng Y, Zou G. Cytotoxicity and antibacterial activity of Lindera strychnifolia essential oils and extracts. J Ethnopharmacol. 2009;121:451-5.
16. Comai S, Dall'Acqua S, Grillo A, Castagliuolo I, Gurung K, Innocenti G. Essential oil of Lindera neesiana fruit: Chemical analysis and its potential use in topical applications. Fitoterapia. 2010;81:11-6.
17. Chouna JR, Nkeng-Efouet PA, Lenta BN, Devkota KP, Neumann B, Stammler HG, et al. Antibacterial endiandric acid derivatives from Beilschmiedia anacardioides. Phytochemistry. 2009;70:684-8.
18. Jain SC, Pandey MK, Upadhyay RK, Kumar R, Hundal G, Hundal MS. Alkaloids from Toddalia aculeata. Phytochemistry. 2006;67:1005-10.
19. Duraipandiyan V, Ignacimuthu S. Antibacterial and antifungal activity of Flindersine isolated from the traditional medicinal plant, Toddalia asiatica (L.) Lam. J Ethnopharmacol. 2009;123:494-8.
20. O'Donnell F, Smyth TJP, Ramachandran VN, Smyth WF. A study of the antimicrobial activity of selected synthetic and naturally occurring quinolines. Int J Antimicrob Agents. 2010;5:30-8.
Recibido: 30 de noviembre de 2010.
Aprobado: 9 de enero de 2011.
Dr. Ericsson David Coy Barrera. Laboratorio de Investigación en Productos Naturales Vegetales. Facultad de Ciencias. Departamento de Química. Universidad Nacional de Colombia. Carrera 30 No. 45-03, AA 14490. Bogotá D.C., Colombia. Correo electrónico: edcoyb@unal.edu.co