Introducción
El cáncer de próstata (CaP) constituye un serio problema de salud en el mundo occidental; se estima que uno de cada seis hombres desarrollará la enfermedad en el transcurso de su vida.1 En el 2013, la incidencia a nivel mundial fue de 1,4 millones de nuevos casos y 293 000 muertes.2 Es el segundo tumor más frecuente después del cáncer de pulmón y la quinta causa de muerte en los hombres a nivel mundial.3 En México, (en el 2013), los tumores malignos ocuparon el tercer lugar como causa de muerte en los hombres (10.5 %) y de estos, el CaP fue el más frecuente (16,3 %).4
Dada la relevancia clínica, social y las implicaciones para el sistema de salud, se han desarrollado métodos como complemento diagnóstico, entre los cuales se encuentran marcadores séricos como el antígeno prostático específico (APE) y sus variantes, y marcadores urinarios como son el prostate cancer antigen 3 (por sus siglas en inglés PCA3) y el transmembrane protease, serine 2 (por sus siglas en inglés TMPRSS2).1,5 Las dos herramientas principales para la detección precoz del CaP son el tacto rectal (TR) y el APE.1 Se estima que la introducción de la prueba de APE podría reducir la mortalidad por CaP entre un 20 y 30 %, entre un 20 y 40 % de los casos detectados por esta prueba se sobrediagnostican.6 Desde su aparición en la década de los 70, el APE se ha empleado en la práctica clínica para el diagnóstico, el cribado y el seguimiento del CaP.7 El diagnóstico depende de la confirmación histopatológica de cáncer.7 Aunque se considera que la utilización del APE como marcador sérico ha revolucionado el diagnóstico de CaP,7,8,9 sabemos que es un marcador específico de órgano, pero no específico de cáncer.7 Se han reportado niveles elevados de APE en hiperplasia benigna de próstata, prostatitis, retención aguda de orina, biopsia de próstata, y después de un masaje prostático.7 Más aun, tejidos extraprostáticos humanos que pueden producir proteínas similares al APE, como los tejidos y líquidos que rodean lesiones benignas y malignas de mama.7
Por otra parte, varios investigadores, demostraron que como variable independiente, el APE sérico (APEs; cuantificado mediante ensayo inmunoenzimático Tándem-E o ensayo inmunoradiométrico Tándem-R; Hybritech) es mejor predictor de CaP que el tacto rectal o la ecografía transrectal. Este marcador de tejido prostático está presente en el suero en varias formas,7 de las cuales, la forma libre (APEl) es la más importante y forma un complejo con la α1-antiquimotripsina.7,10,11 Estas formas, han demostrado su utilidad para evaluar la enfermedad de la próstata.7,12,13,14
Se ha establecido que cuando el APE es mayor que 10 ng/mL, la probabilidad de CaP es del 50 %15 y cuando su concentración está entre 4 y 10 ng/mL, la probabilidad de este cáncer es del 25 %.7 En consecuencia, el valor absoluto del APEs es útil para determinar el alcance del CaP y evaluar la respuesta al tratamiento.15 Su uso como prueba de tamizaje es controversial, aunque su práctica es común.15 Además, para los pacientes que presentan concentraciones de entre 4-10 ng/ml, se recomienda realizar una biopsia de tejido prostático, pero este enfoque conduce a la práctica de muchas biopsias innecesarias.7
Por su parte, Miano y otros, con la finalidad de aumentar la tasa de aceptación y reducir el costo del programa de detección de CaP, evaluaron una prueba cualitativa para APE, llamada prostatic specific antigen (PSA) RapidScreen, la cual, es un inmunoensayo de flujo lateral cromatográfico, que genera un resultado positivo o negativo para los valores de APE ≥ o < 4 ng/ml, respectivamente.6 Los investigadores, en relación a la prueba rápida, reportaron valores elevados de sensibilidad (97,6 %), especificidad (90,4 %), precisión (94 %), valores predictivos negativos (98 %) y positivos (89 %), con una reproducibilidad del (99,5 %) y una variación inter-observador del (5 %)6 Además, reportaron una buena correlación entre la intensidad de la banda (obtenida mediante la prueba rápida) y el valor del APE (r = 0,87; t = 23,97; p<0,001), por lo que recomendaron la aplicación de la prueba rápida para la detección de CaP. Sus datos derivan de un tamaño de muestra bajo (n=188 hombres), de un estudio sin un método de muestreo y una población especifica de Italia (sin representatividad nacional).
Por otra parte, existe la necesidad de una toma de decisión compartida entre la comunidad académico-científica, los gobiernos, la sociedad y los sistemas de salud, para optimizar los recursos en la detección oportuna de pacientes con CaP. Al día de hoy no se ha alcanzado un consenso sobre el mejor enfoque para realizar el tamizaje y la detección precoz del CaP, en la población.16 Debido a ello, la Organización Mundial de la Salud (OMS) todavía no ha desarrollado recomendaciones específicas encaminadas a los tomadores de decisión, para el tamizaje del CaP. Ha publicado guías sobre los requisitos de los sistemas de salud para establecer programas de tamizaje y detección temprana del cáncer.16,17,18,19,20,21 Al día de hoy no se ha alcanzado un consenso sobre el mejor enfoque para realizar el tamizaje y la detección precoz del CaP, en la población. El objetivo fue correlacionar los resultados obtenidos de la prueba rápida de APE (APEr) con los resultados de la prueba de APEs.
Métodos
Se diseñó un estudio descriptivo, observacional y transversal para analizar la correlación entre ambas pruebas de APE. La obtención de datos se realizó mediante un diseño retrospectivo, con información procedente del período entre el 25 de mayo al 13 de julio de 2017. El estudio se llevó a cabo durante el mes de febrero de 2018.
Se incluyó una muestra no probabilística por conveniencia, de 1 635 registros de hombres, procedentes de la Clínica de Detección y Diagnóstico Automatizados (CLIDDA) del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE), en la Ciudad de México, México. La muestra se caracterizó por hombres mayores de 40 años, o menores con factores de riesgo para CaP. Estos registros se emplearon para contestar si: ¿Los resultados de la prueba APEr correlacionan con los valores de la prueba de APEs? Como objetivo secundario se planteó determinar los coeficientes de correlación para los quintiles de edad (Q1-Q5) y lugar de residencia. Se excluyeron registros con información incompleta.
Prueba de antígeno prostático específico sérica y prueba rápida (en casete).
Para la cuantificación del APEs, se empleó el ensayo Access Hybritech PSA (Cat. Núm. 37200), el cual es un inmunoensayo (ensayo inmunoenzimático de dos posiciones “sandwichˮ) de quimioluminiscencia de partículas paramagnéticas. Este ensayo cuantifica los niveles totales del antígeno prostático en suero humano.
Se añade una muestra a un vaso de reacción con conjugado de fosfatasa alcalina anticuerpo monoclonal murino anti-APE y partículas paramagnéticas recubiertas de un segundo anticuerpo monoclonal murino anti-APE. El APE en la muestra se une al anticuerpo monoclonal anti-APE inmovilizado en la fase sólida, y al mismo tiempo, el conjugado de fosfatasa alcalina (anticuerpo monoclonal anti-APE) reacciona con diferentes lugares antigénicos en el APE de la muestra. Tras la incubación en un vaso de reacción, los materiales unidos a la fase sólida son retenidos en un campo magnético mientras que los materiales que no han quedado unidos a la fase sólida se eliminan mediante lavado. A continuación, se añade al vaso de reacción el sustrato quimioluminiscente Lumi-Phos 530 y se mide la luz generada por la reacción mediante un luminómetro. La producción de luz es directamente proporcional a la concentración de APE en la muestra. La cantidad de analito en la muestra se determina a partir de una curva de calibración de puntos múltiples almacenada.
La prueba rápida que se empleó fue SERATEC® PSA SEMIQUANT. Esta prueba es un inmunoensayo cromatográfico para la detección rápida y semicuantitativa de APE; inicialmente se utilizó en muestras forenses, posteriormente se amplió para la detección de niveles de antígeno prostático como prueba de escrutinio como sucede en este caso. El producto contiene como componentes activos dos anticuerpos monoclonales murinos dirigidos contra el APE humano. Las muestras se recogieron de forma paralela y se analizaron simultáneamente.
Variables de estudio y recolección de datos
Los valores de ambas pruebas se recopilaron en una base de datos administrativa, la cual incluye información de identificación del paciente como folio, nombre, clave única de registro poblacional, edad (en años cumplidos), lugar de residencia, resultado de la prueba rápida y concentración sérica de antígeno prostático y fecha de obtención de las muestras.
Análisis estadísticos
Las variables categóricas se describen como frecuencia absoluta y relativa (a manera de porcentaje) con su intervalo de confianza de 95 % (IC95 %). Todos los (IC95 %), para las variables categóricas, se obtuvo un muestreo de tipo bootstrap de 1 000 repeticiones.
Las variables cuantitativas se describen como media, desviación estándar (DE), valor mínimo y máximo, rango, mediana (Md) y rango intercuartílico (RI). Las variables categóricas se compararon usando la prueba de Chi cuadrado. Para el análisis de correlación se determinaron los coeficientes de correlación punto biserial (rpb) y phi (r phi ). Un valor de p<0,05 (prueba a dos colas) fue considerado significativo.
Consideraciones éticas
El presente estudio se llevó a cabo de conformidad con las Guías de Práctica Clínica, Normas y Programas incluidas en nuestras leyes y la Declaración de Helsinki. El protocolo fue aprobado por los Comités Institucionales de Investigación, Ética en Investigación y Bioseguridad, de la Dirección Médica del ISSSTE.
Para garantizar el anonimato de los participantes, los datos correspondientes a su identificación fueron tratados de manera confidencial y se asignó una clave de identificación. Sólo los investigadores que realizaron el análisis estadístico tuvieron acceso a la base de datos.
Resultados
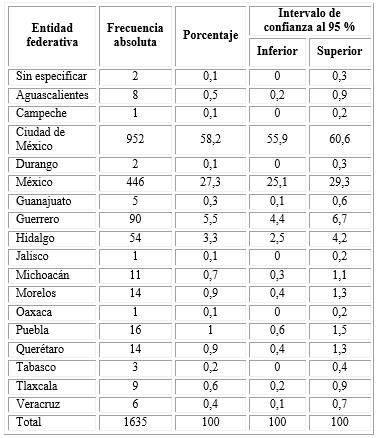
De un total de 1 643 registros, se incluyó la información de 1 635 y se excluyeron 8. Del total de 1 635 registros analizados, la gran mayoría corresponde a hombres residentes de la Ciudad de México y el Estado de México n= 1 398; 85,5 %, IC95 % 81-89,9; (Tabla 1).
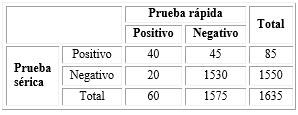
La edad promedio de los pacientes fue de 51 años cumplidos (desviación estándar; DE= 7,68; mediana= 51, rango= 45, mínimo= 38, máximo= 83, RI= 45-56). El valor promedio obtenido, de antígeno prostático, mediante la prueba sérica fue de 1,49 ng/mL (DE= 1,91; mediana= 1,00; rango= 26,56; mínimo= 0,03, máximo= 26,59; RI= 0,61-1,67). La proporción de hombres con una prueba rápida de antígeno prostático positiva (n=60; 3,7 %; IC95 % 2,9-4,6) fue significativamente menor (p= 0,0415) en comparación a la proporción de pacientes con una prueba sérica ≥ 4ng/mL (n= 85; 5,2 %; IC95 % 4,1-6,3). El número de casos dobles negativos fue de 1 530 (93,6 %; IC95 % 92,3-94,6) y dobles positivos de 40 (2,4 %; IC95 % 1,7-3,2). Se observó un menor número de casos con un resultado positivo para la prueba rápida y una concentración menor de 4ng/ml para la prueba sérica (casos= 20; 1,2 %, IC95 % 0,7-1,8) en comparación con los casos con una concentración ≥ 4 ng/m y negativos para la prueba rápida (casos= 45; 2,8 %; IC95 % 2,0-3,5) (Tabla 2).
Tabla 2 Comparación entre los casos positivos y con una concentración igual o mayor que 4 ng/mL entre las pruebas para antígeno prostático rápida y sérica; respectivamente
Análisis de los coeficientes de correlación global punto biserial y phi.
Al realizar los análisis de correlación, se observó una correlación baja entre la positividad de la prueba rápida (variable dicotómica) y la concentración sérica de antígeno prostático (rpb= 0,469; p < 0,001; r2= 0,2199 (Fig 1).

Fig 1 Gráfico de dispersión de la correlación punto biserial entre la concentración sérica de antígeno prostático en relación al resultado de la prueba rápida.
De manera similar, al realizar el análisis de correlación phi, observamos una correlación baja (r phi = 0,540; p < 0,001; r2= 0,2916) entre la positividad de la prueba rápida y la prueba sérica. (Para este análisis, la concentración sérica del antígeno prostático, se convirtió a una variable dicotómica se tomó como punto de corte una concentración ≥ 4 ng/ml; que es el punto de corte de la prueba rápida).
Análisis de los coeficientes de correlación punto biserial y phi, por quintiles de edad
Al analizar los datos por quintiles de edad y con dos diferentes puntos de corte para la concentración de antígeno prostático (primer punto de corte ≥ 4 ng/ml y segundo punto de corte ≥ 10 ng/mL), pudimos observar que, con un punto de corte más estricto, el coeficiente de correlación phi proporciona coeficientes muy similares a los observados por el análisis de correlación de punto biserial (Tabla 3).
Tabla 3 Coeficientes de correlación punto biserial y phi entre las pruebas para antígeno prostático rápida y sérica, de acuerdo a la distribución de los pacientes, por quintiles de edad
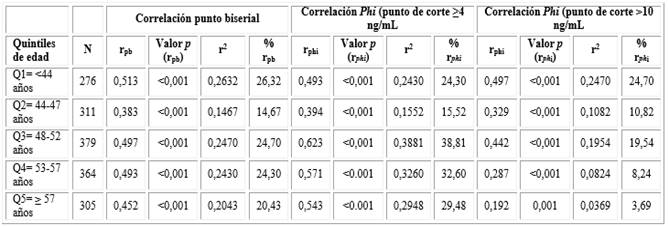
Aunque todos los análisis de correlación son estadísticamente significativos a un nivel de confianza mayor del 99 % (0,01), todas las correlaciones son bajas (tabla 3), lo que fue similar a lo encontrado en el análisis global de la población de estudio.
Análisis de los coeficientes de correlación punto biserial, por entidad federativa
Al realizar los análisis de correlación de punto biserial por lugar de residencia, observamos que para varias entidades federativas no es posible, debido a que al menos una variable es constante. Por otra parte, (para las entidades que si se pudieron analizar) los coeficientes de correlación se elevan al disminuir el tamaño de muestra (r2= 0,9047). Para la población de las entidades federativas de Aguascalientes y Veracruz, los valores de correlación son muy altos (r2= 0,9761 y r2= 0,9811;), por arriba del 95 %; el tamaño de la muestra en ambas entidades es muy bajo (Aguascalientes= 8 y Veracruz= 6). Para el Estado de Hidalgo, con un tamaño de muestra bajo (n= 54), el coeficiente de correlación es aceptable (r2= 0,7639) (Tabla 4).
Tabla 4 Coeficientes de correlación punto biserial entre las pruebas para antígeno prostático rápida y sérica, de acuerdo a la distribución de los pacientes, por entidad federativa
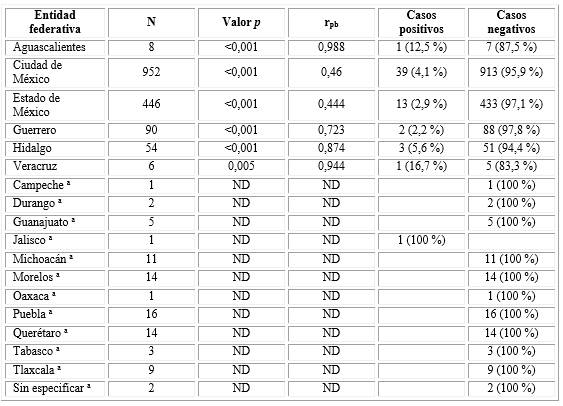
a No se puede calcular porque al menos una variable es constante. Fuente: Elaboración propia con datos de los registros de la base de datos.
En relación a los estados con tamaños de muestra mayores pudimos observar coeficientes de correlación bajos. Para los residentes del Estado de Guerrero, el coeficiente de correlación es un poco mayor del 52 % (r2= 0,5227). Mientras que, para los residentes de la Ciudad de México (r2= 0,2116) y el Estado de México (r2= 0,1971) son más bajos (Tabla 4).
Por otra parte, los valores de la mediana correspondientes a las concentraciones séricas de antígeno prostático por quintiles de edad difieren por cada quintil analizado, en el grupo de pacientes con prueba rápida positiva (figura 2). Sin embargo, los valores de la mediana en el grupo de pacientes con una prueba rápida negativa son similares entre los grupos (Fig 2).
Discusión
Con la finalidad de mejorar la aceptación y reducir el costo ejercido de los programas de detección del CaP, se han realizado evaluaciones para comparar los resultados de las pruebas de APEr en relación a la prueba de APEs.6 Como resultado, se ha recomendado el empleo de la prueba rápida, como prueba de tamizaje, para la detección temprana de CaP.6 Aunque la detección de CaP e uno de los temas más controvertidos en oncología, es bien sabido que el examen rectal digital y la prueba de APE, usados en conjunto, son las herramientas más útiles y efectivas para diagnosticar el carcinoma de próstata.6,9,22,23 Además, se considera que el uso generalizado de las pruebas de APE es un factor determinante que ha llevado a un aumento significativo en el diagnóstico y una disminución en las tasas de mortalidad por CaP.6,24,25,26,27
Otros factores que influyen en la detección oportuna de CaP, incluyen la tasa de aceptación del programa, la tasa de participación de los pacientes, la factibilidad y viabilidad de los procedimientos técnicos y administrativos, la disponibilidad de los recursos financieros, materiales y humanos, y el tiempo de entrega de los resultados de las pruebas realizadas. En relación a la tasa de aceptación de los programas de detección y control médico para el diagnóstico de CaP, se ha reportado que esta tiene una variación que va desde una participación del 22,7 al 74 %.6,28,29,30 Asimismo, se reconoce que los programas de detección oportuna tienen una mayor aceptación por parte de los pacientes cuando su diseño implica un procedimiento simple, no invasivo y de “un díaˮ;6,31 mientras que, la aceptación por parte de los servicios que integran el Sistema de Salud debe cumplir varias características específicas, entre las que se considera que sean de bajo costo, alta sensibilidad y disminuyan la sobre-detección de casos.6 Por ende, la resolución de estas condiciones mejoraría la aceptación de los programas de detección oportuna en todo el mundo.
Aunque la prueba APEr es una prueba simple y reproducible de un solo paso, de bajo costo y su velocidad de realización la convierten en una herramienta poderosa y conveniente para los programas de detección del CaP, la investigación indica que es de baja sensibilidad (66,7 %), con un valor predictivo positivo (47 %) y un coeficiente de correlación bajos, en relación a la prueba sérica. Lo que es diferente a lo reportado por Miano y otros, quienes reportan una alta correlación entre ambas pruebas (r=0,87; t=23.97; p<0,001)6 Un resultado positivo de la prueba rápida no descarta la necesidad de una medición cuantitativa precisa de APEs. Sin embargo, en presencia de un resultado negativo, esta prueba siempre debe integrarse con el examen rectal digital para excluir la posibilidad de CaP.32
La principal limitación de esta prueba parecen ser la baja sensibilidad donde la posibilidad de detección de CaP es menor al 70 %, por lo que se necesita más precisión para la identificación de sujetos enfermos, sin embargo, en centros de salud localizados en zonas rurales, clínicas de medicina familiar que carecen de servicios de laboratorio, comunidades con acceso limitado a los servicios de salud (inequidad sanitaria), su utilidad sería buena a pesar de su baja sensibilidad. En consecuencia, el desarrollo de pruebas de APEr se debe centrar no sólo en que sean pruebas cuantitativas desechables, fácilmente disponibles y autoadministradas, sino que tengan una sensibilidad aceptable y que sean precisas, otro límite de la investigación es el sesgo derivado a un estudio que no realizó un muestreo probabilístico, por lo que la inclusión de personas de otras regiones del país fue menor; nuestros datos derivan principalmente con personas procedentes de la Ciudad de México y el Estado de México., el análisis por la entidad federativa permitió encontrar que las correlaciones disminuyen al incrementarse el tamaño de la muestra analizada. Por lo que se requiere ampliar el tamaño de la muestra para otras entidades federativas y así poder tener una representatividad nacional.
El tamizaje del CaP es un tema controvertido debido a que al inicio se tomaron decisiones sobre la adopción de pruebas de APE en ausencia de estudios que evaluaran datos de eficacia procedentes de ensayos aleatorizados.15 Y todavía existe poca literatura que evalúa el tamizaje de CaP basado en el APE. Schröder y otros22, reportan que el tamizaje basado en la prueba de APEs se asocia con una reducción de la tasa de muerte por CaP en un 20 %, pero se observa un alto riesgo de sobrediagnóstico.32Pron y otros,33 posterior al análisis de 5 revisiones sistemáticas y 6 ensayos aleatorizados controlados, indica que en ninguna de las revisiones sistemáticas analizadas encontró una reducción estadística significativa en el riesgo relativo de mortalidad por CaP o de la mortalidad general asociado a un tamizaje basado en el APEs.34
No obstante, encontró que las reducciones de mortalidad de CaP varían según el país, el programa de detección y la edad de los hombres al ingresar al estudio.33 El estudio aleatorizado europeo para la detección del CaP encontró una reducción del riesgo relativo alrededor del 44 % en la mortalidad de pacientes con este cáncer a los 13 años de seguimiento (0,79; IC95 % 0,69-0,91; p=0,001)33 Los esfuerzos para diseñar estudios sobre tamizaje basado en la prueba de APEs todavía son pocos y basados en el empleo de pruebas rápidas, no se han reportado. En la práctica clínica se recomienda el uso de pruebas rápidas para la detección de APE y se han reportado estudios descriptivos con muestreos no probabilísticos por conveniencia con el uso de diferentes pruebas. Torrijos y otros,34 en una población procedente de Valencia España reportan que con el uso de la prueba SD Bioline se detectan casi un 50 % de hombres con concentraciones > 3 ng/mL de APE34 a diferencia de la baja proporción de casos que observamos en nuestra población de estudio. Sin embargo, al emplear un punto de corte diferente al de la prueba comercial empleada para el estudio, las proporciones encontradas no son comparables. Por otra parte, Miano y otros, a través de una prueba de inmunocromatografía de flujo lateral encontraron que la proporción de casos positivos (>4 ng/mL) fue muy elevada6 (45 %) en comparación con el hallazgo (3,7 %). A su vez, encontraron una correlación significativa entre la interpretación de positividad de la prueba rápida y la concentración del APEs (r= 0,87; p<0.00000001).6 Este coeficiente sugiere que las pruebas tienen una alta correlación entre ellas (75,69,%). Estos datos son diferentes al hallazgo.
El análisis global de nuestra población (n= 1635), muestra una baja correlación (rpb= 0,469; p<0,001; r2= 0,2199), con una diferencia de 53,7 puntos porcentuales en comparación con los valores encontrados por Miano y otros.6 Además, al comparar los datos de correlación de los hombres procedentes del Estado de Hidalgo (n=54), se observa que el coeficiente de correlación es igual al reportado por Miano y otros6 (n=54). Más aún, al comparar los coeficientes de correlación por residencia pudimos demostrar que la correlación depende del tamaño de la muestra de la población, lo que sugiere la presencia de otras variables que afectan el resultado. Los datos sugieren que a mayor tamaño de la muestra la correlación es menor. Lo cual explica la diferencia encontrada al comparar los datos con lo reportado en la población italiana.
Se concluye que la prueba de antígeno prostático específico rápida es una herramienta conveniente para los programas de detección de alteración prostática en unidades médicas del primer nivel de atención, donde la prueba sérica no se puede realizar, sin embargo, al ser una prueba con una baja sensibilidad y con un bajo coeficiente de correlación respecto de la prueba de antígeno prostático específico sérica, esto es un punto importante que debe considerarse al diseñar programas de detección oportuna de cáncer de próstata.