Introducción
El mieloma múltiple (MM) está caracterizado por una expansión clonal de células plasmáticas neoplásicas en la médula ósea, así como la producción de una inmunoglobulina monoclonal; además, se acompaña frecuentemente de citopenias, lesiones osteolíticas, hipercalcemia y daño renal. Por tanto, es responsable del 15-20 % de las muertes por hemopatías malignas y del 2 % de todas las muertes por cáncer. Constituye la segunda neoplasia hematológica más frecuente, que representa el 1% de todos los tipos de cáncer y es una enfermedad de paciente de edad avanzada, pues el 80 % de los casos tienen 60 o más años, con una edad media al diagnóstico de alrededor de 68 años.1
Se estima que en Europa la incidencia es de 4,5 a 6,0 casos por 100 000 habitantes por año.2 En Estados Unidos se estima que en el año 2018 se diagnosticaron 30 770 nuevos pacientes con MM, por lo que representó el 1,8 % de todos los casos de cáncer, con una prevalencia en el año 2015 de 124 733 casos.3 En Cuba, según el Registro Nacional de Cáncer, la incidencia de MM es bastante significativa, con más de 1 300 casos entre los años 2011 y 2014.4
En las últimas dos décadas se ha producido una mejoría progresiva de la supervivencia de los pacientes con MM, atribuible al desarrollo e incorporación en la práctica clínica de fármacos muy eficaces como los inmunomoduladores, los inhibidores del proteosoma, los anticuerpos monoclonales, así como el trasplante de progenitores hematopoyéticos autólogo (TPHa). Esto ha permitido que las medianas de supervivencia se hayan incrementado de 45 a 83 meses, lo que ha evidenciado mejoras en el pronóstico.5
Se considera que el TPHa es el tratamiento estándar de primera línea en el paciente joven, menor de 65 años, o hasta 70 años en buena condición clínica.6 Se debe considerar que el estado de salud y las comorbilidades son factores más importantes que la edad cronológica máxima para la realización del trasplante, este ha demostrado ser de valor para alcanzar o consolidar una respuesta completa (RC) después de un tratamiento de inducción basado en la quimioterapia triple o con nuevos agentes, y se recomienda que se realice después de 4 a 6 ciclos de quimioterapia.7
Actualmente, los pacientes con MM son la principal indicación de realización de TPHa, con un crecimiento sostenido de acuerdo a las estadísticas reportadas por el Centro para la Investigación Internacional de Trasplantes de Sangre y Médula, (CIBMTR, por sus siglas en inglés).8
En el Servicio de Hematología del hospital en estudio en el año 2009 se inició el TPHa como parte de la terapéutica del MM para poder incorporarnos a las tendencias mundiales en el manejo de esta neoplasia.
Esta investigación tuvo el objetivo de evaluar los resultados del trasplante de progenitores hematopoyéticos autólogo en pacientes con mieloma múltiple, a partir de los resultados obtenidos en el TPHa en el hospital en estudio en un grupo de enfermos con el diagnóstico de la enfermedad.
Métodos
Se realizó un estudio retrospectivo en pacientes con diagnóstico de mieloma múltiple que recibieron TPHa, atendidos por el Servicio de Hematología del Hospital Clínico Quirúrgico Hermanos Ameijeiras, durante el período comprendido de noviembre de 2009 a noviembre de 2019, por lo que la muestra quedó constituida por 15 pacientes.
A todos los pacientes se les realizó una exhaustiva evaluación pretransplante, en la que se constató el estado de las funciones cardíaca, hepática, renal, y pulmonar, así como la ausencia de focos sépticos demostrables. Para la quimioterapia de acondicionamiento se utilizó el melfalán (por vía endovenosa u oral), en dosis entre 140 y 200 mg/m2. Se utilizaron células progenitoras hematopoyéticas de sangre periférica, obtenidas mediante dos leucoféresis (una de gran volumen y otra de volumen estándar) y conservadas a 4ºC, sin criopreservación, según el método de Ruiz-Argüelles y otros.7
El día de la infusión de las células hematopoyéticas fue considerado el día 0. Posterior al proceder los pacientes fueron sometidos a un aislamiento protector en cuartos simples, con filtro de aire de alta eficiencia y con una alimentación estéril. Se utilizó antibióticoterapia oral profiláctica a partir del día -7 que consistió en la combinación de cotrimoxazol, una quinolona y fluconazol.
En todos los pacientes se utilizó el factor estimulador de colonias granulociticas (leukocim o hebervital) 300-600 µg diarios a partir del día +3, hasta alcanzarse un conteo de neutrófilos igual o mayor de a 1x109/L durante tres días. La antibióticoterapia sistémica se utilizó cuando los pacientes tuvieron neutropenia febril y se empleó la combinación de una cefalosporina de tercera generación, un aminoglucósido y vancomicina.
En los casos en que persistió la fiebre después de 72 h se añadió amfotericín B. El tratamiento antibiótico empírico se mantuvo hasta que el conteo de neutrófilos fue igual o mayor de 0,5x109/L durante tres días seguidos o hasta que los estudios bacteriológicos y la evolución clínica indicaron la necesidad de un cambio. Todos los pacientes fueron transfundidos con hemocomponentes irradiados para mantener una cifra de hemoglobina ≥ 10 g/dL y una cifra de plaquetas ≥ 20 x 109/L.
Todos los casos continuaron en el período posTPHa con un tratamiento de mantenimiento, con talidomida (100 mg diarios) o lenalidomida (25 mg diarios) según la disponibilidad.
Los datos se registraron en un cuaderno de recolección. La información se obtuvo de las historias clínicas. Para llevar a cabo lo anteriormente expuesto Se elaboró una base de datos al efecto y se utilizó el paquete estadístico Statistical Package Social Science (SPSS) versión 15.0.
Como medida de resumen para las variables cualitativas se utilizaron las frecuencias absolutas y relativas. Se consideró la supervivencia global a partir del tiempo transcurrido entre el trasplante y la muerte o la última consulta recibida por el paciente. El análisis de supervivencia se realizó mediante el método estadístico de Kaplan Meier.
En cuanto a las consideraciones éticas, se garantizó la confidencialidad de la información obtenida durante el estudio, la cual solo se utilizó con propósitos docentes e investigativos. El trabajo se llevó a cabo bajo la autorización del Comité Científico y la Comisión de Ética de la Investigación. Se aplicaron los principios de la Declaración de Helsinki9 del año 2013, para el desarrollo de investigaciones en los seres humanos.
Resultados
El grupo de edad que más casos aportó fue el de 40-59 años con 9 pacientes (60 %), la media de edad fue de 54,67 años, en cuanto al sexo, la muestra estuvo bastante equilibrada, con un ligero predominio del sexo masculino con ocho hombres (53,3 %) y siete mujeres (46,7 %) y una relación M/F de 1,14. El estado funcional de los pacientes previo al trasplante fue en su totalidad bueno, 14 de estos enfermos estaban en una escala ECOG de 0 (93,3 %).
Todos los pacientes debutaron en estadio III de Durie-Salmon, y 13 (86,7 %) con función renal normal (estadío IIIA). La variedad inmunológica IgG fue la que predominó (10 casos, 66,7 %).
La distribución de los pacientes del estudio según el estado de la enfermedad en el momento del TPHa, muestra que la mayoría de los pacientes (14) alcanzaron la RC, para un 93,3 %.
La media del tiempo transcurrido entre el momento del diagnóstico y la realización del TPHa fue de 21,46 meses con un rango de 8,28-56,61 meses. Diez casos (66,7 %) fueron trasplantados entre el año y los tres años de haber sido diagnosticados (tabla 1).
Tabla 1 Características generales de los pacientes
| Variables | n.o (n = 15) | % |
|---|---|---|
| Edad < 40 años 40-59 años ≥ 60 años Media (rango) años | 1 | 6,7 |
| 9 | 60 | |
| 5 | 33,3 | |
| 54,67 (28-67) | ||
| Sexo | ||
| Masculino | 7 | 46,7 |
| Femenino | 8 | 53,3 |
| Estado funcional (SP) escala ECOG | ||
| 0 | 14 | 93,3 |
| 1 | 1 | 6,7 |
| Estadio (Durie-Salmon) | ||
| III-A | 13 | 86,7 |
| III-B | 2 | 13,3 |
| Variedad imunológica IgA ƙ | 4 | 26,7 |
| IgA λ | 1 | 6,7 |
| IgG ƙ | 9 | 60,0 |
| IgG λ | 1 | 6,7 |
| Estado de la enfermedad preTPH | ||
| RC | 14 | 93,3 |
| RP | 1 | 6,7 |
| Tiempo entre el diagnóstico y el TPH | ||
| < 1 año | 3 | 20 |
| 1-2 años | 10 | 66,7 |
| > 2 años Media (rango) meses | 2 | 13,3 |
| 21,46 (8,28-56,61) | ||
RC: remisión completa; RP: remisión parcial, PS: Status Performance.
En todos los casos la fuente de células hematopoyéticas fue de sangre periférica, obtenidas de 2 colectas (leucoféresis). Se infundió una media de 5,49 células x 108/kg de peso con un rango de 2,4-12,03. El régimen de acondicionamiento más utilizado fue melfalán de 200 mg/m2, en 10 pacientes, lo que representó un 66,7 %. La recuperación de las cifras de neutrófilos y las plaquetas ocurrieron como promedio a los 11 días. Los datos fueron evaluados solamente en 14 pacientes, pues uno falleció precozmente sin lograr la recuperación hematológica (tabla 2).
Tabla 2 Características del trasplante
| Variables | n.o (n= 15) | % |
|---|---|---|
| Fuente de células hematopoyéticas S. periférica | 15 | 100 |
| Número de colectas 2 | 15 | 100 |
| Células mononucleares infundidas x 108 x kg Media (rango) | 5,49 (2,4-12) | |
| Quimioterapia de acondicionamiento | ||
| Melfalán IV 140 | 4 | 26,7 |
| Melfalán IV 200 | 10 | 67,7 |
| Melfalán oral 150 | 1 | 6,7 |
| Tiempo de recuperación hematopoyética (dias)* | ||
| Neutrófilos: media (rango) | 11 (8-2) | |
| Plaquetas: media (rango) | 11 (7-23) | |
Dentro de las toxicidades y complicaciones en el período precoz postrasplante asociadas al régimen de acondicionamiento, se encuentran la toxicidad gastrointestinal y las citopenias en 14 pacientes (93,3 %). Después de un periodo de observación promedio de 47,78 meses, 13 de los casos continúan en RC (86,7 %). Solo dos pacientes fallecieron (13,3 %), uno asociado a una sepsis grave el día + 6 postrasplante (mortalidad asociada con el trasplante) y otro por recaída (tabla 3).
Tabla 3 Toxicidad y complicaciones en el período precoz* postrasplante
| Variables | n.o (n = 15) | % |
|---|---|---|
| Toxicidad | ||
| Toxicidad gastrointestinal | 14 | 93,3 |
| Citopenias | 14 | 93,3 |
| Neutropenia febril | 12 | 80 |
| Sepsis bacteriana comprobada por hemocultivo | 5 | 33,3 |
| Sangrado | 2 | 13,3 |
| Mucositis | 1 | 6,7 |
| Cardiovascular | 2 | 13,3 |
| Fibrilación auricular | 1 | 6,7 |
| Síndrome de taquicardia por reentrada nodal | 1 | 6,7 |
| Otras | ||
| Foliculitis | 1 | 6,7 |
| Sepsis del catéter | 1 | 6,7 |
| *Fallecimiento | 1 | 6,7 |
Datos: *1.o 30 dias.
Se expone el estado actual de los pacientes y la mortalidad después de un período de observación promedio de 47,78 meses; 13 de los casos continúan en RC (86,7 %). Solo dos pacientes fallecieron (13,3 %), uno asociado a una sepsis grave el día + 6 postrasplante (mortalidad asociada con el trasplante) y otro por recaída (tabla 4).
Tabla 4 Estado actual de los pacientes y la mortalidad
| variables | n.o (n = 15) | % |
|---|---|---|
| vivos remisión completa | 13 | 86,7 |
| fallecidos | 2 | 13,3 |
| recaída | 1 | 6,7 |
| mortalidad asociada al trasplante | 1 | 6,7 |
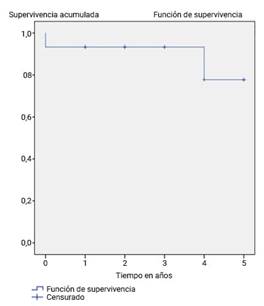
Se muestra la probabilidad de SG de la serie estudiada, según el método de Kaplan-Meier, la cual fue de 77,8 % a los cinco años de la observación (fig.).
Discusión
En el momento actual el tratamiento estándar del MM consiste en una quimioterapia de inducción, seguida de TPHa como consolidación, con el objetivo de prolongar la SG y la sobrevida libre de eventos (SLE).
En el presente estudio los pacientes con una edad media en el momento del trasplante fue similar a lo reportado en otras investigaciones y hubo un predominio del sexo masculino, similar a lo reportado en distintas series publicadas.10,11 Además, en Cuba, según los datos del Anuario Estadístico del MINSAP, existe una mayor morbilidad del género masculino en las hemopatías en general, lo cual justifica este resultado.4)
En la totalidad de la muestra el estado funcional en el momento del trasplante fue de un ECOG 0-1, lo cual difiere de lo reportado en algunas publicaciones, ya que este suele ser variable y dependiente del momento en que se aborde al paciente. También este indicador forma parte del proceso de selección para el trasplante, lo que explica que, en la mayoría de las ocasiones, como es nuestra serie, los sujetos tributarios de TPHa posean buen estado funcional para poder someterse al proceder.12
Con relación al estadio de los pacientes con MM al diagnóstico, diversos estudios epidemiológicos coinciden que al inicio la mayoría de los casos se encuentran en estadios avanzados.12 En una investigación de Martínez-Cornejo y otros (13 incluyeron los pacientes con MM de casi todo el territorio mexicano en un período de cinco años, el 64,3 % de los casos se encontraban en estadio III (Durie - Salmon) y de estos el 18,6 % en estadio IIIB. En la presente serie los 15 casos estaban en estadio III y de estos 2 (13,3 %) tenían un estadio IIIB.
En cuanto a la variedad inmunológica de los resultados obtenidos, coinciden con otros autores, puesto que la mayoría de los casos con MM en grandes series son clasificados como IgG.12
En la totalidad los estudios publicados en la actualidad, concuerdan con los resultado del presente estudio con el uso de la sangre periférica, como fuente de células progenitoras hematopoyéticas en el trasplante autólogo en el MM.14
En relación con las características del trasplante la totalidad de los trabajos publicados en la actualidad coinciden con el uso de la sangre periférica como fuente de células progenitoras hematopoyéticas en el trasplante autólogo en el MM.15
Sin embargo, una característica muy particular de nuestro estudio es la conservación de dichas células durante 24-48 h después de extraídas y hasta su infusión a 4oC, en un refrigerador común del banco de sangre, sin criopreservación. En este aspecto, son pocos los estudios que han demostrado que el TPHa en el MM es factible sin criopreservación, lo cual es muy importante en los países en desarrollo donde hay un reto en hacer accesible el TPHa a todos los pacientes con MM, sin necesidad de tener que contar con recursos financieros para toda la estructura técnica-profesional de la criopreservación.15
En los pacientes del estudio, se infundió una media de 5,49 células x 108/kg de peso con un rango de 2,4 - 12,03; valores muy similares a los reportados en series de pacientes con MM sometidos a de TPHa.
En relación con el régimen de acondicionamiento, en nuestra serie el más utilizado fue el MEL 200 IV (10 casos, 66,7 %), en este aspecto la mayor parte de los estudios consideran superior el uso del MEL 200, en cuanto a niveles de respuesta y con impacto en la SLE.16,17,18
El tiempo de recuperación hematopoyética de neutrófilos y las plaquetas de nuestros pacientes, concuerda con lo que han publicado otros autores que reportan que estos tiempos varían entre 10 y 14 días para ambas líneas hematopoyéticas.17,18,19
Con relación a las toxicidades y complicaciones secundarias al RA con altas dosis de melfalán nuestros resultados en sentido general son similares a otros estudios, se evidenciaron que las citopenias y la toxicidad gastrointestinal se reportan en la mayoría de las series de pacientes trasplantados con MM.20,21 Igualmente la neutropenia febril constituye una de las complicaciones frecuentes del proceder, y en el estudio se observó en el 80 % de los casos (12/15), lo cual se corresponde con otras autores que reportaron una frecuencia por encima del 60 % en condiciones similares a la nuestra.22
El estado actual de los pacientes y la mortalidad después de un período de observación promedio de aproximadamente 4 años, solo dos pacientes fallecieron (13,3 %) y 13 (86,7 %) de ellos continúa vivo y en RC. Otros autores23 reportaron resultados acerca de la respuesta de los postrasplante con remisiones completas con muy buenas respuestas parciales que varían entre 60 y 89 %, lo cual está en el rango de nuestros resultados.
De los fallecidos, uno se produjo por una sepsis grave el día + 6 postrasplante y otro por recaída a los 4 años del proceder, lo que representa una mortalidad relacionada con el trasplante (MRT) al día + 30 de 7,1 %. Este último resultado coincide con otros estudios, que reportaron una MRT de 7 % en 53 pacientes trasplantados.24
Sin embargo, diversas investigaciones han señalado que con la mejoría de los cuidados de soporte y la utilización de agentes menos tóxicos la MRT reportada en la actualidad en pacientes con MM sometidos a TPHa es menor de 3 %.24 Se considera que el resultado en el momento actual es aceptable, pero que debe mejorarse en un futuro a medida que aumenten los casos sometidos a este proceder; además, se debe tener en cuenta un mejor criterio de selección y de los cuidados de soporte.
En el último reporte del CIBMTR en el 2019, la SG a los tres años de la observación postrasplante fue de 78 % ± 1 %.17) En nuestro trabajo la probabilidad de SG a los 5 años fue del 77,8 ± 1,52 %, lo cual es equiparable a los obtenidos a nivel mundial, sobre todo en las publicaciones de los últimos 10 años y en el reporte del CIBMTR de 2019.25,26,27,28
Se concluye que al evaluar los resultados obtenidos se confirma que el TPHa en pacientes con MM es un procedimiento factible y seguro, se asocia a una toxicidad y MRT aceptable, con una rápida recuperación hematológica, y de una adecuada respuesta de la enfermedad postrasplante. Lo más importante en estos pacientes es que mejoran considerablemente la expectativa de sobrevida. El TPHa es visto en el momento actual como una etapa esencial en el tratamiento del MM y de acuerdo a nuestra experiencia debemos considerar con fuerza ampliar el rango de edad de su indicación.