Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.37 no.4 Ciudad de la Habana oct.-dic. 2011
GINECOLOGÍA Y SALUD REPRODUCTIVA
Respuesta inmune celular en pacientes con lesiones benignas y malignas del cuello uterino
Cellular immune response in patients presenting with benign and malignant lesions of cervix
MSc. Lic. Grettell León Cruz,I Dra. C. María del Carmen Arango Prado, I Dra. C. María Elena Faxas GarcÍa,I Dra. Pilar Soto Pardeiro,I Dr. Omar de Jesús Bosque,I Dra. Claudia Beltrán MirandapII
I Instituto Nacional de Oncología y Radiobiología. La Habana, Cuba.
II Universidad de Guadalajara, Méjico.
RESUMEN
Objetivo: estudiar parámetros inmunológicos en pacientes con lesiones intraepiteliales (NIC) y carcinoma in situ del cuello uterino en el Instituto Nacional de Oncología y Radiobiología durante el año 2009.
Métodos: se realizó un estudio en 20 pacientes donde se determinaron las características inmunofenotípicas de los linfocitos de sangre periférica mediante citometría de flujo y la capacidad funcional frente a diversos mitógenos utilizando el método de síntesis de DNA. El análisis de correlación entre variables inmunológicas y epidemiológicas se realizó mediante el cálculo del coeficiente de correlación de Pearson. Para las pruebas estadísticas se utilizó el paquete estadístico SPSS (versión 11.5).
Resultados: la subpoblación de los linfocitos Tc CD8+, mostró valores superiores estadísticamente significativos (p=0,004) solo para las pacientes con NIC I. En todas las pacientes, independientemente del estadio de la enfermedad y del mitógeno utilizado, los índices de estimulación (IE) resultaron inferiores a los valores del grupo control.
Conclusión: las alteraciones en el sistema inmune en las pacientes con patología de cuello están asociadas al progreso de la enfermedad y las células T son fundamentales en el control de la progresión de las lesiones.
Palabras clave: neoplasia intraepitelial cervical (NIC), carcinoma in situ, inmunofenotipo, síntesis de DNA.
ABSTRACT
Objective: To study the immunologic parameters in patients presenting with intraepithelial lesions (IEL) and carcinoma in situ of cervix in the National Institute of Oncology and Radiotherapy over 2009.
Methods: A study was conducted in 20 patients to determine the immuno-phenotypical of lymphocytes in peripheral blood by flow-cytometry and the functional ability in face of diverse mitogen using the AND synthesis method. The correlation analysis among the immunologic and epidemiologic variables was carried out by an estimation of Pearson's correlation coefficient. For the statistic test the SPSS statistical package was used (version 11.5).
Results: The subgroup of Tc + CD8 lymphocytes showed higher values statistically significant ( p= 0.004) only for patients presenting with IEL. In all patients, independently of disease stage and of the mitogen used, the stimulation rates (SR) were lower than the values of controls.
Conclusions: The alterations in the immune system in patients with cervix pathology are associated with the progress of lesions.
Key words: Cervical intraepithelial neoplasm (CIN), carcinoma in situ, immuno-phenotype, AND synthesis.
INTRODUCCION
La infección por el virus del papiloma humano (VPH) ha sido asociada a displasia y cáncer del cuello uterino y aunque la prevención, el diagnóstico y el tratamiento se refuerzan continuamente, la patología de cuello uterino sigue siendo un importante problema de salud en la mujer.1 En Cuba, a pesar de existir un programa de detección precoz de cáncer cérvico-uterino, las cifras de cáncer en esta localización continúan altas. Acorde a la información del Anuario estadístico 2010 del MINSAP, esta enfermedad ocupa el 1er. lugar de incidencia por cáncer del sexo femenino en las edades comprendidas entre 20 y 40 años. La tasa global de incidencia es de 29 y la de mortalidad, de 7,7, y se encuentra entre las primeras 10 causas de muerte por neoplasias malignas.2
La infección con el virus VPH es frecuente, pero generalmente transitoria. Solo del 10 al 30 % de las mujeres infectadas, progresan hacia lesiones intraepiteliales de alto grado y carcinoma in situ. Cuando el huésped es incapaz de eliminar el virus se establece la fase de persistencia que se observa en las personas que se inician tempranamente en la vida sexual, cambian de pareja frecuentemente, utilizan contraceptivos orales, consumen alcohol y fuman.1 Estas condiciones propician que el virus pueda inducir alteraciones progresivas en el cuello del útero que se derivan hacia lesiones intraepiteliales de bajo y alto grado de malignidad (NIC1-3) e incluso hasta cáncer cervical. Las NIC-1 comúnmente aparecen en la mujer poco tiempo después de iniciarse en la vida sexual y la progresión hacia lesiones NIC-2 / NIC-3 y cáncer toma al menos 2 años aunque frecuentemente su desarrollo necesita décadas.3-5
Las evidencias clínicas sugieren que la inmunidad celular es importante en la protección contra la persistencia del VPH. Estos resultados se documentan con la alta incidencia de displasias en pacientes inmunosuprimidos por trasplantes y en los infectados por el virus de la inmunodeficiencia humana (VIH).6 Diversos estudios reportan desregulación en la producción de citoquinas y déficit de las células TCD4+. Alteraciones en la respuesta a los mitógenos Phytohemaglutinin (PHA) y a la interleuquina 2, y en el patrón de citocinas, tanto localmente como en sangre periférica, se describen en los estadios más avanzados de displasia y cáncer cervical y en general estas modificaciones están asociadas, con la incapacidad del sistema inmune de controlar la infección.7-10
En el presente estudio se evaluaron las características inmunofenotípicas de las células de sangre periférica y la capacidad de respuesta frente a mitógenos convencionales de pacientes con diferentes grados de lesiones de cuello de útero. Los resultados evidenciaron disminución del número de linfocitos CD3+ asociado con el avance de la enfermedad, e incremento de las células CD8+ en las pacientes con NIC-1. La respuesta frente a mitógenos mostró disminución de la capacidad proliferativa en presencia de PHA, TPA e IL-2 en pacientes con NIC-3 y con carcinoma in situ.
MÉTODOS
Fueron incluidas 20 pacientes con diagnóstico histológico de neoplasias intraepiteliales (NIC), que se distribuyeron en 5 pacientes por cada grupo (NIC-1, NIC-2, NIC-3), y 5 portadoras de carcinoma in situ de cuello uterino (CaCU), (clasificación de la FIGO para el cáncer cérvico-uterino, año 1988). Se atendieron en el servicio de Ginecología del Instituto Nacional de Oncología y Radiobiología durante el año 2009, fueron positivas al VPH y presentaban un rango de edad entre 25 y 47 años. Estas pacientes no habían recibido tratamiento oncoespecífico y aceptaron participar voluntariamente en el estudio mediante la firma del Consentimiento Informado. El estudio fue aprobado en el consejo científico y el comité de ética de la institución acorde a las normas de investigación en humanos. A todas las pacientes se les realizaron entrevistas individuales y la información fue registrada en un modelo de Recogida de Datos
Se obtuvieron las siguientes muestras biológicas:
- Del canal endocervical: mediante cepillado, con el propósito de obtener las células exfoliadas del cérvix para diagnóstico de la lesión.
- De sangre periférica: para la identificación fenotípica de moléculas de diferenciación (CD) y la evaluación de la capacidad proliferativa de los linfocitos con células mononucleares periféricas.11
Todos estos experimentos incluyeron, además, estudios de 20 mujeres aparentemente sanas que representaron un grupo control.
Determinación de marcadores linfocitarios (CD)
Se determinaron los marcadores linfocitarios CD3, CD4, CD8, CD19, CD5/19, CD4/25 en las poblaciones de linfocitos periféricos por Inmunofluorescencia directa mediante Citometría de Flujo en FACS (con los siguientes anticuerpos monoclonales AcMs de la comercial Becton Dickinson, AcM anti-CD3 conjugados con isotiocianato de fluoresceína (FITC, AcM anti-CD4, AcM anti-CD8, AcM anti-CD 19, el anti-CD25 (PE, phycoerythrin).
Se realizó técnica de citometría de flujo según procedimientos convencionales12 con modificaciones utilizando 2 mL de sangre total. Se dispensaron 100 mL de sangre en cada tubo para luego añadir 2,5 mL de cada AcM correspondiente a la población linfocitaria a evaluar. Para cada paciente se identificó la distribución de leucocitos por medio del marcador CD45. Los resultados se obtuvieron según salida habitual correspondiente al software del citómetro. Las muestras se leyeron en Sistema de análisis de flujo celular (citómetro de flujo FACScan- Becton Dickinson).
Síntesis de ADN medida por incorporación de timidina tritiada
Mitógenos: Phytohemaglutinin (PHA); 1 µg/mL; SIGMA), Lipopolisacárido de E. Coli (LPS); 25 U/mL; SIGMA), Esteres de Forbol (TPA; 0.01 µg/mL; SIGMA) e IL-2 humana recombinante (125 U/mL; SIGMA) en concentraciones previamente estandarizadas. Las emisiones radioactivas b se midieron en cuentas por min (cpm) en un contador Beta LKB. El Índice de Proliferación (IE) para cada experimento fue el siguiente:
Procesamiento de datos
Se determinaron los parámetros descriptivos, frecuencias absolutas y relativas, media aritmética y desviación estándar para las variables cuantitativas. Para la comparación entre los grupos de estudio fue utilizada la prueba no paramétrica de Kruskall-Wallis, por la no distribución normal de las variables. El análisis de correlación entre variables inmunológicas y epidemiológicas se realizó mediante el cálculo del coeficiente de correlación de Pearson. Todas las pruebas estadísticas se realizaron utilizando el paquete estadístico SPSS (versión 11.5).
RESULTADOS
Identificación de marcadores fenotípicos de linfocitos
El análisis por citometría de flujo (FACS) de la población de las células mononucleares periféricas utilizando AcM anti-CD 19 para células B y AcM anti-CD 19/5 para células B1, reveló que los niveles de estas células se encontraban en el rango de la normalidad (figura 1).
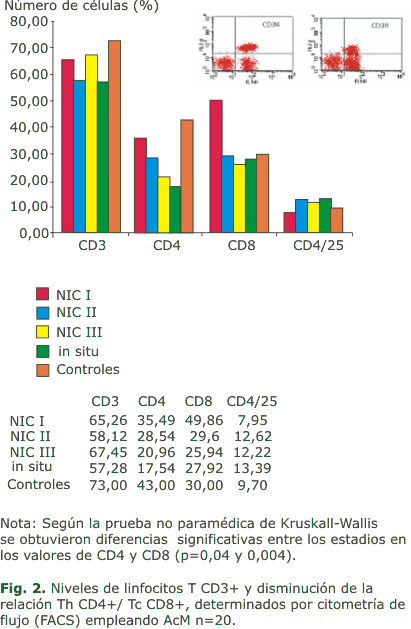
De la población de linfocitos T CD3+, los valores obtenidos para la subpoblación Th CD4+ mostraron diferencias estadísticamente significativas entre los estadios (p = 0,04), disminuyendo el número de células con el avance de las lesiones. La subpoblación de los linfocitos Tc CD8+, mostró valores superiores, estadísticamente significativos (p = 0,004), solo para las pacientes con NIC I en relación al grupo control. En todos los estadios evaluados el porcentaje de la subpoblación de linfocitos CD8+ fue superior al de CD4+, resultando invertida la relación CD4:CD8 comparada con la obtenida en individuos aparentemente sanos.
Por otra parte, no se detectaron diferencias estadísticamente significativas (p = 0,15) en los valores de la subpoblación de linfocitos Th CD4+/CD25+ entre los diferentes estadios y el grupo control. Sin embargo, dado que los niveles de CD4+ en estas pacientes disminuyen con el avance de la enfermedad, la relación (CD4+/CD25+)/CD4+ se incrementó.
Así mismo, los valores de la cuantificación de las células T mediante el marcaje con AcM anti-CD3, fueron similares a los del grupo control (figura 2).
Capacidad proliferativa de los linfocitos de sangre periférica
Los linfocitos de sangre periférica al ser estimulados por LPS no tuvieron diferencias significativas con el grupo control. Los valores obtenidos fueron similares en todos los estadios de la enfermedad.
En la figura 3 se advierte la función proliferativa de los linfocitos T de sangre periférica de las pacientes, comparada con el rango de valores obtenidos en el grupo control, al ser estimulados con los mitógenos PHA y TPA.
En todas las pacientes, independientemente del estadio de la enfermedad y del mitógeno utilizado, los índices de estimulación (IE) resultaron inferiores a los valores del grupo control. La estimulación por ambos mitógenos no mostró diferencias estadísticamente significativas entre los estadios (pPHA=0.264 y pTPA=0,88).
Las células mononucleares periféricas estimuladas con IL-2, disminuye el IE en los estadios NIC III e in situ y esta diferencia es estadísticamente significativa (p = 0,002).
DISCUSIÓN
Las lesiones del cuello uterino se derivan de infecciones persistentes por VPH, factores relacionados con el sistema inmune y otros asociados con hábitos de vida favorecerán o no el desarrollo progresivo hacia cáncer.
En este estudio el número de células B no se encuentra comprometido en las pacientes incluidas; sugiere que la producción de anticuerpos no se afecta y que la rama humoral de la respuesta inmune se encuentra probablemente conservada. Sin embargo, el comportamiento de las células T difiere en el grupo de pacientes con respecto al control, con cambios en el número y la función de los linfocitos T relacionados con el avance de la enfermedad.
La cantidad de células efectoras, su diferenciación y su capacidad funcional puede ser el resultado de la acción simultánea de varios mecanismos desarrollados tanto por el VPH como por las células tumorales para evadir la respuesta inmune. Un balance desfavorable, conduce a un estado de tolerancia con inhibición de la respuesta inmune adaptativa donde se puede detectar disminución en el número de moléculas coestimulatorias, expresión de proteínas virales que inducen la liberación de factores solubles moduladores de las células efectoras y la participación de linfocitos T con función supresora (CD4+/CD25+).9
En las NIC-I, la observación del incremento en el CD8 puede deberse a que los cambios citopáticos y la expresión de antígenos virales son menores en este estadio inicial que en las lesiones de alto grado. En dicho escenario la población de linfocitos T efectores se expande frecuentemente y es posible el control de la lesión, pero un incremento en el número de células infectadas requiere que la función de los linfocitos Tc CD8+ se estimule aún más para lograr la eliminación de la célula maligna mediante apoptosis. A medida que avanza la enfermedad, es posible apreciar el efecto contrario, que los linfocitos Tc CD8+ disminuyan a medida que se incrementan las células modificadas, por lo que estas células T no pueden controlar la enfermedad, resultados que concuerdan con los estudios de Purnima Bhat y García-Pineres.6,9
En las pacientes incluidas en el estudio, el resultado "normal" en los valores de linfocitos Tc CD8+ a partir del NIC-2 pudiera explicarse, a la presencia de células CD8+ supresoras que contribuyen, además, a la disminución de linfocitos Th CD4+ observada, y niveles relativamente constantes de linfocitos CD4+/CD25+ lo que explica el aumento de la relación CD4+:CD25+/CD4+ en las pacientes.
Los linfocitos CD4+/CD25+, una vez activados, comienzan a secretar interleuquinas inmunosupresoras como el TNF-b y la IL-10, desencadenando eventos que propician el ambiente supresor a medida que aumenta la carga tumoral. Se induce la diferenciación de las células T a linfocitos Th2, con disminución de la secreción de INF-g y de IL-2, interleuquina fundamental en la cascada de activación de la respuesta citotóxica. El aumento en la expresión de interleuquinas del patrón Th2 paralelo a la disminución de las interleuquinas del patrón Th1, contribuye a la desregulación de los mecanismos de presentación antigénica y por tanto, una disminución de la activación de los linfocitos T CD8+10.
Por otra parte, la estimulación frente a mitógenos se conservó solo frente al LPS. Este mitógeno estimula preferentemente a las células B y dado que estos linfocitos se conservan, no hay afectación en la respuesta; sin embargo la estimulación mediante otros mitógenos donde participan en la respuesta células T y sus mediadores, se deprime. Estos resultados coinciden con los obtenidos por Fattorossi y otros, quienes reportaron que los valores de IE de pacientes con cáncer de cérvix son inferiores a los del grupo control, y esta disminución se asocia con la progresión de la enfermedad.13
Aunque este estudio es poco abarcador en cuanto al número de pacientes y parámetros evaluados, las células T son fundamentales en el control de la progresión de las lesiones del cuello uterino.
REFERENCIAS BIBLIOGRAFICAS
1. Zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer. 2002;2:342-50.
2. Dirección Nacional de Registros Médicos y estadísticas de salud. Anuario estadísitico de Salud 2010. La Habana: MINSAP; 2011.
3. Bosch F.X, Lorincz A, Munoz N, Mejer CJ, Shah KV. The casual relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002;55:244-65.
4. Woodman CB, Collins SI, Young LS. The natural history of cervical HPV infection: unresolved issues. Nat Rev Cancer. 2007;7:11-22.
5. Ho G YF, Bierman R, Beardsley L, Chang CJ, Burk RD. Natural history of cervicovaginal papillomavirus infection in young women. N Eng Med; 338: 423-8.
6. Purnima Bhat, Stephen R, Mattarollo, Christina Gosmann, Ian H. Frazer. Regulation of immune responses to HPV infection and during HPV directed. Immunotherapy Immunological Reviews. 2011;239:85-98.
7. Chin-Hong PV, Palefsky JM. Human papillomavirus anogenital disease in HIV-infected individuals. Dermatol Ther. 2005;18:67-76.
8. van der Burg SH, Piersma SJ, Jong A de, van der Hulst JM, Kwappenberg KMC, van den Hende M, et al. Association of cervical cancer with the presence of CD4+ regulatory T cells specific for human papilloma virus antigens. PNAS. 2007;104(29):12087-92.
9. García-Pineres AJ, Hildesheim A, Herrero R, Trivett M, Williams M, Atmetlla I, et al. Persistent Human Papillomavirus Infection Is Associated with a Generalized Decrease in Immune Responsiveness in Older Women A. Pinto Cancer Res. 2006;66:11070-6.
10. Bor-Ching Sheu, Rong-Hwa Lin, Huang-Chun Lien, Hong-Nerng Ho, Su-Ming Hsu, Su-Cheng Huang. Predominant Th2/Tc2 Polarity of Tumor-Infiltrating Lymphocytes in Human Cervical Cancer1. The Journal of Immunology. 2001;167:2972-8.
11. Boyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest [Suppl]. 1968;77-114.
12. Landay AL, Muirhead KA. Procedural guidelines for performing immunophenotyping by flow cytometry. Clin Immunol Immunopathol. 1989;52(1):48-60.
13. Fattorossi A, Battaglia A, Ferrandina G, Buzzonetti A, Legge F, Salutari Vet al. Lymphocyte populations in human lymph nodes. Alterations in CD4+ CD25+ T regulatory cell phenotype and T-cell receptor V-beta repertoire. Gynecol Oncol. 2004;92(1):106-15.
Recibido: 3 de julio de 2011.
Aprobado: 18 de julio de 2011.
Grettell León Cruz. Instituto Nacional de Oncología y Radiobiología. Calle 29 y F. Vedado. La Habana, Cuba. Correo electrónico: glcruz@infomed.sld.cu