Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.41 no.2 Ciudad de la Habana abr.-jun. 2015
Rev Cubana Obstet Ginecol. 2015;41(2)
RIESGO REPRODUCTIVO Y GINECOLOGIA
La embolización selectiva de arterias uterinas como alternativa en el tratamiento del fibroma uterino
Selective Embolization of Uterine Artery as an Alternative in the Treatment of Uterine Fibroids
Dr. Juan Emilio Rodríguez LinaresI, Dr. Boris Luis Torres CuevasII, Dra. Geominia Maldonado CantilloII
I Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
II Instituto Nacional de Higiene y Epidemiologia. La Habana. La Habana, Cuba.
RESUMEN
El fibroma uterino se presenta entre el 25 y 50 % de las mujeres mayores de 30 años, y sus manifestaciones clínicas más importantes son: el dolor pélvico y el sangrado vaginal. Su diagnóstico se basa en el examen clínico y se confirma con métodos imaginológicos. Los tratamientos tradicionales han sido la hormonoterapia, la cirugía y, en los últimos años, la cirugía de mínimo acceso. El objetivo de este trabajo es reportar los beneficios del empleo de la emboloterapia de las arterias uterinas como terapéutica alternativa de tratamiento de los fibromas uterinos sintomáticos, según las referencias de varios autores.
Palabras clave : fibroma uterino, embolización, arterias uterinas, tratamiento.
ABSTRACT
Uterine fibroid occurs between 25 and 50% of women over 30 years, and its main clinical manifestations are pelvic pain and vaginal bleeding. Diagnosis is based on clinical examination and confirmed with imaging methods. Traditional treatments are hormone therapy, surgery, and, in recent years, minimal access surgery. The aim of this paper is to report the benefits of the use of embolotherapy for uterine artery as a therapeutic alternative for the treatment of symptomatic uterine fibroids, according to references by various authors.
Keywords: uterine fibroid embolization, arteriasuterinas treatment.
INTRODUCCIÓN
Epidemiología
En la actualidad, la medicina moderna exige utilizar los métodos imaginológicos, no solo con fines diagnósticos sino también como terapéuticos. Una forma sencilla de clasificar el intervencionismo imaginológico es que lo divide en dos grandes grupos: vascular (obstrucción o por dilatación de los vasos) y no vascular, un ejemplo del intervencionismo vascular es el tratamiento de los fibromas uterinos por medio de la embolización de las arterias uterinas (en lo adelante EAU).1
Los fibromas uterinos son tumores muy frecuentes, que ocurren entre el 25 y 50 % de las mujeres mayores de 30 años, el 60 % de las histerectomías realizadas en los países occidentales son provocadas por estos tumores. Los fibromas uterinos (FU) pueden cursar asintomáticos o provocar diferentes síntomas, tales como menometrorragia, dolor pelviano, dispareunia, trastornos urinarios, lumbalgia y asociarse, entre otros, a infertilidad.1
Los fibromas uterinos son tumores benignos compuestos por células de músculo liso y tejido colágeno; que, como es conocido, inician la génesis de los estos y que en su desarrollo o crecimiento intervienen los estrógenos y la progesterona.3
De acuerdo a su localización en el útero se acostumbra a clasificarlos en submucosos (o subendometriales), intramurales (en el interior del miometrio sin comprometer la cavidad) y subserosos, que por crecer hacia la cavidad abdominal no provocan sangrado, pero sí dolor y, cuando crecen mucho, comprimen estructuras vecinas. Los submucosos son intracavitarios y provocan sangrado abundante, menstruaciones extensas y pueden ser detectados mejor por histerosalpingografía y resecados por histeroscopia.4
La distorsión de la cavidad uterina que provocan, puede ser una causa de subfertilidad y, del mismo modo, disminución en las tasas de embarazo; además, causan sangrado abundante, prolongación de los días de menstruación, dolor pélvico y síntomas compresivos fundamentalmente urinarios, lo que obliga a su tratamiento.5
Anatomía vascular
La nueva opción de tratamiento de los FU con embolización de las arterias uterinas obliga a realizar una breve revisión de la anatomía vascular del útero. Las arterias uterinas se originan en la división anterior de la arteria ilíaca interna, con un trayecto en forma de U y un primer segmento descendente, paralelo a la pared de la pelvis, un segundo segmento horizontal que cruza el uréter distal al nivel del cérvix y un tercer segmento ascendente, a lo largo del borde del útero, por el margen medial del ligamento ancho. La arteria cervicovaginal se origina de la porción horizontal de la arteria uterina; por tanto, la embolización se debe realizar en el trayecto ascendente de esta arteria.6
La irrigación de los fibromas se realiza por las arterias uterinas entre un 50 y 90 % de las mujeres, por anastomosis entre arterias ováricas y uterinas entre el 13,2 y 56 %, lo que depende de la dominancia del flujo por uno u otro vaso y solo por las arterias ováricas en un 3,9 % de las pacientes.7
Los ovarios están vascularizados por las arterias ováricas en un 40 %, por las arterias uterinas y las ováricas en el 56 % y solo por las arterias uterinas en el 4 %.
En casos en los cuales no se respete la anatomía vascular, el exceso de material embolizante puede producir una isquemia de estas.8
Las anastomosis útero-ováricas se identifican entre el 10 y 30 % de las arteriografías, ya sea al inicio del proceder o al redistribuirse el flujo, después de la embolización de los miomas. El diámetro de estas anastomosis se estima en menos de 500µ.9
El aporte arterial a los miomas procede, entre un 5-10 % de los casos, de la arteria ovárica. Este hecho se observa con mayor frecuencia en pacientes con antecedentes de cirugía pélvica, enfermedad tubo-ovárica inflamatoria o grandes fibromas fúndicos. Otras fuentes poco frecuentes de vascularización fibromatosa pueden ser la arteria del ligamento redondo o las arterias lumbares. La aortografía posembolización puede ayudar a descubrir esta aferencia arterial residual.10
Opciones terapéuticas
Los fibromas sintomáticos se han tratado clásicamente con medicamentos (hormonas) o con la cirugía (miomectomía). En el primer caso suelen utilizarse los agonistas liberadores de gonadotropina, antiinflamatorios no esteroideos, anticonceptivos orales, progesterona y andrógenos, empleados en forma temporal para reducir previo a la cirugía la vascularización y el tamaño tumoral. La principal desventaja en el tratamiento hormonal, es el rápido crecimiento del mioma en pocos meses, una vez suspendido el tratamiento. Cabe destacar, la presencia de otros efectos adversos como osteoporosis, síntomas menopáusicos y amenorrea.
En relación al tratamiento quirúrgico (histerectomía o miomectomía) cabe destacar la alta morbilidad asociada, sobre todo en términos de pérdida hemática con necesidad de transfusiones, tiempo quirúrgico prolongado, complicaciones posoperatorias y alta estadía hospitalaria.11
En los últimos años se han reportado resultados muy favorables con el empleo de la ablación percutánea con microondas, como terapéutica alternativa en algunas pacientes portadoras de fibroma uterino.12
A los tratamientos clásicos referidos con anterioridad se ha agregado en la actualidad una variante terapéutica que parece resolver la sintomatología en más de un 90 %, siempre que exista una correcta selección de la paciente para realizar la embolización selectiva de las arterias uterinas.
Orígenes de la embolización terapéutica
El término “embolización terapéutica” (emboloterapia) significa la oclusión deliberada de un vaso sanguíneo y de los espacios vasculares, mediante la introducción de un cuerpo extraño o tejido biológico en el torrente sanguíneo, que interrumpe el flujo vascular de modo mecánico o por la producción de una intensa reacción inflamatoria de la pared, para lo cual se utiliza como control algún estudio de imagen. En 1972 se comienza a utilizar el IBCA (isobutil cianoacrilato) como agente embolizante, que fue precedido por la utilización de partículas de Gelfoam. En 1975 Gianturco introduce los coils y en 1982 Amplatz y colegas emplean el contraste calentado como medio de embolización.13
Los materiales de embolización se pueden clasificar como absorbibles (usados para oclusión temporal) y no absorbibles (para oclusión permanente). Dentro de los materiales absorbibles se encuentran el coágulo sanguíneo autólogo, coágulo sanguíneo autólogo modificado, Oxycel (celulosa) y Gelfoam (esponja de gelatina quirúrgica) y los no absorbibles como alcohol polivinílico (PVA), espirales metálicas o coils, microesferas de gelatina trisacrílica (embosferas), etanol absoluto y otros.14
La emboloterapia de los miomas se desarrolló en Francia y la primera publicación internacional sobre el tema aparece en 1995 en la revista Lancet, realizada por Ravina y colaboradores.14
En 1997, Goodwin y colaboradores publicaron los resultados preliminares de las primeras pacientes tratadas en EE. UU.15Los buenos resultados de este novedoso tratamiento condujeron a la expansión de la embolización de los miomas en todo el mundo, efectuándose hasta ese momento más de 60 000 de estas intervenciones.
El número de pacientes tratadas, en especial en Europa y EE. UU. demostró, de modo fehaciente, que no se trataba de un método “experimental”, sino de una opción terapéutica validada para pacientes bien seleccionadas.16
En aquellas mujeres en que se contempla la conservación del útero, la EAU tiene múltiples ventajas: no requiere anestesia general ni transfusiones innecesarias, pocas complicaciones, se evita el trauma psicológico de una cirugía mayor y permite al mismo tiempo una convalecencia más rápida.17
La EAU es el tratamiento ideal en mujeres premenopáusicas que deseen evitar la histerectomía, las transfusiones sanguíneas o tengan contraindicaciones para la anestesia general. Lo mismo sucede en las pacientes con fibromas múltiples de difícil acceso quirúrgico o en aquellas que presentan una recidiva posquirúrgica de su mioma en las miomectomías parciales.18
El tratamiento endovascular solo se debe realizar, cuando exista la certeza de que los síntomas son causados por los miomas, debiéndose descartar la existencia de otras enfermedades que pudieran ocasionar síntomas similares.19
Imaginología
Los exámenes imaginológicos previos al procedimiento son: ecografía transabdominal, transvaginal y la resonancia magnética (IRM):
- Ecografía transabdominal (US-TA): se realiza con la vejiga llena y bien distendida, usando transductores de 3,5 y 5 MHz, y se efectúan cortes longitudinales y transversales con angulaciones que permitan visualizar adecuadamente los órganos a estudiar.20
- Ecografía transvaginal (US-TV): se realiza con la vejiga vacía, usando transductores de alta frecuencia (5 a 7 MHz), se efectúan cortes longitudinales y transversales con diferentes angulaciones a fin de visualizar adecuadamente los órganos pélvicos.21
- Resonancia magnética (IRM) en secuencias T1, T2 y técnica de supresión grasa, con cortes axiales y sagitales que son muy importantes, no solo para localizar a los miomas, sino también para evaluar sus características, a fin de determinar si la embolización es el tratamiento adecuado.
Descripción de la técnica de embolización
Se utiliza un equipo de angiografía por sustracción digital (ASD), modelo Integris Allura de la Compañía Philips.
Previa asepsia y antisepsia de la región inguinal, preferiblemente del lado derecho, se infiltra lidocaína al 2 % (10 mL), con fines de anestesiar los planos superficiales y profundos.
Se procede a la punción de la arteria femoral, según la técnica de Seldinger, con un trocar No.18, seguido de la colocación de una guía metálica y del introductor arterial para catéteres 5F con técnica coaxial a través de la guía.
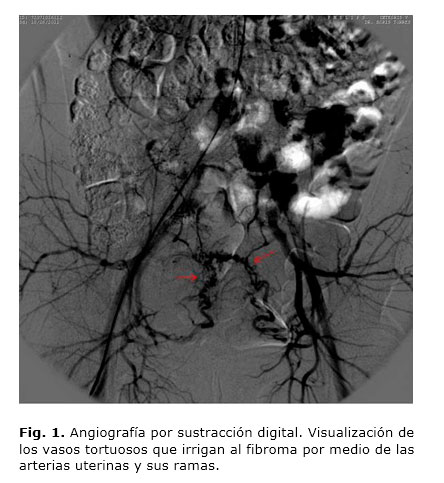
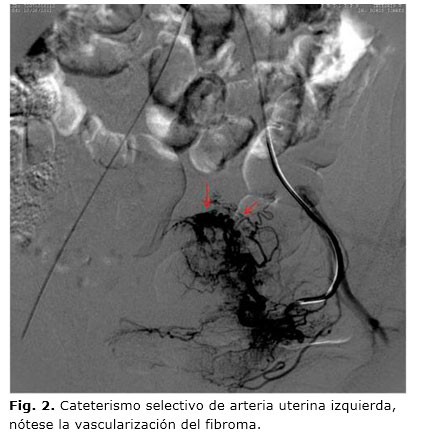
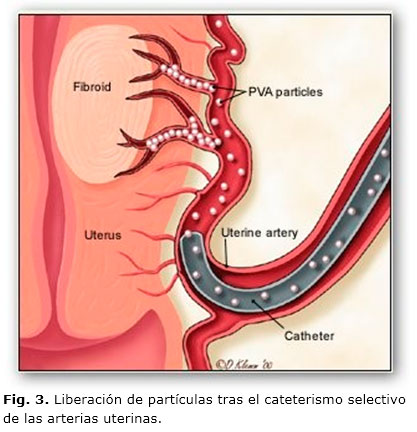
Una vez canalizada la arteria femoral y empleando un catéter tipo Cobra-2, 5F se realiza el cateterismo selectivo de ambas arterias ilíacas internas (Fig. 1), iniciando con la izquierda y colocando dicho catéter hasta la porción ascendente de la arteria uterina sobrepasando el nacimiento de la arteria cervicovaginal. A continuación se inyectan 4 mL de contraste yodado no iónico (Iopamiro-370) diluido en 6 mL de solución salina (10 mL total), para realizar mapeo angiográfico del o los fibromas, y comprobar el grado de su vascularización tumoral (Fig. 2). Luego de confirmar la correcta colocación del catéter y la vascularización del o los fibromas a tratar, se procede a la embolización con inyección a través del microcatéter de microesferas de polivinil alcohol (PVA) de calibre entre 700-900 µ o partículas de Gelfoam, diluidas dentro de una jeringa (Fig. 3), en una mezcla de solución salina y contraste yodado a partes iguales (10 mL), hasta producir un estancamiento circulatorio en la arteria uterina ascendente. Se considera suficiente la persistencia del contraste en dicha arteria durante no menos de cinco latidos cardiacos. El proceso termina luego de comprobarse, bajo control angiográfico, la desvascularización tumoral por bloqueo del flujo arterial, lo que va seguido del mismo proceder en la arteria uterina del lado opuesto.
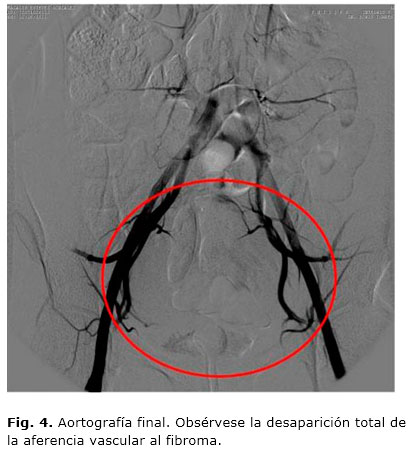
El estudio concluye con una aortografía abdominal posembolización (Fig. 4), luego de colocar un catéter angiográfico Pigtail 5F a la altura de la porción infrarrenal de la aorta abdominal, para confirmar el bloqueo completo de ambas arterias uterinas y descartar variantes anatómicas o vasos accesorios que puedan dar aferencia arterial al fibroma, en cuyo caso, y de acuerdo con el patrón vascular, se intenta la embolización súper selectiva de estos, a fin de evitar una isquemia en áreas no deseadas.23 Estos aportes vasculares anómalos son causas de fracaso de la técnica.18,24,25
Una vez finalizada la EAU se retira el introductor de catéter, se coloca un vendaje compresivo en el área de punción, se indica reposo en decúbito prono, manteniendo abrigado correctamente la extremidad utilizada para mantener la temperatura adecuada por 24 h. Se evalúan la tensión arterial, los pulsos periféricos, poplíteo, tibial anterior, posterior y pedio, la temperatura del miembro inferior cada 4 h, a fin de detectar cualquier complicación.
La paciente es egresada a las 24 h siguientes al proceder, de no existir ninguna complicación.
Es importante evaluar los riesgos y las potenciales complicaciones, realizando un buen monitoreo analgésico continuo, así como el empleo de antibióticos profilácticos para obtener resultados satisfactorios.
Como se puede deducir, el conocimiento de la anatomía vascular uterina y pélvica es condición indispensable para asegurar el éxito de la embolización y evitar efectos indeseados de las partículas embolizantes.
DISCUSIÓN
Los resultados son muy alentadores, ya que la disminución del volumen de los miomas es variable y oscila entre el 48 y 78 % de su volumen inicial, entre el 81 y 92 % de las pacientes. Según diferentes autores la EAU mejora o hace desaparecer los síntomas hemorrágicos, dolorosos o compresivos referidos por las pacientes, así como su estado físico. El procedimiento requiere hospitalización posterior al tratamiento durante 24 h y el 80 % de las pacientes reinicia sus actividades normales a los 4 días posteriores a la intervención.26
Con esta práctica, al realizar la oclusión de los vasos que irrigan el fibroma sin causar daño permanente en el útero, el proceso de isquemia, hace que el fibroma uterino sufra reducción volumétrica en lo que se llama proceso de degeneración hialina, lo que disminuye su tamaño y mejora la sintomatología de la paciente y su calidad de vida.27
A la hora de enfrentarse a una paciente portadora de fibroma uterino sintomático, se hace necesario el estudio y manejo de procedimientos que enriquezcan nuestro arsenal terapéutico, tal es el caso de la EAU.
De esta manera, se puede contar con otra herramienta para el tratamiento de las mujeres portadoras de un fibroma sintomático que, al parecer, bien seleccionadas constituye una opción terapéutica segura, económica, de excelentes resultados y ventajas bien establecidas, con respecto a los tratamientos convencionales.
REFERENCIAS BIBLIOGRÁFICAS
1. Lee HJ, Norvitz ER, Shaw J. Contemporary Management of fibroids in pregnancy. Rev. Obstet. Gynecol. 2010;3(1):20-7.
2. Broder MS, Kanouse DE, Mittman BS, Bernstein SJ. The appropriateness of recommendations for hysterectomy. Obstet Gynecol. 2000; 95:199-205.
3. Goodwin S, Spires J. Uterine Fibroid Embolization. N Engl J Med. 2009;361:691.
4. Williams P, Laifer S, Ragavendra N. US of Abnormal Uterine Bleeding. Radio Graphics 2003;23:703.
5. Pritts EA, Parker WH, Olive DL. Fibroids and infertility: an updated systematic review of the evidence. Fertil Steril. 2009;91:1215-23.
6. Razavi MK, Wolanske KA, Hwang GL, Sze DY, Kee ST, Dake MD. Angiographic classification of ovarian artery to uterine artery anastomoses: Initial observations in uterine fibroids embolization. Radiology. 2002;224(3):707-12.
7. Goldberg J, Pereira L. Pregnancy outcomes following treatment for fibroids: uterine fibroids embolization vs laparoscopic myomectomy. Curr Opin Obstet Gynecol. 2006;18:402-6.
8. Ryan S, Mc Nicholas M, Eustace S. Anatomía para el radiodiagnóstico. 2da ed. Madrid: Marban. 2007; pp. 235-42.
9. Andrews RT, Bromley PJ, Pfister ME. Succesful embolization of collaterals from the ovarian artery during uterine artery embolization for fibroids: a case report. J Vasc Intervent Radiol. 2000;11:607-10.
10. Domínguez J, Sabriá E, Giné L, Alba E, Sánchez A, Ponce J. Embolización arterial de miomas uterinos. Ginecología y Obstetricia Clínica. 2009;10(1):46-52.
11. García Mónaco RD, Testa R. Embolización de miomas uterinos. Rev. Hosp. Ital. B. Aires. 2006 ago;26(2):1-8.
12. Zang J, Feng L, Zang B, Ren J, Cai Li Z, Hu D. Ultrasound-guided percutaneous microwave ablation for symptomatic fibroid treatment. A clinical study. Int J Hyperthermia. 2011 Aug;27(5):510-6.
13. Vals O. Embolización percutánea por catéter. En: Vals O., editores. Manual de procedimientos básicos en Imaginología intervencionista. 1ra ed. Cuba: Ciencias Médicas; 2012. pp. 265-7.
14. Ravina JH, Herbreteau D, Ciraru-Vigneron N, y cols. Arterial embolization to treat uterine myomata. Lancet. 1995;346:671-2.
15. Goodwin SC, McLucas B, Lee M. Uterine artery embolization for the treatment of uterine leiomyomata midterm results. J Vasc Interv Radiol. 1999;10:1159-65.
16. Scrif BE, Vogelzang RL, Chrisman HB. Complications of uterine fibroids embolization. Semin Intervent Radiol. 2006;23:143-9.
17. Morris C. Update on uterine artery embolization for simptomatic fibroids disease. Abdom Imagin. 2008;33:104-11.
18. Lucino S, Ñañez M, Castellari M, Oulton C. Embolización arterial de miomas uterinos: resultados morfológicos y funcionales a corto y mediano plazo. RAR 2010;74(2):158-69.
19. Thanikasalam K, Marshburn PB, Mathews ML, Hurst BS. Uterine Artery Embolization for Fibroids. Calicut Medical Journal. 2007;5(4): 47-53.
20. Spielmann A, Keogh C, Forster B, Martin M, Machan L. Comparison of MRI and Sonography in the Preliminary Evaluation for Fibroid Embolization. AJR. 2006;187:1499-504.
21. Rumack C, Wilson S, Charboneau JW. Diagnóstico por ultrasonografía .2a ed. España: Marban; 2006. pp. 459-60.
22. Pelage JP, Cazejust J, Pluot E, Le Dref O, Laurent A, Spies J, Chagnon S, Lacombe P. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. Radio Graphics. 2005;25:S99–S117.
23. White A, Banovac F, Yusefi S, Salack R, Spies J.: Uterine Fibroid Embolization: The utility of aortography in detecting ovarian artery collateral supply. Radiology 2007;244(1):291-8.
24. Abbara S, Nikolic B, Pelage JP, Banovac F, Spies J.: Frecuency and extent of uterine perfusion via ovarian arteries observed during uterine artery embolization for leiomyomas. AJR. 2007 Jun;188:1558-63.
25. Nghia J, Torrance A. Uterine artery embolization: Safe and effective, minimally invasive, uterine-sparing tretment option for symptomatic fibroids. Seminars in Interventional Radiology. 2008;25(3):252-60.
26. Siskin G, Englander M, Stainken B, Ahn J, Dowling K, Dolen E. Embolic Agents Used for Uterine Fibroid Embolization. AJR 2000; 175:767-73.
27. Van T, Li N. Clinical care of patients undergoing Uterine Artery Embolization. Seminars Interventional Radiology. 2006;23(4):176-85.
Recibido: 3 de marzo de 2015.
Aprobado: 29 de marzo de 2015.
Dr. Juan Emilio Rodríguez Linares. Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana. Correo electrónico: emilio.rodriguez@infomed.sld.cu