Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.60 n.3 Ciudad de la Habana sep.-dic. 2008
ARTÍCULO ORIGINAL
Evaluación de la actividad de extractos marinos sobre Plasmodium falciparum in vitro y aspártico proteasas
Evaluation of the marine extracts action on Plasmodium falciparum in vitro and on aspartic proteases
Judith Mendiola MartínezI; Yasel Guerra BorregoII; Olga Valdés IglesiasIII; Maydelín Miguel MoralesIV; Ayda Hernández ZanuyV; Aymé Fernández-Calienes ValdésVI; Lázara Rojas RiveroVII; María de los Ángeles Chávez PlanesVIII
I Máster en Ciencias en Bioquímica. Investigadora Auxiliar. Instructora. Departamento de Parasitología, Instituto de Medicina Tropical "Pedro Kourí" (IPK). Ciudad de La Habana, Cuba.
II Licenciado en Bioquímica. Reserva científica. Centro de Estudios de Proteínas, Facultad de Biología, Universidad de La Habana. Ciudad de La Habana, Cuba.
III Máster en Ciencias en Bioquímica. Investigadora Auxiliar. Centro de Bioactivos Marinos. Ciudad de La Habana, Cuba.
IV Licenciada en Bioquímica. Reserva científica. Departamento de Parasitología. IPK. Ciudad de La Habana, Cuba.
V Doctora en Ciencias Biológicas. Investigadora Titular. Instituto de Oceanología. Ciudad de La Habana, Cuba.
VI Máster en Ciencias en Bioquímica. Investigadora Agregada. Departamento de Parasitología. IPK. Ciudad de La Habana, Cuba.
VII Doctora en Ciencias Médicas. Investigadora Titular. Departamento de Parasitología. IPK. Ciudad de La Habana, Cuba.
VIII Doctora en Ciencias Biológicas. Investigadora Titular. Profesora Titular. Centro de Estudios de Proteínas, Facultad de Biología, Universidad de La Habana. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: la búsqueda de nuevas drogas o alternativas terapéuticas para el tratamiento de la malaria es una alta prioridad en la lucha por el control de esta enfermedad. En la actualidad, varios estudios se concentran en la evaluación de inhibidores de proteasas de tipo aspártico presentes en la vacuola digestiva de Plasmodium falciparum, las cuales son parte de las enzimas que participan en la degradación de la hemoglobina. Los escasos reportes en la literatura sobre la purificación de inhibidores de proteasas aspárticas a partir de organismos marinos sugieren que constituyen una fuente de este tipo de moléculas prácticamente inexplorada.
MÉTODOS: las especies de invertebrados marinos Phallusia nigra, Bugula sp., Lyssodendoryx isodictyalis, Ascidia sydneiensis, Microscosmus goanus, Holothuria mexicana, Lytechinus variegatus y Echinaster sp. fueron colectadas en la localidad de Puerto Esperanza, Pinar del Río, en abril de 2006 y se prepararon extractos etanólicos. Se realizó la evaluación antimalárica in vitro contra Plasmodium falciparum de estos extractos con valores descriptivos de eficacia comparables a los utilizados internacionalmente. Los resultados se relacionaron con los hallazgos de los ensayos de inhibición de la actividad enzimática de pepsina como modelo de proteasa aspártica y con el perfil químico de metabolitos secundarios en estos extractos.
RESULTADOS: se encontró una buena reproducibilidad de la actividad antimalárica de los extractos de P. nigra, M. goanus y L. isodictyalis con concentraciones inhibitorias medias menores que 50 µg/mL. El extracto de M. goanus mostró la posible presencia de un inhibidor de pepsina. El perfil químico obtenido para las ascidias se corresponde con los principales compuestos reportados para las familias Pyuridae y Ascidiidae. La actividad antimalárica, así como la actividad inhibidora de pepsina, pudiera ser atribuida a algunos de los grupos de metabolitos secundarios detectados.
CONCLUSIONES: se recomienda el fraccionamiento de estos extractos para el aislamiento de los compuestos químicos responsables de las actividades biológicas obtenidas.
Palabras clave: Plasmodium falciparum, malaria, actividad antimalárica, plasmepsina, proteasas aspárticas, pepsina, organismos marinos.
ABSTRACT
BACKGROUND: the search for new drugs or therapeutic alternatives for malaria treatment is a high priority in the struggle against this disease. At present, several studies are focused on the evaluation of aspartic protease inhibitors present in the digestive vacuole of Plasmodium falciparum, which are part of the enzymes involved in hemoglobin degradation. The few reports in literature on the purification of aspartic proteases inhibitors from marine organisms suggest that they are a practically unexplored source of this type of molecules.
METHODS: marine invertebrate species Phallusia nigra, Bugula sp., Lyssodendoryx isodictyalis, Ascidia sydneiensis, Microscosmus goanus, Holothuria mexicana, Lytechinus variegatus y Echinaster sp.were detected in Puerto Esperanza area, Pinar del Rio province, on April 2006 and then ethanol extracts were prepared. In vitro antimalarial evaluation of these extracts against Plasmodium falciparum, with descriptive efficacy values being comparable with those used worldwide. The results were associated to the findings of aspartic protease model-like pepsin enzymatic action inhibition tests and to the chemical profile of secondary metabolites in these extracts.
RESULTS: good reproducibility of antimalarial action of P. nigra, M. goanus y L. isodictyalis extracts was found, being the average inhibitory concentrations lower than 50 µg/mL. M. goanus extract showed a possible pepsin inhibitor. The chemical profile for ascidians corresponded to the main compounds reported in Pyuridae y Ascidiidae families. The antimalarial activity as well as the pepsin inhibitory activity might be attributed to some of the detected secondary metabolites.
CONCLUSIONS: the breaking-up of these extracts is recommended in order to isolate the chemical compounds involved in the studied biological activities.
Key words: Plasmodium falciparum, malaria, antimalarial activity, plasmepsin, aspartic proteases, pepsin, marine organisms.
INTRODUCCIÓN
La malaria es la enfermedad parasitaria más importante en el mundo por causa de la alta morbilidad, mortalidad y el impacto socioeconómico que ocasiona en las poblaciones humanas afectadas. La resistencia a drogas antimaláricas en infecciones causadas por Plasmodium falciparum, se ha extendido e intensificado, lo que inició un declive en su eficacia, que incide en el incremento de la frecuencia y severidad de las epidemias. Por tanto, la búsqueda de nuevas drogas o alternativas terapéuticas para el tratamiento de la malaria es una alta prioridad en la lucha por el control de esta enfermedad.1
La caracterización bioquímica del genoma de Plasmodium falciparum ha permitido la identificación de numerosas moléculas que pudieran convertirse en blancos terapéuticos para el desarrollo de nuevos medicamentos.2 En la actualidad, varios estudios se concentran en la evaluación de inhibidores de proteasas de tipo aspártico presentes en la vacuola digestiva de P. falciparum llamadas plasmepsinas (PlmI, PlmII, PlmIV y proteasa histoaspártica [HAP]), las cuales son parte de las enzimas presentes en la especie P. falciparum que degradan la hemoglobina. Los resultados actuales de estudios de silenciamiento (knocknout/KO) de genes que codifican estas plasmepsinas sugieren que los parásitos son todavía viables a pesar de la pérdida de la expresión de cada una de las 4 plasmepsinas mencionadas y que la existencia de múltiples variantes enzimáticas puede limitar la utilidad de agentes muy específicos.3 Investigaciones más recientes describen la obtención de un cuádruple KO, el cual mostró una velocidad de crecimiento significativamente menor de P. falciparum en medio de cultivo RPMI estándar que la cepa salvaje.4 Se ha demostrado que la adición conjunta de inhibidores de enzimas de la clase aspártico y de tipo cisteíno produce la inhibición del crecimiento de los parásitos en cultivo y en modelos animales.5-7 Esto representa un desafío para el diseño de nuevos inhibidores, donde las estrategias actuales están basadas en la construcción de inhibidores multifuncionales,7-9 o de modo que se combinen un conjunto de inhibidores dirigidos a diferentes proteasas diana. Se ha sugerido también multifuncionalidad en aquellas moléculas que además de demostrar inhibición de plasmepsinas, muestran otros mecanismos de acción antimalárica aún no precisados. Estos resultados motivan el estudio de moléculas con blancos de acción alternativos que demuestren sinergismo con los inhibidores de plasmepsinas.
Investigaciones recientes demuestran que los organismos marinos pueden producir sustancias con actividad contra los parásitos maláricos.10 La diversidad y naturaleza peculiar de las estructuras químicas con actividad farmacológica que se han identificado en los organismos marinos11 justifican la búsqueda de nuevos compuestos antimaláricos en esta fuente natural. Así, se han aislado y purificado varias moléculas inhibidoras activas frente a tripsina, quimotripsina, elastasa de neutrófilos humanos, calicreína y otras proteasas de tipo serino, cisteíno y metalo.12-15 Los escasos informes en la literatura sobre la purificación de inhibidores de proteasas aspárticas a partir de organismos marinos sugieren que esta constituye una fuente prácticamente inexplorada de este tipo de moléculas.
En un estudio precedente se evaluaron un total de 71 especies de invertebrados marinos y algas colectados desde julio de 2000 hasta mayo de 2004, en zonas de la costa Noroccidental de Cuba. Como resultado de este (Mendiola J, Ramírez A, Salas E, Chávez MA, Hernández H, Rojas L, Acuña D, Robles-Laurencio R, Marcos Z, Hernández-Zanuy A. Actividad antimalárica in vitro de extractos de organismos marinos y su actividad inhibidora de plasmepsina II. [Presentación en Taller]. En: Informe del proyecto ID990948 de TDR/OMS, Instituto de Medicina Tropical "Pedro Kourí", Ciudad de La Habana, 2005), se observó que del total de especies encontradas con actividad inhibidora sobre plasmepsina II, 9 especies fueron consideradas las más activas contra el crecimiento in vitro de P. falciparum con concentraciones mínimas inhibitorias (CMI) en cultivo menores que 100 µg/mL, 4 presentaron una actividad moderada con valores de CMI que tomaron entre 100 y 500 µg/mL, y 9 fueron consideradas no activas por presentar CMI mayores que 500 µg/mL. Estos resultados permitieron la selección de un grupo de especies de organismos marinos sobre la base de la actividad antimalárica in vitro frente a P. falciparum que mostraron inhibición de la actividad de la Plm II en sus extractos acuosos, lo que no estuvo exento de efectos inespecíficos sobre ambos ensayos por la complejidad de los extractos. Sin embargo, estos extractos no fueron obtenidos mediante técnicas que generalmente favorecen la extracción de sustancias de baja y mediana polaridad con mayor potencia de acción antimalárica,10,16,17 por lo que se obtuvo una respuesta en un rango de dosis más elevado y no equivalentes, si se compara con los resultados obtenidos para extractos de plantas.18,19
El presente trabajo muestra los resultados de la evaluación antimalárica in vitro de extractos crudos etanólicos de 8 invertebrados marinos, en la cual fueron aplicados valores descriptivos de eficacia comparables a los utilizados internacionalmente, se relacionan los hallazgos de los ensayos de inhibición de la actividad enzimática de pepsina como modelo de proteasa aspártica, con los resultados de la inhibición del crecimiento in vitro de P. falciparum y se determinó la presencia de diferentes metabolitos secundarios en aquellos extractos, que por su actividad farmacológica, fueron seleccionados con vistas a diseñar el aislamiento y la purificación de los principios activos.
MÉTODOS
Droga antimalárica de referencia
Se utilizó la sal de difosfato de cloroquina (Sigma Co). Las soluciones madres se prepararon de inmediato antes del ensayo, en agua Milli-Q, las cuales fueron filtradas por membranas estériles de 0,22 mm y posteriormente diluidas en medio de cultivo completo.
Inhibidores de proteasas comerciales
Se utilizaron el isovaleril pepstatin (IVP), como inhibidor de proteasas aspárticas y el trans-epoxisuccinil-L-leucilamido (4-guanidinio)-butano (E-64), como inhibidor de proteasas tipo cisteíno, ambos procedentes de la Sigma (USA). Ambas soluciones madres fueron preparadas en dimetilsulfóxido (DMSO) y almacenadas a -20 °C hasta su posterior utilización.
Preparación de los extractos
Las especies Phallusia nigra, Bugula sp., Lyssodendoryx isodictyalis, Ascidia sydneiensis, Microscosmus goanus, Holothuria mexicana, Lytechinus variegatus y Echinaster sp. fueron colectadas en la localidad de Puerto Esperanza, Pinar del Río, en abril de 2006. Las especies Palythoa caribaeorum, Ectyoplasia ferox Plexaurella dichotoma y Eunicea caliculata, fueron excluidas de la preparación en etanol por causa de factores como su toxicidad y problemas de disponibilidad. Los extractos crudos se obtuvieron por homogenización de los ejemplares de invertebrados marinos con etanol 80 % en una licuadora (Waring-Blendor, USA) por 2 min a la mayor velocidad, las suspensiones se mantuvieron en maceración a 4 ºC durante 72 h, con agitación ocasional. Las suspensiones fueron colectadas y centrifugadas a 10 000 g y el sobrenadante sometido a evaporación rotatoria al vacío a temperaturas cercanas a 40 ºC, hasta volumen constante o arrastre de sedimento con agua, seguido de liofilización y almacenamiento a -20 ºC. Los ejemplares de P. nigra y A. sydneiensis fueron disecados para la separación del cuerpo de su contenido estomacal y de las túnicas, inmediatamente después de su colecta. De la especie M. goanus fueron separadas solo las túnicas. Estas fueron cortadas en tiras delgadas y maceradas en solución hidroalcohólica,20 las suspensiones obtenidas fueron clarificadas y concentradas como fue descrito antes. El resto de las especies fueron tratadas en su totalidad.
Ensayos de inhibición de pepsina. Cálculo de CI50
Para estos ensayos se preparó una solución madre de pepsina a una concentración de 10 mg/mL en tampón fosfato 0,2 mol/L pH 6. Se determinó la concentración de enzima activa en los ensayos según lo recomendado por Bieth.21 Para la titulación se utilizó IVP. La concentración final de enzima activa en los ensayos de inhibición fue del orden entre 2 y 3 x 10-8 M. La velocidad de reacción se midió a partir de la variación continua de la absorbancia a 310 nm, producto de la hidrólisis del sustrato cromogénico Leu-Ser-Phe(NO2)-Nle-Ala-Leu-OMe a una concentración final de 215 mmol/L.22 El sustrato se preparó en DMSO (15 mg/mL) y se almacenó a -20 ºC hasta su utilización. Se prepararon soluciones madres de los extractos etanólicos en DMSO a concentraciones entre 40 y 100 mg/mL en dependencia del extracto y se diluyeron en tampón de acetato de sodio (NaAc) 100 mM pH 4,0 y se mantuvieron en hielo durante el ensayo. El volumen de la mezcla de reacción fue de 800 mL y se utilizó NaAc 0,1 mol/L, pH 4,0 como tampón de actividad. Las concentraciones finales de DMSO en los ensayos no fueron mayores que 1 %. Se preincubó la enzima a concentración de 2 x 10-8 M con el extracto a evaluar durante 10 min, a 37 °C. Paralelo a los ensayos de inhibición se realizaron ensayos controles en ausencia de la muestra de organismos marinos. Ambos ensayos se realizaron a 37 ºC y se iniciaron por la adición de 10 mL de sustrato a la mezcla de reacción, como se describe para la titulación de pepsina. Los datos se colectaron mediante el empleo de un espectrofotómetro cinético Ultrospec 4000 (Amersham Bioscience, USA) acoplado a una computadora.
Las velocidades iniciales se midieron en la zona lineal de la curva de absorbancia a 310 nm en función del tiempo. Se comprobó la existencia de una relación lineal entre la velocidad inicial y la concentración de enzima empleada en los ensayos. Con los valores de velocidad de los ensayos controles y los ensayos de inhibición, se calculó el valor de la actividad residual (?a?)= Vi/Vo. Con estos valores se construyó un gráfico de "a" versus la concentración de extracto, y por interpolación se obtuvo el valor de la concentración de extracto necesaria para lograr un valor de "a" igual a 0,5 (CI50).
Ensayo in vitro de la actividad antimalárica
El cultivo in vitro de las formas asexuales de P. falciparum Ghana (procedente del Laboratorio de Microbiología, Parasitología e Higiene de la Universidad de Amberes, Bélgica) fue realizado de forma continua en eritrocitos humanos A +, siguiendo la metodología de Trager y Jensen.23 La susceptibilidad de P. falciparum a los diferentes extractos se determinó en placas de 96 pocillos (TPP, Suiza), donde se ensayaron las concentraciones de 200 µg/mL y las diluciones dobles subsiguientes en medio de cultivo completo (medio RPMI 1640 + 20 % de suero sanguíneo A+). En cada pocillo se mezclaron iguales volúmenes de extractos diluidos y de preparaciones de cultivos en los cuales la parasitemia inicial fue de 1 % (con mayoría de anillos obtenidos por la descongelación con sorbitol) y el hematócrito de 2 %. En todos los casos la concentración de DMSO se mantuvo por debajo de 0,5 % y se prepararon controles para cada dilución del solvente. La incubación se realizó a 37 ºC durante 48 h, en una atmósfera de 85 % de N2, 5 % de CO2 y 10 % de O2, obtenida por la combustión de una vela en una jarra desecadora. Utilizando láminas portaobjetos se realizaron extensiones finas de las muestras de cada pocillo, las cuales fueron fijadas en metanol y teñidas con Giemsa. La estimación de la inhibición del crecimiento de P. falciparum se realizó mediante el método directo de conteo microscópico de acuerdo con la metodología recomendada por Schlichtherle y otros.24
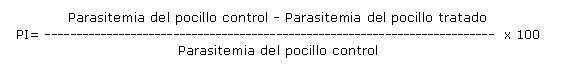
El porcentaje de inhibición (PI) se calculó según la fórmula siguiente:
Para los extractos alcohólicos se determinó la concentración inhibitoria media (CI50) que se define como la concentración que inhibió el crecimiento del parásito a 50 %. La CI50 de la droga se puede determinar a través de una interpolación lineal según la ecuación25 siguiente:
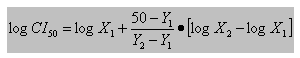
X1: concentración de la droga que provoca una inhibición de la parasitemia Y1 > 50 %.
X2: concentración de la droga que provoca una inhibición de la parasitemia Y2 < 50 %.
Caracterización química de los extractos orgánicos con actividad antimalárica
La caracterización química de los extractos crudos liofilizados fue realizada a partir de alícuotas de las muestras disueltas en agua destilada, mediante ensayos químicos cualitativos para la identificación de metabolitos secundarios,26 y los resultados positivos fueron confirmados mediante cromatografía en capa delgada (CCD) acoplada a las mismas pruebas químicas. Para las CCD se utilizaron placas preelaboradas de aluminio (5 x 5 cm) cubiertas con sílica gel G60 F254 (Merck) y las fases móviles siguientes: diclorometano-metanol (9,5:0,5 v/v) y acetato de etilo-metanol-agua-ácido fórmico (100:18:9:1 v/v). Los espectros de UV-visible de los extractos hidroalcohólicos crudos y liofilizados se obtuvieron en un espectrofotómetro Shimadzu, modelo UV-1201 (Japón), con un rango de longitud de onda de 200 a 800 nm, en cubeta de cuarzo de 1 cm. Las determinaciones se realizaron a las muestras con una dilución de 1 mg/mL en metanol, que fue utilizado como referencia según Hirose y otros.20
RESULTADOS
Ensayo in vitro de la actividad antimalárica
El efecto de los extractos crudos etanólicos sobre el crecimiento in vitro de P. falciparum Ghana se presenta en la tabla 1. Los 3 extractos obtenidos después de la extracción con etanol 80 % que se consideraron activos contra P. falciparum Ghana fueron: P. nigra (CI50= 45 ± 2,82 mg/mL); L. isodictyalis (CI50= 42 mg/mL) y M. goanus (CI50= 34,13 ± 2,73 mg/mL), porque la CI50 fue menor que 100 mg/mL, valor límite recomendado internacionalmente. El resto de las muestras se consideraron no activas; incluidos los contenidos estomacales de P. nigra y A. sydneiensis. El extracto de túnicas de P. nigra presentó actividad similar al cuerpo, pero la túnica de M. goanus no se consideró activa (resultados no mostrados).
La CI50 obtenida para la cloroquina fue igual que 16 nM para la cepa Ghana de P. falciparum, en las condiciones de laboratorio empleadas, la cual mostró la sensibilidad esperada.27 El IVP fue el compuesto sintético con la CI50 más alta (55 mM), mientras el E-64 presentó una CI50 igual que 3,7 mM.
Ensayos de inhibición con pepsina para P. nigra, A. sydneiensis, L. isodictyalis y M. goanus. Cálculo de la CI50
De los extractos evaluados, solo el de M. goanus mostró una actividad inhibidora de pepsina dependiente de la cantidad de extracto añadida al ensayo. Cantidades crecientes de extracto provocaron un aumento del grado de inhibición de la enzima en el ensayo (fig.). El valor de CI50 calculado fue de 501,55 mg/mL (tabla 1). En los extractos de P. nigra y A. sydneiensis se detectó una disminución de la velocidad inicial en los ensayos de inhibición, sin embargo, no fue posible obtener curvas de dosis-respuesta por causa de interferencias presentes en los extractos, porque se consideraron válidos solo aquellos valores de velocidad inicial obtenidos con valores de absorbancia a 310 nm menores que 1,5.
Caracterización química de los extractos orgánicos con actividad antimalárica
Los extractos etanólicos de M. goanus y P. nigra fueron finalmente seleccionados por sus actividades antimaláricas reproducibles y menor citoxicidad que el extracto de L. isodictyalis.28
En las muestras crudas hidroalcohólicas del cuerpo y de la túnica de P. nigra se detectó mediante espectrofotometría la presencia de sustancias de fuerte absorción UV, con máximos de absorción a 319 nm para el primero, y a 312 nm y 359 nm para la segunda. También en estas muestras se observaron bandas en CCD donde se detectaron aminoácidos mediante la reacción de la ninhidrina (tabla 2) y bandas de fluorescencia intensa con lámparas de emisión l 365 nm, de similar corrimiento que en el caso de la túnica (resultados no mostrados), lo que sugiere la presencia de aminoácidos similares a la micosporina (estructuras de anillos de ciclohexenonas y cicloheximinas conjugadas a una subunidad de aminoácido y en algunos casos enlazados a varios carbohidratos.29 Los máximos de absorción en la región UV, así como la fuerte reactividad al FeCl3 en muestras de P. nigra (tabla 2) sugieren además la presencia de tunicromos (pigmentos formados por aminoácidos enlazados entre sí y modificados con residuos de 3,4,5-trihidroxifenilalanina (catecol) y 3,4-dihidroxifenilalanina (pirogalol).30 En el caso de M. goanus, el máximo de absorción UV, posiblemente relacionado con micosporinas, se detectó en el cuerpo a longitud de onda 313 nm y también los extractos fueron reactivos a la ninhidrina. Sin embargo, en la región visible del espectro se destaca la fuerte absorción a 439 nm en el extracto del cuerpo de M. goanus relacionada con la presencia de pigmentos, quizás de carotenoides por su mayor solubilidad en las fases menos polares. Los carotenoides son pigmentos naturales que forman estructuras regulares de 40 carbonos, muy conjugadas, y que en uno de sus extremos sufren ciclización para formar un anillo de b-ionona que de manera adicional puede estar sustituido por grupos oxo, hidroxi o epoxi.31 En estos extractos también se observó reactividad muy positiva a la prueba de alcaloides, pero no se aislaron bandas reactivas en las CCD con la utilización de diferentes fases móviles. En las 2 especies se detectó además la presencia de esteroides o triterpenos (o ambos) mediante CCD (tabla 2). En los contenidos estomacales y las túnicas se evidencia en la región visible la presencia de clorofilas principalmente, además de otros pigmentos derivados quizás de la dieta vegetal (tabla 2).
DISCUSIÓN
Las proteasas de tipo aspático se encuentran agrupadas en familias y clanes en función de la similitud estructural existente entre ellas. La pepsina es la enzima representativa de la familia A1, Clan AA, de ahí el nombre de plasmepsinas a las proteasas aspárticas de Plasmodium. La estrategia general del diseño de inhibidores de aspártico proteasas se ha basado sobre todo en el uso, como molde, de la estructura del complejo tetraédrico que se alcanza durante la catálisis. Como consecuencia de esto, los compuestos que mimetizan a este complejo se unen mucho más fuerte que el sustrato y son resistentes a la ruptura enzimática. Como ejemplo de funciones químicas con las cuales se logra este efecto están las amidas reducidas, estatinas, hidroxietilaminas, hidroxipropilaminas, norestatinas, dihidroxietilenos, fosfinatos y difluorocetonas.12 Además del diseño racional y el tamizaje de librerías, la búsqueda entre los productos naturales ha conducido a la identificación de inhibidores de Plm II no peptídicos (ácido elágico; 3,4,5-trimetoxifenil [6-o-galoyl]-b-D-glucopiranósido; alcaloides aislados de Albizia adinocephala y compuestos procedentes de la esponja Smenospongia aurea de Jamaica).12 Aunque estos inhibidores muestran solo una potencia moderada frente a estas enzimas, la posibilidad de interferir con el estado de transición se puede explicar a partir de la presencia en su estructura de grupos hidroxilos, carbonilos y átomos de nitrógeno.32 Sin embargo, en el caso del extracto de M. goanus, la curva dosis-efecto no solo confirma la presencia de un inhibidor de pepsina en este extracto, sino también la tendencia de la curva sugiere un comportamiento típico de un inhibidor fuerte de proteasas de tipo aspártico, como las plasmepsinas, lo que representaría tener una molécula con un valor de Ki posiblemente menor que 10-8 M de acuerdo con lo planteado por Bieth,27 que convierte a esta especie en muy promisoria para estudios de continuación.
Se ha explicado previamente que la esencialidad de las plasmepsinas se manifiesta solo cuando son inhibidas las 4 variantes génicas que se expresan en la vacuola digestiva. El IVP se utilizó como control positivo por causa de las propiedades demostradas como inhibidor de estas enzimas.33 La biodisponibilidad es uno de los problemas que se han detectado en el desarrollo de inhibidores de plasmepsinas y es una característica compartida por el IVP.12 A pesar de este inconveniente, los resultados del presente trabajo de la adición de IVP a P. falciparum Ghana indican que esta cepa es susceptible de ser disminuido su crecimiento si se inhiben sus proteasas de tipo aspártico, de forma similar a la cepa 3D7,3 lo que permitió validar los resultados obtenidos en cultivo con el extracto de M. goanus.
El planteamiento de este mecanismo de acción para extractos de M. goanus debe realizarse con cautela. A pesar de que la preparación alcohólica de M. goanus reduce la actividad inespecífica, aún es una muestra compleja. Sería conveniente realizar el aislamiento del principio activo antimalárico (o varios) para que la inhibición de la actividad enzimática sea reevaluada. Los ensayos realizados con pepsina pudieran sugerir blancos alternativos novedosos muy relacionados con otras proteasas aspártico, pero además los blancos podrían ser completamente diferentes.
Los residuos catecol y pirogalol de los tunicromos y otras posibles sustancias del extracto de P. nigra le confieren un alto potencial para la formación de quelatos metálicos,30 específicamente con el hierro. Sustancias con esta clase de reactividad (desferrioxamina por ejemplo) son efectivas contra P. falciparum in vitro, contra varias especies de Plasmodium de roedores y en experimentos con monos Aotus sp., aunque en humanos se presentan problemas de recrudescencia. Varios mecanismos se han sugerido como explicación de su actividad antiparasitaria: desgaste de las fuentes de hierro del parásito, disociación del hierro en la hemozoína lo que libera componentes tóxicos e inhibición directa de metaloenzimas.34
El perfil químico obtenido para las ascidias en este trabajo se corresponde con los principales compuestos descritos para las familias Pyuridae y Ascidiidae.20,30,31,35 La actividad antimalárica in vitro mostrada por M. goanus y P. nigra, así como la actividad inhibidora de pepsina, pudiera ser atribuida a algunos de los grupos de metabolitos secundarios detectados. Procedimientos cromatográficos y espectroscópicos podrían recomendarse para abordar la identificación de los posibles principios activos antimaláricos.29,30,31
Los avances en la genómica y la proteómica han posibilitado la detección cada vez mayor de moléculas que constituyen dianas terapéuticas muy promisorias para el desarrollo de fármacos potencialmente eficientes contra la malaria. Estos avances han revolucionado las estrategias de búsqueda de fármacos o estructuras líderes que pueden ser luego convertidas en medicamentos más eficientes, mediante la identificación de moléculas con actividad inhibitoria frente a blancos moleculares y el uso de técnicas de alto rendimiento para el tamizaje ("HTS"), así como del diseño racional. Sin embargo, es necesario tener en cuenta que no siempre un compuesto activo in vitro puede presentar todas las características idóneas para convertirse en un buen medicamento, por lo que deben ser complementadas con ensayos sobre células en cultivo ("MTS") y no valorarse como un sustituto de este.6
La combinación de métodos "HTS" y "MTS", así como la caracterización química preliminar, aplicados en este trabajo, han permitido la identificación de 2 especies de organismos marinos con resultados interesantes para la búsqueda de nuevos compuestos antimaláricos; lo cual motiva el fraccionamiento de sus extractos guiado por ambos tipos de bioensayos, así como la profundización del estudio de sus mecanismos de acción antimalárica.
AGRADECIMIENTOS
A la colaboración imprescindible y entusiasta de la técnico Deyanira Acuña Rodríguez. Al apoyo necesario de los especialistas del Banco de Sangre de Marianao. A las recomendaciones aportadas por el doctor Colin Berry de la Universidad de Cardiff, del Reino Unido.
Institución patrocinadora: Programa de la OMS para la investigación y el entrenamiento en enfermedades tropicales (TDR).
REFERENCIAS BIBLIOGRÁFICAS
1. Nwaka S, Hudson A. Innovative lead discovery strategies for tropical diseases. Nat Rev Drug Discov. 2006;5:941-55.
2. Birkholtz LM, Bastien O, Wells G, Grando D, Joubert F, Kasam V. Integration and mining of malaria molecular, functional and pharmacological data: how far are we from chemogenomic knowledge space: Malaria J. 2006;5:110-34.
3. Liu J, Gluzman IY, Drew ME, Goldberg DE. The role of Plasmodium falciparum food vacuole plasmepsins. J Biol Chem. 2005;280:1432-7.
4. Bonilla JA, Bonilla TD, Yowell CA, Fujioka H, Dame JB. Critical roles for the digestive vacuole plasmepsins of Plasmodium falciparum in vacuolar function. Mol Microbiol. 2007;65:64-75.
5. Bailly E, Jambou R, Savel J, Jaureguibesry G. Plasmodium falciparum: differential sensitivity in vitro to E-64 (cysteine protease inhibitor) and pepstatin (aspartyl protease inhibitor). J Protozool. 1992;39:593-9.
6. Semenov A, Olson JE, Rosenthal PJ. Antimalarial synergy of cysteine and aspartic protease inhibitors. Antimicrob Agents Chemother. 1998;42:2254-8.
7. Ersmark K, Samuelsson B, Hallberg A. Plasmepsins as potential targets for new antimalarial therapy. Med Res Rev. 2006;26:626-66.
8. Eckstein JW. Malarial proteinases: a review of the recent patent literature. Drugs 2002;5:342-8.
9. Romeo S, Dell' Agli M, Parapini S, Rizzi L, Galli G, Mondani M et al. Plasmepsin II inhibition and antiplasmodial activity of primaquine-statine `double drugs'. Bioorg Med Chem Lett. 2004;14:2931-4.
10. Laurent. D, Pietra F. Antiplasmodial marine natural products in the perspective of current chemotherapy and prevention of malaria. Mar Biotechnol (NY). 2006;8:433-47.
11. Faulkner, DJ. Marine pharmacology. Antoine Leeuwenhoek 2000;77:135-45.
12. Pascual I, González Y, Alonso del Rivero M, Ramírez A, Salas, E, García R et al. Inhibidores de proteasas no proteicos aislados de organismos marinos. Non polypeptide proteases inhibitors isolated from marine organisms. Rev Biología. 2005;19:12-19.
13. Pascual I, Gil S, Cisneros M, Joseph-Bravo P, Díaz J, Possani LD et al. Purification of a specific inhibitor of pyroglutamyl aminopeptidase II from the marine annelide Hermodice carunculata. In vivo effects in rodent brain. Int J Biochem Cell Biol. 2004;36:138-52.
14. Lenarcic B, Turk V. Thyriglobulin type 1 domains in equistatin inhibit both papain like cysteine proteinases and cathepsin D J Biol Chem. 1999;274:563-6.
15. González Y, Pons T, Gil J, Besada V, Alonso del Rivero M, Tanaka AS et al. Characterization and comparative 3D modelling of CmPI-II, a novel "nonclassical" Kazal-type inhibitor from the marine snail Cenchritis muricatus (Mollusca). Biol Chem. 2007;388:1183-94.
16. Orhan I, Sener B, Atici T, Brun R, Perozzo R, Tasdemir D. Turkish fresh-water and marine macrophyte extracts show in vitro antiprotozoal activity and inhibit Fab I, a key enzyme of Plasmodium falciparum fatty acid biosynthesis. Phythomed. 2006;13:388-93.
17. Cos P, Vlietinck AJ, Berghe DV, Maes L. Anti-infective potential of natural products: How to develop a stronger in vitro 'proof-of- concept'. J Ethnopharmacol. 2006;106:290-302.
18. Muñoz V, Sauvain M, Bourdy G, Callapa J, Rojas I, Vargas L, et al. The search for natural bioactive compounds through a multidisciplinary approach in Bolivia. Part II. Antimalarial activity of some plants used by Mosetene Indians. J Ethnopharmacol. 2000;69:139-55.
19. Osorio E, Arango GJ, Jiménez N, Alzate F, Ruiz G, Gutiérrez D et al. Antiprotozoal and cytotoxic activities in vitro of Colombian Annonaceae. J Ethnopharm. 2007;111:630-5.
20. Hirose E, Ohtsuka K, Ishikura M, Maruyama T. Ultraviolet absorption in ascidian tunic and ascidian-Prochloron symbiosis J Mar Biol Ass UK. 2004;84:789-94.
21. Bieth, J.G. Theoretical and practical aspects of proteinase inhibition kinetics. En: Methods in Enzymology. Vol 248. New York: Academic Press; 1995. p. 59-84.
22. Martin P, Trieu-Curot P, Collin JC, Ribadeau-Dumas B. Purification and characterization of bovine gastricsin. Eur J Biochem. 1982;122:31-9.
23. Trager W, Jensen JB. Human malaria parasites in continuous culture. Science. 1976;193:673-675.
24. Schlichtherle M, Wahlgren M, Perlmann, Scherf A. Methods in malaria research. 3 ed. Virginia: Malaria Research and Reference Reagent Resource Center; 2000.
25. Huber W, Koella JC. A comparison of three methods of estimating EC50 in studies of drug resistance of malaria parasites. Acta Trop. 1993;55:257-61.
26. Ministerio de Salud Pública de Cuba. Guía metodológica para la investigación fitoquímica en plantas medicinales. Ciudad de La Habana: MINSAP; 1995.
27. Van Miert S, Jonckers T, Cimanga K, Maes L, Maes B, Lemière G, et al. In vitro inhibition of a-haematin formation, DNA interactions, antiplasmodial activity, and cytotoxicity of synthetic neocryptolepine derivatives. Exp Parasitol. 2004;108:163-8.
28. Mendiola J, Hernández H, Sariego I, Rojas L, Otero A, Ramírez A et al. Antimalarial activity from three ascidians: an exploration of different marine invertebrate phyla. Trans Roy Soc Trop Med Hyg. 2006;100:909-16.
29. Volkmann M, Gorbushina AA. A broadly applicable method for extraction and characterization of mycosporines and mycosporine-like amino acids of terrestrial, marine and freshwater origin. FEMS Microbiol Lett. 2006;255:286-95.
30. Taylor SW, Kammerer B, Bayer E. New perspectives in the Chemistry and Biochemistry of the tunichromes and related compounds. Chem Rev. 1997;97:333-46.
31. Ookubo M, Matsuno T. Carotenoids of sea squirts- II. Comparative biochemical studies of carotenoids in sea squirts. Comp Biochem Physiol. 1985;81B:137-41.
32. Wyatt DM, Berry C. Activity and inhibition of plasmepsin IV, a new aspartic proteinase from the malaria parasite, Plasmodium falciparum. FEBS Lett. 2002;513:159-62.
33. Dunn BM. Structure and mechanism of the Pepsin-Like family of aspartic peptidases. Chem Rev. 2002;102:4431-58.
34. Golenser J, Domb A, Mordechal-Daniel T, Leshem B, Luty A, Kremser P. Iron chelators: correlation between effects on Plasmodium spp. and immune functions. J Parasitol. 2006;92:170-77.
35. Slantchev K, Yalcin F, Ersoz T, Nechev J, Calis I, Stefanov K et al. Composition of lypophylic extracts from two Tunicates, Styela sp. and Phallusia sp. from the Eastern Mediterranean. Z Naturforsch [C] 2000;57:534-40.
Recibido: 26 de febrero de 2008.
Aprobado: 28 de septiembre de 2008.
Lic. Judith Mendiola. Instituto de Medicina Tropical "Pedro Kourí". AP 601, CP 11300, Ciudad de La Habana, Cuba. Correo electrónico: mendiola@ipk.sld.cu














