Introducción
El término lepidopterismo se utiliza de forma generalizada para describir los efectos tóxicos, locales y sistémicos, producidos en humanos por las formas adultas (mariposas, polillas) mientras que a las manifestaciones clínicas asociadas con los estados inmaduros de las mariposas se les conoce como erucismo.1
Las mariposas pertenecen a la clase Insecta, orden Lepidóptera, que comprende más de 160.000 especies y se subdivide en dos subórdenes: Rhopalocera (mariposas diurnas) y Heterocera (mariposas nocturnas o polillas). A este último grupo pertenecen las familias Megalopygidae, Limacodidae y Saturniidae, que son las más importantes desde el punto de vista médico y toxinológico en sus formas larvarias.2
En Latinoamérica, la principal familia reportada como causante de erucismo es la familia Saturniidae.1 Dentro de la familia Saturniidae, solo las formas larvales (es decir, orugas) del género Lonomia pueden causar reacciones sistémicas en humanos. De las 26 especies encontradas en el continente americano, solo unas pocas especies se consideran de importancia médica.1,3
Hasta el momento, solo dos especies se han relacionado formalmente con accidentes por envenenamiento: Lonomia achelous y Lonomia obliqua.4L. achelous se encuentra en las porciones amazónicas de Brasil, Venezuela, Colombia, Perú, Ecuador y las Guayanas. L. obliqua se encuentra en el área no amazónica de Brasil, Paraguay, Argentina y Uruguay.4
Los primeros registros de envenenamiento por orugas de Lonomia en América del Sur provienen de Venezuela en 1967, atribuidos a Lonomia achelous. Desde entonces, se han reportado varios accidentes. En Brasil, el Ministerio de Salud notificó 1.930 casos entre 2001 y 2006. En Colombia, el primer accidente mortal se notificó en 2000 y la especie involucrada fue nuevamente identificada como L. achelous. También se han notificado accidentes en Perú en 2006, 2010 y 2016 (especie no identificada), en Argentina (todos los casos de la provincia de Misiones y atribuidos a L. obliqua) y en la Guayana Francesa (atribuidos a L. achelous).5
Además, recientemente se reveló la capacidad de otras dos especies para inducir un síndrome hemorrágico similar en ratas, Lonomia orientoandensis y Lonomia casanarensis.5
Si bien la coagulopatía de consumo causada por el extracto crudo de cerdas de L. obliqua se debe al agotamiento de los factores de coagulación y la activación de la fibrinólisis, los estudios han demostrado que el extracto de L. achelous aumenta la fibrinólisis, con una marcada reducción de los niveles plasmáticos del factor XIII.3
Las orugas de Lonomia son gregarias, formando grupos de más de cincuenta individuos con coloración críptica que permanecen inactivas en los troncos de los árboles durante el día y se activan durante la noche para alimentarse de las hojas del árbol huésped. Sus espinas tienen glándulas de veneno unicelulares sin poros para la liberación de veneno; cuando una columna vertebral se rompe después de tocar o penetrar una superficie rígida, como la piel humana, se libera el veneno. Los incidentes tienden a ocurrir cuando las personas se exponen accidentalmente a colonias de orugas que descansan sobre los troncos de los árboles durante el día.5
Existe un aumento en el número de casos, que se atribuye a diversas causas como los cambios climáticos, la iluminación artificial y la intervención del hombre en el medio ambiente. La población de mayor riesgo son las personas que están dispersas en zonas rurales y los trabajadores de áreas silvestres por la distribución y hábitat de las larvas.6
El objetivo de este trabajo es describir un caso de síndrome hemorrágico asociado a contacto con Lonomia sp., intentando así proveer información sobre una condición poco conocida en Latinoamérica y de gran relevancia clínica y sanitaria para la región de Latinoamérica.
Caso clínico
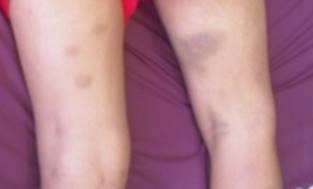
Paciente escolar masculino, de 12 años, habitante de comunidad rural de La Paragua, Estado Bolívar, Venezuela, sin antecedentes familiares o personales de relevancia, quien posterior a contacto con oruga en antebrazo izquierdo (Figura 1) comienza a presentar dolor local de fuerte intensidad, fiebre no precedida de escalofríos, no cuantificada y vómitos de contenido alimentario. Al día siguiente apareció hematoma en región submentoniana que limitaba apertura bucal, por lo que acude a centro de salud de su localidad, donde fue evaluado, siendo derivado al Complejo Hospitalario Ruíz y Páez. En la exploración física de ingreso, se observó en región sublingual hematoma que limitaba la apertura bucal, y múltiples hematomas localizados en extremidad superior derecha y en ambas extremidades inferiores (Figura 2). Se realizó analítica en la que presentaba: hemoglobina: 10,8 gr/dl, hematocrito: 35,5 %, leve leucocitosis con predominio de neutrófilos (leucocitos: 10900×109/L, neutrófilos: 85,2 %, linfocitos: 13,8 %, monocitos: 0,3 %, eosinófilos: 1,1 %), plaquetas: 132000×109/L, glucemia: 146 mg/dl, urea: 46,1 mg/dl, creatinina: 0,6 mg/dl, TGO: 32 UI, TGP: 13 UI, VSG: 2mm/h, PT y PTT prolongados (PT 21,7 seg. PT control 11,8 seg; PTT 41,4 seg, PTT control 28,8 seg), fibrinógeno: 207 mg/dl. En los siguientes días de hospitalización se reporta una disminución aún mayor de los valores de fibrinógeno, llegando a 73 mg/dl en su tercer día de hospitalización.
Por la historia, el cuadro clínico y la observación de la oruga entregada por los familiares del paciente se llega al diagnóstico de síndrome hemorrágico secundario a contacto con oruga Lonomia sp.
Se indicaron medidas de soporte, analgesia con ketoprofeno 5mg/kg/día, ciclokapron 10 mg/kg/día, vitamina K vía endovenosa cada 24 horas, dexametasona 15mg/kg/día, ácido ε-aminocaproico (EACA) 300 mg/kg, luego 15 mg/kg/día. Además, se administraron 2 unidades de plasma fresco congelado el 2do y 3er día de hospitalización.
El paciente presentó mejoría clínica y analítica progresiva, encontrándose al quinto día los parámetros de coagulación normales, por lo que fue dado de alta al 7mo día de hospitalización.
Discusión
La presentación clínica del lonomismo se caracteriza inicialmente por dolor intenso en el sitio de contacto, seguido de cefalea y dolores generalizados. Entre 8 y 72 h después, pueden ocurrir trastornos sistémicos de la coagulación (sangrado, gingivorragia, equimosis, hematoma, coagulación intravascular diseminada, petequias) con la consiguiente insuficiencia renal aguda. La severidad de los síntomas es variable, dependiendo del número de larvas que entran en contacto con la piel, la intensidad del contacto y las características individuales de la víctima. Sin un tratamiento de emergencia adecuado, las víctimas pueden morir.7
Se ha descrito que los exámenes hematológicos pueden mostrar anemia leve con leucocitosis, tiempos prolongados de protrombina, tromboplastina parcial y trombina, así como también, una disminución en los niveles de fibrinógeno, factor V, FXIII, plasminógeno y a2-antiplasmina. Además, niveles aumentados de factor VIII:c, factor de von Willebrand y productos de degradación de fibrina/dímeros D. Los niveles de antitrombina III y plaquetas se pueden mantener normales, mientras que los niveles de factor VII, factor II y proteína C pueden variar.8
Se ha sugerido que el síndrome hemorrágico resultante del contacto con la oruga de L. achelous es causado principalmente debido a la activación de la fibrinolisis y por coagulación intravascular diseminada leve. La intensa actividad fibrinolítica presente en los pacientes envenenados por L. achelous es consecuencia de la enzima proteolítica/similar a la uroquinasa del factor XIII (lonomina II) y del factor XIII, las cuales podrían desempeñar el papel más importante en las manifestaciones hemorrágicas. En las plaquetas, el bloqueo o la proteólisis de la integrina y/o las proteínas de la matriz extracelular que inhiben la adhesión y agregación pueden contribuir al síndrome hemorrágico que se encuentra comúnmente en pacientes expuestos a la oruga de L. achelous.9
Además, la hemolinfa de L. achelous induce activación endotelial y de macrófagos. A su vez, estas células activadas podrían generar enzimas fibrinolíticas y factor tisular, así como mediadores proinflamatorios, principalmente TNF-α, que potencian esta liberación. Así, esta citoquina puede aumentar el efecto hemostático y finalmente las manifestaciones hemorrágicas exacerbadas observadas en humanos, mediante la liberación de elastasa de los neutrófilos, así como la liberación de activadores del plasminógeno (tPA y uPA) de las células endoteliales, con la subsiguiente formación de plasmina.10
En el caso de L. obliqua, sus toxinas tienen actividades hemolíticas directas e indirectas, cardiotóxicas, miotóxicas y genotóxicas, así como efectos sobre la adhesión y agregación plaquetaria.11
El diagnóstico de envenenamiento por Lonomia se basa en la presencia de coagulopatía o hemorragia sistémica en un paciente que tuvo contacto cutáneo con orugas en las 48 horas previas.12 Se han establecido los criterios de gravedad en 3 grados: 1) los casos leves muestran sólo manifestaciones locales; 2) los casos moderados pueden incluir manifestaciones locales y sangrado en piel/mucosas y coagulopatía leve; y 3) los casos graves se presentan con síntomas previos asociados con sangrado visceral o potencialmente mortal.13
La letalidad del envenenamiento lonómico en ausencia de un tratamiento específico es de 1,5 a 2,0 %, que es aproximadamente 3 a 4 veces mayor que la letalidad de las mordeduras de serpiente.12 Desde 1994, el tratamiento recomendado del envenenamiento por contacto con orugas de Lonomia en Brasil es el uso de suero antilonómico, que se produce utilizando un extracto de L. obliqua scoli como antígeno.11
Antes de la terapia con suero antilonómico, experiencias previas en Venezuela demostraron que las terapias de reemplazo con sangre total, plasma fresco o congelado, o crioprecipitados contribuyen a las consecuencias clínicas adversas del envenenamiento, muy probablemente porque este tipo de tratamiento proporciona factores de coagulación adicionales que exacerban la coagulación intravascular inducida por toxinas circulantes. Se ha notificado el cese de evidencia clínica de hemorragia después del tratamiento con fibrinógeno humano purificado y fármacos antifibrinolíticos, como la aprotinina y el ácido ε-aminocaproico (EACA).12) En el caso presentado, el paciente presentó mejoría clínica y de los parámetros de coagulación con la administración de ácido ε-aminocaproico.
Aunque el uso de ácido ε-aminocaproico (EACA) ha sido exitoso en detener el síndrome hemorrágico por L. achelous estudios recientes no lo recomiendan para L. obliqua ya que se ha visto altas tasas de mortalidad en experimentos con ratas.1
Se recomienda, que el tratamiento específico de los pacientes con síndrome hemorrágico por Lonomia se realice con la administración del suero antilonómico y no con el uso de fármacos antifibrinolíticos. Así mismo, debe evitarse la aplicación de sangre total, plasma fresco congelado o crioprecipitados, debido a que pueden inducir una coagulación intravascular diseminada.2
Conclusiones
El caso reportado describe un síndrome hemorrágico producido tras el contacto con orugas de Lonomia sp, en el que para su diagnóstico fue importante el cuadro clínico presentado por el paciente junto con la observación de la oruga. Con respecto al tratamiento, aunque el suero antilonómico es un tratamiento efectivo recomendado, al no contar con el mismo, se administró ácido ε-aminocaproico (EACA), presentado buena evolución clínica con normalización de los valores de coagulación.
Cabe agregar, que dada la presentación de casos de erucismo en diferentes países de Latinoamérica, es importante proveer de conocimiento a los profesionales de salud sobre su diagnóstico y manejo terapéutico, con la finalidad de evitar complicaciones graves.