Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.3 Ciudad de la Habana jul.-set. 2012
ARTÍCULO ORIGINAL
Índice hemolítico: una aproximación a los subfenotipos clínicos en niños con drepanocitosis
Hemolytic index: an approach to clinical subphenotypes in children with sickle cell disease
Dr. Alberto Arencibia-Núñez,I Dra. Yamilé Quintero-Sierra,IDr. Eliezer San Román-García,II Prof. Dra.Cs. Eva Svarch,I Dra. Adys Gutiérrez-Díaz,I Dr. Sergio Machín-García,I Dr. Alejandro González-Otero,I Dr. Jesús Serrano-Mirabal,I Dra. Andrea Menéndez-Veitía,I Dra. Marlén Domínguez-Toirac,I Dra. Tamara Delgado-VargasI
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Instituto de Cardiología y Cirugía Cardiovascular. La Habana, Cuba.
RESUMEN
Se realizó estudio prospectivo con el objetivo de calcular el índice hemolítico y determinar su asociación con las manifestaciones clínicas y de laboratorio. Se incluyeron 40 niños con anemia drepanocítica y Sbº talasemia atendidos en el Instituto de Hematología e Inmunología entre los años 2009-2010. El índice hemolítico se calculó a partir de los valores de deshidrogenasa láctica, bilirrubina y reticulocitos, utilizando el análisis de componentes principales, con media 0 y rango entre -3 y 3. Se compararon los pacientes del grupo 1, con índice hemolítico menor del 33 percentil (-3 a -0,71; n=13), con los pacientes del grupo 2, con índice hemolítico mayor del 66
percentil (0,84 a 3; n=14). En los pacientes del grupo 2 fue más frecuente el síndrome torácico agudo (38,5 % vs. 78,6 % p=0,034) y la enfermedad cerebrovascular (0 % vs. 28,6 %; p=0,037). La prevalencia de asma bronquial (p=0,080) e hipertensión arterial sistólica (p=0,076) tuvo tendencia a ser mayor en el grupo 2. El 42,9 % de los pacientes del grupo 2 tuvieron una velocidad de regurgitación tricuspídea ≥ 2,5 m/s, lo que no ocurrió en ningún paciente del grupo 1 (p=0,007). En el grupo 2 fueron más frecuentes las transfusiones (p=0,021) y el uso de hidroxiurea (p=0,081). La correlación de la velocidad de regurgitación tricuspídea con el índice hemolítico (r=0,61; p<0,0001) fue mucho mayor que con los otros marcadores de hemólisis incluidos en el análisis. El índice hemolítico permite diferenciar los pacientes con fenotipo hemolítico, los cuales tienen un comportamiento clínico característico.
Palabras clave: anemia drepanocítica, análisis de componente principal, hemólisis, hipertensión pulmonar.
ABSTRACT
A prospective study was performed in order to calculate the hemolytic index and determine its association with clinical and laboratory manifestations. Forty children with sickle cell anemia and Sß º thalassemia treated at the Institute of Hematology and Immunology from 2009 to 2010 were included in this study. The haemolytic index, with mean 0 and range between -3 to 3, was calculated from the values of lactate dehydrogenase, bilirubin and reticulocytes, using the principal component analysis. We compared patients in group 1 with less than 33 hemolytic index percentile (-3 to -0.71, n = 13), patients in group 2 with hemolytic index greater than 66 percentile (0.84 to 3; n = 14). Acute chest syndrome (38.5 % vs. 78.6% p = 0.034) and cerebrovascular disease (0 % vs. 28.6 %, P = 0.037) were more frequent in patients of group 2. The prevalence of asthma (p = 0.080) and systolic blood pressure (p = 0.076) tended to be higher in group 2; 42.9 % of patients in group 2 had tricuspid regurgitation velocity ? 2.5 m / s, which did not occur in any patient in group 1 (p = 0.007). Transfusions (p = 0.021) and the use of hydroxyurea (p = 0.081) were more frequent in group 2. The correlation of the tricuspid regurgitation velocity with haemolytic index (r = 0.61, p <0.0001) was significantly higher than other markers of hemolysis included in this analysis. This haemolytic index allows differentiating patients with hemolytic phenotype who have a characteristic clinical behavior.
Keywords: sickle cell anemia, principal component analysis, hemolysis, pulmonary hypertension.
INTRODUCCIÓN
Hasta hace pocos años, la hemólisis se consideraba un elemento secundario en la fisiopatología de la drepanocitosis.1,2 Sin embargo, en la última década se han desarrollado importantes investigaciones que han postulado la presencia de 2 subfenotipos clínicos, uno de los cuales está relacionado con la hemólisis intravascular crónica.3,4
La hemólisis intravascular crónica produce alteraciones en la biodisponibilidad del óxido nítrico,5-7 genera especies reactivas del oxígeno,8 activa los elementos de la hemostasia,9 y desarrolla un estado inflamatorio crónico.10 Los factores mencionados y otros menos conocidos, interactúan de forma dinámica desencadenando una disfunción endotelial que se expresa en mayor o menor medida en todos los pacientes.1
Desde el punto de vista clínico, los pacientes con subfenotipo hemolítico presentan menos crisis vasooclusivas dolorosas (CVOD), tienen baja frecuencia de necrosis de la cabeza de fémur y alta incidencia de úlceras maleolares, priapismo, hipertensión pulmonar (HTP) y accidente vascular encefálico (AVE) de carácter isquémico.1,2,4
En la actualidad se investiga extensamente el impacto de la hemólisis en los pacientes pediátricos para detectar precozmente las alteraciones descritas y diseñar estrategias efectivas que limiten la progresión del daño vascular crónico.11-14
En este trabajo se estudian las diferencias fenotípicas entre 2 grupos de pacientes pediátricos definidos a partir de su comportamiento hemolítico.
MÉTODOS
Se realizó un estudio prospectivo, que incluyó 40 niños con anemia drepanocítica (AD) y Sbº talasemia, atendidos en el Instituto de Hematología e Inmunología, entre los años 2009-2010. Los pacientes fueron estudiados en el contexto de una investigación diseñada para determinar las alteraciones en la circulación cardiopulmonar y su relación con la hemólisis.
La muestra se seleccionó de forma no aleatoria, consecutiva. Todos los pacientes se encontraban en estado basal (al menos un mes sin eventos agudos y 3 meses sin transfusiones) y los padres accedieron a participar en el estudio mediante consentimiento informado. El estudio fue aprobado por el consejo científico y el comité de ética de la institución.
Datos clínicos y de laboratorio
Los datos clínicos de los pacientes se obtuvieron por medio de la revisión de su historia clínica. El hemograma completo se realizó en un contador celular marca MINDRAY BC-3200 (Bio-Medical Electronics Co. Ltd, Shenzhen, China).
Los reticulocitos se realizaron por técnicas estandarizadas. Las variables bioquímicas séricas se determinaron en un equipo automatizado Hitachi Automatic Analyzer Modelo 902 (Hitachi High-Tech Science Systems, Japón) con el empleo de los estuches comerciales de la Helfa (Helfa Diagnósticos, Quimefa, La Habana, Cuba).15 Las determinaciones de deshidrogenasa láctica (LDH) y hemoglobina fetal (HbF) se realizaron por las técnicas recomendadas en la literatura.16,17
Evaluación cardio-respiratoria
Se establecieron los percentiles de la tensión arterial (TA) de acuerdo con la edad y la talla de los pacientes, basados en las recomendaciones del grupo norteamericano de trabajo para la hipertensión arterial en niños y adolescentes. Se consideró hipertenso a todo paciente cuya TA se encontrara por encima del 90 percentil.18
La ecocardiografía con Doppler se realizó en el Instituto de Cardiología y Cirugía Cardiovascular. Se utilizó un equipo Philips Sonos 5500 (Philips Medical Systems, Best, Holanda), con transductores apropiados para la edad. Después de un período de reposo de 10 min se visualizaron las estructuras cardíacas en modo M, a través de la ventana paraesternal, y se realizaron las mediciones correspondientes mediante los programas incorporados al equipo, de acuerdo con las recomendaciones de la Sociedad Norteamericana de Ecocardiografía.19
La velocidad de regurgitación tricuspídea (VRT) se determinó en las vistas eje corto y eje largo paraesternal y 4 cámaras apical y subcostal, tomando el valor máximo de estas mediciones. Se consideraron elevados los valores de VRT ≥ 2,5 m/s.19
Se midió la saturación de oxígeno (SaO2) con el oxímetro de pulso OXY 9800 (Equipos médicos COMBIOMED, Cuba). Se siguió la metodología recomendada por la Sociedad Norteamericana del Tórax.20
Análisis estadístico
Se confeccionó una base de datos en Microsoft Office Excel 2003 y se utilizó el procesador estadístico SPSS versión 11.5. A partir del análisis de componentes principales se generó una nueva variable,21 el índice hemolítico (IH) que se calculó a partir de los valores de LDH, bilirrubina y reticulocitos, y explica que el 67 % de la varianza de estos 3 componentes principales.
La muestra se dividió en 3 grupos a partir del cálculo de percentiles del IH, y se compararon los valores extremos. El grupo 1 quedó compuesto por los pacientes con IH menor del 33 percentil (-3 a -0,71; n=13), mientras que el grupo 2 presentaba un IH mayor del 66 percentil (0,84 a 3; n=14). El grupo de pacientes con valores intermedios se excluyeron del análisis de grupos.
El análisis de las variables cuantitativas se realizó mediante la prueba de t de Student y la prueba de correlación lineal, y las variables cualitativas se procesaron a partir de la prueba de Pearson c2. El valor de significación estadística se estableció en 95 %, con una tendencia a la significación en 90 % debido al tamaño de la muestra.
RESULTADOS
El cálculo del IH generó una nueva variable con una distribución normal, media de 0 y desviación estándar de 1,73; como se aprecia en la figura 1. Su valor mínimo fue -3 y el máximo +3. Para el análisis la muestra se dividió en 3 grupos a partir del cálculo de percentiles. Se compararon los individuos de los grupos extremos: el grupo 1 (barras naranjas) quedó compuesto por 13 pacientes con IH entre -3 y -0,71; mientras en el grupo 2 (barras verdes) se incluyeron 14 pacientes con IH entre 0,84 y 3.
La figura 2 muestra la correlación del IH con las variables a partir de las que se generó. Se encontró una fuerte correlación lineal con la LDH (r=0,61), la bilirrubina (r=0,73), y los reticulocitos (r=0,69); con una alta significación estadística (p<0,0001).En la tabla se observa la comparación de los pacientes de los grupos 1 y 2. En la muestra solo se incluyeron 3 pacientes con Sbº talasemia que estuvieron dentro del grupo 1.
Tabla. Comparación entre los pacientes según su ESTADO hemolítico
| Variables | Grupo 1 (n = 13) | Grupo 2 (n = 14) | p |
| Datos demográficos y fenotípicos | |||
| Sexo masculino, n (%) | 5 (38,5) | 7 (50) | 0,547 |
| Edad (años, X ± DE) | 11,3 ± 3,93 | 11,2 ± 3,42 | 0,914 |
| Fenotipo SS, n (%) | 10 (76,9) | 14 (100) | 0,057 |
| Manifestaciones clínicas | |||
| Crisis dolorosas por año (X ± DE) | 0,64 ± 0,51 | 0,83 ± 0,34 | 0,272 |
| Síndrome torácico agudo, n (%) | 5 (38,5) | 11 (78,6) | 0,034 |
| Enfermedad cerebro-vascular, n (%) | 0 (0) | 4 (28,6) | 0,037 |
| Secuestro esplénico, n (%) | 8 (61,5) | 7 (50,0) | 0,546 |
| Historia de dactilitis, n (%) | 5 (38,5) | 9 (64,3) | 0,179 |
| Alteraciones orgánicas | |||
| Asma bronquial, n (%) | 1 (7,7) | 5 (35,7) | 0,080 |
| Oximetría de pulso (X ± DE) | 95,3 ± 3,1 | 94,6 ± 2,9 | 0,346 |
| Hipertensión arterial sistólica, n (%) | 0 (0) | 3 (21,4) | 0,076 |
| Velocidad de regurgitación tricuspídea ≥ 2,5 m/s, n (%) | 0 (0) | 6 (42,9) | 0,007 |
| Microalbuminuria, n (%) | 5 (38,5) | 5 (35,7) | 0,883 |
| Tratamiento | |||
| Historia de transfusiones, n (%) | 7 (53,8) | 13 (92,9) | 0,021 |
| Hidroxiurea, n (%) | 6 (46,2) | 11 (78,6) | 0,081 |
| Esplenectomía parcial, n (%) | 3 (23,1) | 4 (28,6) | 0,745 |
X ± DE: media ± desviación estándar.
No se observaron diferencias en el número de crisis dolorosas, antecedentes de secuestro esplénico y dactilitis; sin embargo, en el grupo 2 fueron más frecuentes el síndrome torácico agudo (38,5 % vs. 78,6 %; p=0,034) y la enfermedad cerebrovascular (0 % vs. 28,6 %; p=0,037).
En los pacientes del grupo 2 fue más frecuente al asma bronquial y la HTA, con una tendencia a la significación en ambos casos. La VRT ≥ 2,5 m/s estuvo presente en el 42,9 % de los pacientes de este grupo, mientras todos los pacientes del grupo 1 tuvieron valores normales (p=0,007). La SaO2 y la microalbuminuria no mostraron diferencias significativas.
Solo un paciente del grupo 2 no había sido transfundido, lo cual hace más frecuente esta medida terapéutica en los pacientes con IH alto (53,8 % vs. 92,9 %; p=0,021). También fue más frecuente el tratamiento con hidroxiurea, con tendencia a la significación (p=0,081). No hubo diferencias en relación con el antecedente de esplenectomía parcial.
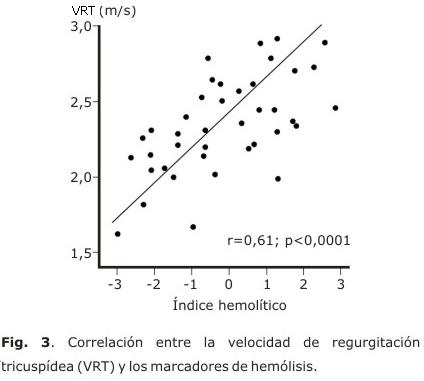
En la figura 3 se muestra la asociación entre los valores de VRT y el IH. La correlación de la VRT con el IH (r=0,61; p<0,0001) fue mayor que con los marcadores de hemólisis de forma independiente: LDH (r=0,43; p=0,005); bilirrubina (r=0,29; p=0,065); reticulocitos (r=0,21; p=0,195).
DISCUSIÓN
El IH reúne las características de los marcadores de hemólisis, y elimina la variabilidad entre ellos. La técnica de análisis de componentes principales fue aplicada con similares propósitos por un grupo de investigadores de Washington DC, en una muestra de niños con drepanocitosis,14,22 y ha sido ampliamente utilizada en el campo de las investigaciones biomédicas.23,24
Como se observa en la figura 1, el IH tiene una distribución normal. Los pacientes ubicados a la derecha del cero tendrán mayor propensión a la hemólisis, a diferencia de los que se encuentren en valores negativos, que tienden a la vasooclusión. No obstante, la mayoría de los casos se encuentran hacia el centro de la curva en la que ocurre la combinación de fenómenos clínicos que caracteriza a la enfermedad.1
La LDH es una enzima que se encuentra en el interior de los hematíes. Cuando ocurre la ruptura de estos y se vierte su contenido a la circulación, esta enzima se libera junto a la hemoglobina y la arginasa.4,5,7,25,26 A partir de los trabajos de Kato,1,2 la LDH se ha definido como el principal marcador de hemólisis y se relaciona además con cifras bajas de hemoglobina, reticulocitosis y niveles altos de bilirrubina.8,27,28
Los elementos clínicos asociados con el fenotipo hemolítico en niños difieren de los clásicamente descritos en adultos.11 En las edades pediátricas son poco frecuentes las úlceras maleolares y el priapismo, por lo tanto, estos eventos no son evaluables en nuestros pacientes.
En los enfermos con hiperhemólisis se detectó mayor frecuencia de STA y AVE de tipo isquémico. Estos datos se corresponden con lo publicado por otros autores.3,11,28
Durante la infección se activa el sistema inmunológico, lo que desencadena un estado inflamatorio agudo que se superpone a la inflamación crónica basal. Además, durante estos episodios hay un déficit agudo de arginina debido a la hiperhemólisis que ocurre en la sepsis, lo que deprime aún más la biodisponibilidad de óxido nítrico y profundiza la vasculopatía de la enfermedad.6,11
Las alteraciones pulmonares agudas y crónicas del tipo de asma/hiperreactividad bronquial, han mostrado una fuerte asociación con la presencia de HTP, que está muy vinculada con el fenotipo hemolítico.11,14,29
El AVE isquémico es también uno de los elementos clínicos asociados con este subfenotipo.14,29-32 El daño endotelial crónico repercute en los vasos del polígono de Willis y produce un estrechamiento de su luz que puede conducir progresivamente a la obliteración.2
Aunque las CVOD son más frecuentes en los pacientes con fenotipo vasooclusivo,33 no se encontró esta asociación con ninguno de los grupos analizados. Tampoco se observó asociación entre la hemólisis y los antecedentes de crisis de secuestro esplénico y dactilitis. Estos aspectos han sido poco estudiados en investigaciones precedentes.29,30,32
En los pacientes del grupo 2 hubo un aumento de la frecuencia de HTA sistólica. El compromiso vascular periférico es una de las alteraciones presentes en el fenotipo hemolítico y se ha comunicado la relación entre el aumento de LDH y la elevación de la TA sistólica.34
La desaturación de oxígeno es un factor que interviene en la etiopatogenia de la vasculopatía en los pacientes con drepanocitosis. La exposición a la hipoxia crónica induce la expresión de endotelina 1 por las células del endotelio pulmonar, que actúa como un potente vasoconstrictor. Además, genera un estado pro-inflamatorio y de activación vascular, a partir de la producción de factor 1 alfa inducible por la hipoxia, que activa las células inflamatorias a través de vías de señalización intracelulares.10
Investigaciones recientes han señalado la asociación de la disminución de la SaO2 tanto diurna como nocturna con la HTP, como parte del fenotipo hemolítico.28,35 En el presente estudio se encontró una disminución ligera de la SaO2 diurna, que no resultó estadísticamente significativa. De igual modo ocurrió con la presencia de microalbuminuria.
La frecuencia del tratamiento con hidroxiurea (HU) fue mayor en los pacientes del grupo 2. Aunque el impacto de la HU sobre la hemólisis es modesto, aún no se conoce su influencia a largo plazo en este grupo de pacientes.22,33 En nuestro estudio se encontró una tendencia a la significación entre el uso de la HU y el componente hemolítico, lo que contrasta con un estudio reciente donde se comunicó asociación negativa entre estos elementos.22 Un aspecto a tener en cuenta es que solo el 38 % de esos pacientes tomaban HU, lo que ocurrió en el 63 % de nuestra muestra. En nuestro instituto se inicia tratamiento con este medicamento desde los 2 años de edad en los pacientes que presentan STA, AVE o crisis dolorosas recurrentes, lo que justifica su elevada frecuencia.
Se conoce que la esplenectomía es un factor de riesgo de trombosis y vasculopatía, aunque no se ha establecido que esté relacionada directamente con la hemólisis.36 No se encontró relación entre el antecedente de esplenectomía con la hemólisis. No obstante, en nuestra institución se realiza esplenectomía parcial a los pacientes con crisis de secuestro esplénico desde 1986 y se ha demostrado que se conserva la función fagocítica y hemocaterética del bazo.37,38
Las investigaciones realizadas por Gladwin en 195 adultos con drepanocitosis, establecieron que los pacientes con VRT ≥ 2,5 m/s tenían una supervivencia a los 3 años 40 % menor que el resto, y que este marcador de riesgo se presentaba en el 32 % de los adultos con AD.39 Una investigación realizada en nuestra institución que incluyó más de 100 adultos con AD, determinó la prevalencia de VRT ≥ 2,5 m/s en el 28,8 %.3 En este trabajo se encontraron 13 niños, lo que representa el 32,5 %. Ninguno de estos pacientes pertenece al grupo 1.
La relación entre la VRT y la LDH es constante en las investigaciones publicadas.3,28 Sin embargo, su relación con otros marcadores de hemólisis, es variable.3 En los pacientes se comportó de manera similar a la descrita; no obstante, hubo una fuerte correlación entre la VRT y el IH, lo que corrobora su validez como determinante del fenotipo hemolítico.14
Numerosas investigaciones han demostrado el aumento de la mortalidad atribuible al fenotipo hemolítico, ya sea a partir de la determinación de la HTP39,40 o de los valores de LDH.33 Hasta el momento no se ha esclarecido el impacto de estas alteraciones en la niñez. Sin embargo, se conoce que persisten o se agravan con el transcurso del tiempo.35,41
La complejidad de la drepanocitosis hace estéril cualquier intento por simplificarla; por tanto, el enfoque de la enfermedad debe ser cada vez más profundo e integrador. La tendencia del tratamiento farmacológico de la enfermedad transcurre hacia la poliquimioterapia. Seleccionar la combinación apropiada para cada paciente solo será posible si avanzamos en su caracterización genotípica, proteómica, así como en la expresión fenotípica de estos factores.
REFERENCIAS BILIOGRÁFICAS
1. Kato GJ, Gladwin MT, Steinberg MH. Deconstructing sickle cell disease: reappraisal of the role of hemolysis in the development of clinical subphenotypes. Blood Rev. 2007;21(1):37-47.
2. Kato GJ, Hsieh M, Machado R, Taylor Jt, Little J, Butman JA, et al. Cerebrovascular disease associated with sickle cell pulmonary hypertension. Am J Hematol. 2006;81(7):503-10.
3. Espinosa E, García MB, Espinosa EE, Álvarez R, Hernández C, Ávila OM, et al. Hipertensión pulmonar en el adulto con anemia drepanocítica. Resultados preliminares. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet] 2010; 27(3):206-15. [citado 15 ene 2011] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892010000300004&lng=es&nrm=iso&tlng=es
4. Kato GJ, McGowan V, Machado RF, Little JA, Taylor Jt, Morris CR, et al. Lactate dehydrogenase as a biomarker of hemolysis-associated nitric oxide resistance, priapism, leg ulceration, pulmonary hypertension, and death in patients with sickle cell disease. Blood. 2006;107(6):2279-85.
5. Kato GJ, Wang Z, Machado RF, Blackwelder WC, Taylor JGt, Hazen SL. Endogenous nitric oxide synthase inhibitors in sickle cell disease: abnormal levels and correlations with pulmonary hypertension, desaturation, haemolysis, organ dysfunction and death. Br J Haematol. 2009;145(4):506-13.
6. Morris CR, Kato GJ, Poljakovic M, Wang X, Blackwelder WC, Sachdev V, et al. Dysregulated arginine metabolism, hemolysis-associated pulmonary hypertension, and mortality in sickle cell disease. JAMA. 2005;294(1):81-90.
7. Kielstein JT, Cooke JP. Arginine metabolism, pulmonary hypertension, and sickle cell disease. JAMA. 2005;294(19):2433-4.
8. Morris CR. Vascular risk assessment in patients with sickle cell disease. Haematologica. 2011;96(1):1-5.
9. Adedeji MO, Cespedes J, Allen K, Subramony C, Hughson MD. Pulmonary thrombotic arteriopathy in patients with sickle cell disease. Arch Pathol Lab Med. 2001;125(11):1436-41.
10. Gonsalves C, Kalra VK. Endothelin-1-induced macrophage inflammatory protein-1beta expression in monocytic cells involves hypoxia-inducible factor-1alpha and AP-1 and is negatively regulated by microRNA-195. J Immunol. 2010;185(10):6253-64.
11. Hagar RW, Michlitsch JG, Gardner J, Vichinsky EP, Morris CR. Clinical differences between children and adults with pulmonary hypertension and sickle cell disease. Br J Haematol. 2008;140(1):104-12.
12. Lamers L, Ensing G, Pignatelli R, Goldberg C, Bezold L, Ayres N, et al. Evaluation of left ventricular systolic function in pediatric sickle cell anemia patients using the end-systolic wall stress-velocity of circumferential fiber shortening relationship. J Am Coll Cardiol. 2006;47(11):2283-8.
13. Liem RI, Nevin MA, Prestridge A, Young LT, Thompson AA. Tricuspid regurgitant jet velocity elevation and its relationship to lung function in pediatric sickle cell disease. Pediatr Pulmonol. 2009;44(3):281-9.
14. Minniti CP, Sable C, Campbell A, Rana S, Ensing G, Dham N, et al. Elevated tricuspid regurgitant jet velocity in children and adolescents with sickle cell disease: association with hemolysis and hemoglobin oxygen desaturation. Haematologica. 2009;94(3):340-7.
15. Diagnosticadores para química clínica y microbiología. En: Helfa-Diagnósticos. La Habana: EPB Carlos J. Finlay. Quimera; 2003. Disponible en: http://www.biofinlay.sld.cu
16. Lewis SM, Bain BJ, Bates I. Dacie and Lewis Practical Haematology. 9th ed. London: Churchill Livingstone; 2001.
17. Betke K, Marti HR, Schlicht I. Estimation of small percentages of foetal haemoglobin. Nature. 1959;184(Suppl 24):1877-8.
18. National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics. 2004;114(2 Suppl 4th Report):555-76.
19. Quinones MA, Otto CM, Stoddard M, Waggoner A, Zoghbi WA. Recommendations for quantification of Doppler echocardiography: a report from the Doppler quantification task force of the nomenclature and Standards Committee of the American Society of Echocardiography. J Am Soc Echocardiogr. 2002;15(2):167-84.
20. Fitzgerald RK, Jonson A. Pulse oximetry in sickle cell disease. Crit Care Med. 2001;29:1803-6.
21. Genser B, Cooper PJ, Yazdanbakhsh M, Barreto ML, Rodrigues LC. A guide to modern statistical analysis of immunological data. BMC Immunol. 2007;8:27-34.
22. Gordeuk VR, Campbell A, Rana S, Nouraie M, Niu X, Minniti CP, et al. Relationship of erythropoietin, fetal hemoglobin, and hydroxyurea treatment to tricuspid regurgitation velocity in children with sickle cell disease. Blood. 2009;114(21):4639-44.
23. Feng X, Scheinberg P, Wu CO, Samsel L, Nunez O, Prince C, et al. Cytokine signature profiles in acquired aplastic anemia and myelodysplastic syndromes. Haematologica. 2011;96(4):602-6.
24. Zhou X, Chou J, Wong ST. Protein structure similarity from principle component correlation analysis. BMC Bioinformatics. 2006;7:40.
25. Liem RI, Young LT, Thompson AA. Tricuspid regurgitant jet velocity is associated with hemolysis in children and young adults with sickle cell disease evaluated for pulmonary hypertension. Haematologica. 2007;92(11):1549-52.
26. Minniti CP, Eckman J, Sebastiani P, Steinberg MH, Ballas SK. Leg ulcers in sickle cell disease. Am J Hematol. 2010;85(10):831-3.
27. Onyekwere OC, Campbell A, Teshome M, Onyeagoro S, Sylvan C, Akintilo A, et al. Pulmonary hypertension in children and adolescents with sickle cell disease. Pediatr Cardiol. 2008;29(2):309-12.
28. Estrada M, García MB, Cisneros H, Díaz LM, Bravo M, Abreu J, et al. Análisis de algunas variables hematológicas, bioquímicas y clínicas en la anemia drepanocítica. Resultados preliminares. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet]. 2010;26(2):39-49. [citado 10 Ago 2011] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892010000200007&lng=es&nrm=iso&tlng=es
29. Colombatti R, Maschietto N, Varotto E, Grison A, Grazzina N, Meneghello L, et al. Pulmonary hypertension in sickle cell disease children under 10 years of age. Br J Haematol. 2010;150(5):601-9.
30. Ambrusko SJ, Gunawardena S, Sakara A, Windsor B, Lanford L, Michelson P, et al. Elevation of tricuspid regurgitant jet velocity, a marker for pulmonary hypertension in children with sickle cell disease. Pediatr Blood Cancer. 2006;47(7):907-13.
31. Dham N, Ensing G, Minniti C, Campbell A, Arteta M, Rana S, et al. Prospective echocardiography assessment of pulmonary hypertension and its potential etiologies in children with sickle cell disease. Am J Cardiol. 2009;104(5):713-20.
32. Chaudry RA, Cikes M, Karu T, Hutchinson C, Ball S, Sutherland G, et al. Paediatric sickle cell disease: pulmonary hypertension but normal vascular resistance. Arch Dis Child. 2010;96(2):131-6.
33. Taylor JGt, Nolan VG, Mendelsohn L, Kato GJ, Gladwin MT, Steinberg MH. Chronic hyper-hemolysis in sickle cell anemia: association of vascular complications and mortality with less frequent vasoocclusive pain. PLoS One. 2008;3(5):e2095.
34. Gordeuk VR, Sachdev V, Taylor JG, Gladwin MT, Kato G, Castro OL. Relative systemic hypertension in patients with sickle cell disease is associated with risk of pulmonary hypertension and renal insufficiency. Am J Hematol. 2008;83(1):15-8.
35. Gordeuk VR, Minniti CP, Nouraie M, Campbell AD, Rana SR, Luchtman-Jones L, et al. Elevated tricuspid regurgitation velocity and decline in exercise capacity over 22 months of follow up in children and adolescents with sickle cell anemia. Haematologica. 2011;96(1):33-40.
36. Haque AK, Gokhale S, Rampy BA, Adegboyega P, Duarte A, Saldana MJ. Pulmonary hypertension in sickle cell hemoglobinopathy: a clinicopathologic study of 20 cases. Hum Pathol. 2002;33(10):1037-43.
37. Svarch E, Nordet I, Valdes J, Gonzalez A, Machin S, de la Torre E. Partial splenectomy in children with sickle cell disease. Haematologica. 2003;88(2):222-3.
38. Svarch E, Vilorio P, Nordet I, Chesney A, Batista JF, Torres L, et al. Partial splenectomy in children with sickle cell disease and repeated episodes of splenic sequestration. Hemoglobin. 1996;20(4):393-400.
39. Gladwin MT, Sachdev V, Jison ML, Shizukuda Y, Plehn JF, Minter K, et al. Pulmonary hypertension as a risk factor for death in patients with sickle cell disease. N Engl J Med. 2004;350(9):886-95.
40. Parent F, Bachir D, Inamo J, Lionnet F, Driss F, Loko G, et al. A hemodynamic study of pulmonary hypertension in sickle cell disease. N Engl J Med. 2011;365(1):44-53.
41. Qureshi N, Joyce JJ, Qi N, Chang RK. Right ventricular abnormalities in sickle cell anemia: evidence of a progressive increase in pulmonary vascular resistance. J Pediatr. 2006;149(1):23-7.
Recibido: 15 de junio del 2012.
Aprobado: 15 de julio del 2012.
Dr. Alberto Arencibia-Núñez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: rchematologia@infomed.sld.cu. Website: http://www.sld.cu/sitios/ihi