Introducción
La cuantificación y caracterización de las subpoblaciones linfocitarias mediante la citometría de flujo ha cobrado gran importancia en los últimos años, por la extensión de sus aplicaciones no solo para el diagnóstico y seguimiento de las inmunodeficiencias,1 sino también en el estudio de la autoinmunidad,2 el cáncer,3) enfermedades hematológicas,4) dermatológicas, alérgicas, infecciosas e inflamatorias, entre otras.5) La citometría de flujo permite la cuantificación de las subpoblaciones de linfocitos con una elevada sensibilidad y especificidad, y con su empleo se han descubierto nuevas subpoblaciones con funciones muy precisas dentro de las enfermedades antes mencionadas.
Con frecuencia, durante la evaluación de un paciente en la práctica clínica o en el desarrollo de las investigaciones se requiere la determinación de múltiples antígenos sobre una misma célula. Esto permite una mayor resolución y confiabilidad en la caracterización de las diferentes subpoblaciones linfocitarias. En caso de realizarse con dos o tres antígenos solamente y en determinaciones independientes, se subregistran algunas poblaciones linfocitarias con funciones claves dentro del sistema inmune. De ahí la importancia del inmunofenotipo periférico con la detección simultánea de 6, 8 o 10 antígenos sobre una misma célula. El diagnóstico inmunofenotípico por citometría de flujo en el estudio del sistema inmune es esencial para la indicación e interpretación de otros métodos de diagnóstico.6
El Centro Nacional de Genética Médica introdujo desde el año 2017 el inmunofenotipaje periférico mediante citometría de flujo, por evaluación de 6 antígenos para la determinación de subpoblaciones de linfocitos T, B, linfocitos citolíticos naturales (NK, del inglés Natural Killer) y linfocitos citolíticos naturales T (NKT, del inglés Natural Killer T), en un solo tubo policromático. La reciente adquisición de monoclonales de la firma MACS, Miltenyi Biotec, con su nuevo formato más concentrado, requiere del diseño y optimización de un tubo policromático que se ajuste a estas condiciones. El empleo de un solo tubo de citometría tiene como ventajas simplificar la operatoria, mayor rapidez y precisión, confiabilidad y aumento de la resolución, para garantizar resultados reproducibles con calidad.
Por lo anteriormente expuesto se realizó este trabajo con el objetivo de diseñar un protocolo de un solo tubo policromático para inmunofenotipo linfocitario en sangre periférica.
Métodos
Se realizó un estudio experimental in vitro en marzo de 2019 en el Centro Nacional de Genética Médica de Cuba, con muestras de sangre periférica de 3 sujetos supuestamente sanos, previa obtención de su consentimiento informado.
Se obtuvieron 4 mL de sangre periférica mediante venipuntura en antebrazo, que fueron depositados en tubo Vacutainer con ácido etilen-diamino tetra-acético como anticoagulante. Las muestras se procesaron de forma inmediata tras su extracción, cumpliendo con las buenas prácticas de laboratorio.
Se seleccionaron seis antígenos: CD45 como marcador pan-leucocitario, CD19 para la identificación de linfocitos B, CD3, CD4 y CD8 para la diferenciación de las subpoblaciones de linfocitos T y CD56 para la detección de NK y NKT.
Para el desarrollo de la titulación se emplearon los siguientes anticuerpos monoclonales conjugados con fluorocromos de la firma MACS Miltenyi Biotec, Alemania: anti-CD45 APC-Vio770 (Clone 5B1), anti-CD19 PE-Vio700 (Clone LT19), anti-CD3 FITC (Clone BW264/56), anti-CD4 PerCP-Vio700 (Clone M-T466), anti-CD8 APC (Clone BW135/80) y anti-CD56 PE (Clone REA196). Se desarrolló un protocolo de lisis de hematíes sin lavado,7) y para la tinción se siguieron las especificaciones del fabricante.
Se dispensaron en un tubo para citometría los volúmenes del conjugado (anticuerpo monoclonal-fluorocromo) elegidos para cada titulación y se agregaron 100 μL de sangre periférica anticoagulada, se homogeneizó la mezcla con vortex durante 3 segundos, se incubó en cámara oscura por 15 min, se añadió 1 mL de solución lisante VersaLyse (BeckmanCoulter, France), se incubó 10 min y se procedió a la lectura inmediatamente.
Para la titulación se partió de la concentración del conjugado, recomendada por el fabricante (1:50= 2 μL) y se obtuvieron 5 diluciones seriadas para encontrar el punto óptimo de concentración, el cual se correspondió con el mayor índice de tinción, menor señal de fondo posible para cada conjugado y la conservación de los porcentajes de positividad de cada población dentro del rango normal, previamente informado en la literatura. El índice de tinción se obtuvo mediante el cociente de la media geográfica de intensidad de fluorescencia (MGIF) de la población positiva entre la MGIF de la población negativa para el antígeno de interés.
Con las concentraciones óptimas de cada monoclonal se diseñó un tubo policromático para la detección de los 6 antígenos seleccionados.
Se empleó un citómetro Beckman Coulter Gallios de 8 fotomultiplicadores para fluorescencia con software Kaluza Acquisition v1.0 para la adquisición de los datos y Kaluza Analysis v1.5a para el análisis y informe de resultados. El control de calidad se realizó con Flow-CheckTM Pro Fluorospheres, (Beckman Coulter, Francia) para comprobar la estabilidad de los sistemas ópticos y de fluidos. Se utilizaron Flow-SetTM Pro Fluorospheres (Beckman Coulter, Francia), para la calibración de la dispersión de la luz y la intensidad de fluorescencia. Se utilizó un control negativo por cada muestra que consistió en la muestra sin teñir, así como la fluorescencia menos uno para el antígeno CD56 sobre las células NKT. Se adquirió un mínimo de 50 000 eventos totales. Se diseñó una estrategia manual de ventanas de tipo secuencial.
La cuantificación de las poblaciones linfocitarias se realizó por doble plataforma. Los valores porcentuales se obtuvieron sobre la ventana de linfocitos (CD45+ vs complejidad estructural) y absolutos (células/µL). Se empleó un contador hematológico marca Mindray BC6800. Se aplicó la siguiente fórmula:
Resultados
Los marcadores seleccionados permitieron realizar correctamente el inmunofenotipo linfocitario periférico de las poblaciones T, B, NK y NKT así como de sus subpoblaciones.
A pesar de que los conjugados empleados con su nuevo formato, tienen como ventaja trabajar con volúmenes pequeños, la re-titulación mostró que se requiere reducir aún más los volúmenes para lograr resultados óptimos, en cuanto a la discriminación entre las señales negativas y positivas, con una señal de fondo más baja (Tabla 1). En el caso del conjugado anti-CD45, el resultado óptimo se obtuvo con la menor concentración de la curva propuesta, a pesar de ser consumido por el 100 % de las células de la muestra.
Tabla 1 Distribución de las titulaciones de los conjugados MACS Miltenyi Biotec según subpoblaciones linfocitarias de interés
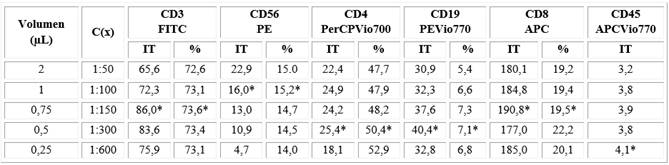
IT: Índice de tinción; %: Porcentaje de positividad de células de interés según el marcador empleado; C(x): Concentración; *: concentraciones seleccionadas para el tubo policromático.
En los cinco puntos de titulación seleccionados se observaron buenas discriminaciones entre señales para casi todos los conjugados (Fig. 1), excepto para el anti-CD56 en que la tendencia decreciente del índice de tinción fue evidente y en el punto de mayor dilución (1:600) no existió buena discriminación. Se eligió el punto de dilución 1:100 con respecto al propuesto por el fabricante por tener una menor señal de fondo (Fig. 1B y 1D). Esta prueba se realizó con un número de células fijas en cada punto de dilución, garantizado por un mismo volumen fijo de la muestra de sangre.
La configuración del citómetro en cuanto a los voltajes de los fotomultiplicadores, se fijó al nivel más bajo que permitiera la visualización de la señal negativa dentro de la primera década de la escala de intensidad de fluorescencia y cercana al cero. Este procedimiento se realizó con un control negativo (células sin teñir). Al realizar el control de calidad diario los coeficientes de variación siempre estuvieron por debajo 1,5 en el canal de FS y en los seis canales de fluorescencia. En el caso del CD3+ y del CD4+ para el análisis de resultados se empleó la escala lógica biexponencial, para poder visualizar adecuadamente la población negativa, ya que estas se encontraban muy cercas de cero (Fig. 1A y 1E).
Al realizar el control de fluorescencia -1 (FMO, del inglés Fluorescence Minus One) se encontró que no existieron interferencias del resto de los conjugados en el canal del FL-2 por el que se identifica la fluorescencia del anti-CD56 en el presente citómetro, por lo que no se requirió hacer ajustes en los niveles de corte para este marcador. El control negativo con el uso de la misma muestra sin teñir demostró pocas modificaciones en la discriminación de señal negativa y positiva.
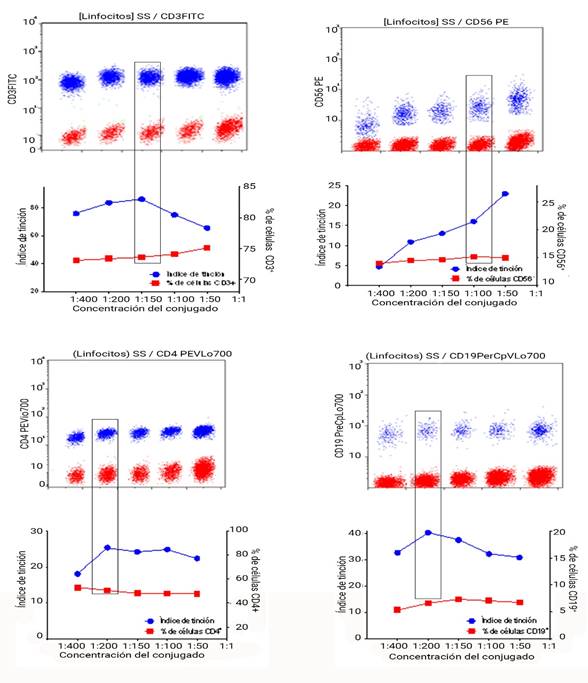
Fig. 1 Curvas de titulación de los conjugados. A, B, E y F gráficos de puntos de intensidad de fluorescencia vs dispersión lateral (azul: población positiva y roja: población negativa). C, D, G y H curvas de los índices de tinción y porcentaje de positividad de los linfocitos según marcadores de selección. Los índices de tinción se obtuvieron del cociente de la mediana geográfica de intensidad de fluorescencia de la población positiva entre la de población negativa. Los recuadros púrpuras representan las titulaciones elegidas.
Se diseñó una estrategia de ventanas de selección de tipo manual y secuencial, con gráficos biparamétricos de puntos. Primero se crearon gráficos para controlar los eventos positivos de florescencia global vs dispersión lateral de la luz (SS, por sus siglas en inglés side scatter), que refleja la complejidad estructural. Posteriormente, a partir de un gráfico de discriminación de eventos coincidentes, se creó uno de eliminación de detritus, para finalmente obtener la ventana de selección de linfocitos del gráfico del CD45+ vs SS. De la ventana del CD45+ se construyeron los gráficos para cuantificar las poblaciones básicas de interés y según correspondió, las subpoblaciones (Fig. 2).
La creación de un gráfico de puntos de CD4 vs CD8 procedente de la región de linfocitos TCD3+ en el cual se excluyen las células NKT (Fig. 2I), permitió una mayor pureza al identificar las poblaciones simple positivas (SP) para cada marcador. Por un lado, se delimitan bien los dobles positivos (DP) que son linfocitos que, de realizar el análisis convencional, producen una sobre estimación a cada población simple positiva. Lo mismo sucede si no se excluyen las NKT que también aportan a la sobre estimación de los simples positivos convencionales T con receptor αβ Lo que esta estrategia requiere un paso adicional para calcular el porcentaje de cada uno con respecto a la ventana de la población linfocitaria. En el caso mostrado el valor sobreestimado sería alrededor de un 3,4 % al sumar los aportes de los DP más las NKT (Fig. 2H y 2I).
El volumen total de conjugados requeridos para la determinación de los 6 antígenos fue de 3.75 μL por tubo. Al tener en cuenta los volúmenes que se requieren dispensar de cada conjugado por tubo, se decidió crear un coctel para 40 determinaciones (Tabla 2).
Tabla 2 Distribución de los volúmenes requerido por cada test y para la conformación del coctel de conjugados para 40 determinaciones, según los volúmenes finales obtenidos de la titulación
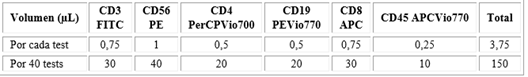

Fig. 2 Estrategia de ventanas de selección para inmunofenotipolinfocitario periférico. A) gráficos de puntos para control de fluorescencia global, eventos positivos y análisis de estrategia de ventana en reversa. B) gráfico de densidad para la eliminación de eventos coincidentes. C) gráfico de puntos FS vs SS para la eliminación de detritus. D) gráfico de puntos sobre el cual se creó la ventana de selección de linfocitos (CD45 vs SS). E-H) gráficos biparamétricos para cuantificar las subpoblaciones linfocitarias. I) gráfico biparamétrico para el análisis de las subpoblaciones T. Las flechas rojas describen la lógica secuencial de ventanas asumida para el análisis.
Discusión
Existen numerosas enfermedades y condiciones médicas que requieren de la identificación y cuantificación de los principales conjuntos de linfocitos que circulan en sangre. Estas determinaciones deben ser realizadas con rapidez y precisión para evitar retrasos en la conformación del diagnóstico y hacerlo con calidad. En la actualidad el inmunofenotipo por citometría de flujo es el método de elección para hacer dichas determinaciones.7
Se seleccionó el antígeno CD45 por ser considerado pan-leucocitario y permitir una mayor pureza en la ventana de selección de linfocitos, como plantean van der Burg y otros, en el diseño de tubos policromáticos validados para inmunofenotipos linfocitarios No solo por eliminar detritus y hematíes no lisados, sino porque permite seleccionar dentro de las células de origen hematológico. Existe una heterogeneidad de expresión del CD45 dentro de los leucocitos, por ejemplo, en los granulocitos existe menor expresión, en los monocitos expresión intermedia y en los linfocitos es de mayor expresión. Hoy existe un consenso en el informe de la cuantificación de subpoblaciones linfocitarias sobre esta ventana.8
Se eligieron antígenos que marcan linajes celulares específicos dentro de los linfocitos por selección positiva como el CD3 para T, el CD19 para B y el CD56 para NK. Las moléculas CD4 y CD8 permiten identificar las subpoblaciones linfocitarias T y de células NKT. A su vez, el CD3 se utiliza como antígeno de selección negativa (de exclusión) para confirmar las NK. El CD16 es un marcador que no está presente en un subgrupo del fenotipo NK (CD3-/CD56 alto), en condiciones fisiológicas y patológicas; sin embargo, el CD56 solo está ausente en células NK disfuncionales que pueden aparecer en infecciones virales crónicas por el VIH, hantavirus y el virus de la hepatitis C,9) por lo cual se seleccionó este último para la identificación de este linaje celular. Este tubo de citometría se emplea fundamentalmente como tamizaje para determinar las subpoblaciones linfocitarias en sangre periférica. En pacientes que requieran un estudio de las células NK se emplea otro tubo de citometría para realizar un fenotipo detallado de las mismas.
Los conjugados seleccionados siguieron las recomendaciones básicas de emplear los más brillantes para los antígenos de menor expresión y viceversa para los más opacos. La titulación de los conjugados de anticuerpos monoclonales con fluorocromos tiene como objetivo fundamental incrementar la resolución y mejorar el rango dinámico o, lo que es lo mismo, disminuir el ruido de fondo e incrementar la señal positiva con la menor distorsión posible. Al igual que en los estudios previos de Finak y otros y de Mateos y otros, la concentración óptima de los conjugados no coinciden con las propuestas por el fabricante, ya que se deben ajustar a los requerimientos del tipo de muestra y la configuración del citómetro a emplear.10,11 Este precepto fue cumplido al realizar estos procedimientos. Uno de los elementos más importantes que se tuvo en cuenta para la titulación fue el nuevo formato más concentrado de Miltenyi. Se requirieron volúmenes muy pequeños por debajo del microlitro, lo cual puede introducir imprecisiones en la técnica. Sin embargo, la correcta calibración de las pipetas minimiza dichas imprecisiones.
Se coincide con los estudios de Winsor y otros en lo referente a las ventajas que posee el método de lisis de hematíes sin lavado como la poca manipulación de la muestra, que no exista pérdida de células por lavados, ahorro de otros reactivos requeridos y su rapidez.12
Los controles negativos resultan importantes en este tipo de protocolo en el que no se realizan lavados, por su tendencia al incremento del ruido de fondo. Existe consenso al recomendar este tipo de control al realizar marcaje superficial, sobre los controles isotípicos. Otro control muy importante es la FMO, sobre todo para establecer los niveles de corte de los antígenos secundarios y terciarios. En la literatura especializada existen evidencias acumuladas de los errores que se cometen si no se realiza este tipo de control.11,13,14
La estrategia de ventanas se basó en facilitar el análisis multiparamétrico por evaluación de seis antígenos sobre una misma célula. Se tuvo en cuenta los controles y cuidados requeridos cuando se decide realizar de forma manual esta estrategia. No solo se diseñaron gráficos biparamétricos para las poblaciones convencionalmente descritas, sino que además se crearon otros para subpoblaciones con menor concentración en sangre. En la actualidad se han descubierto muchas variedades de linfocitos, precisamente gracias a la citometría de flujo. Existe consenso en que estas poblaciones menos representativas en sangre deben ser tomadas en cuenta para conformar la fórmula total de linfocitos.10,15
Al evaluar los SP CD4 y CD8 dentro del linaje T se deben excluir otras células que aportan a estos marcadores sobre todo al CD4. Por ejemplo, monocitos, NKT y células dendríticas. La estrategia creada permitió eliminar en gran medida la contaminación que se introduce sobre los T SP. En la actualidad se recomienda establecer una estrategia para determinar los valores de estas subpoblaciones de forma excluyente y así evitar sobre estimaciones. Se sugiere además excluir el CD56 y hacerlo también para el CD14 correspondiente a monocitos. Pues cuando se suman otras células que aportan al marcador CD4 y CD8, los valores reales de estos se alejan del encontrado de forma significativa, con cifras que oscilan entre un 5 % y un 10 %.16,17
La utilización del software Kaluza facilitó el análisis de datos e informe de resultados. Entre las ventajas más sobresalientes que posee está la posibilidad de habilitar la escala biexponencial en sus gráficos, esto facilita la visualización de la señal negativa con buena discriminación de la señal de fondo; otra beneficio es el de poder realizar ajustes a la compensación off-line.
La propia firma MACS Miltenyi Biotec, produce el estuche comercial 7-Color Immunophenotyping Kit human,18 que permite la detección de 8 antígenos leucocitarios mediante un protocolo de tinción de lisis de hematíes sin lavado similar al propuesto. Tiene la ventaja sobre el realizado en este estudio, que además de las subpoblaciones linfocitarias descritas, permite identificar neutrófilos y eosinófilos al incluir los antígenos CD14 y CD16; y como desventajas que es más costoso y está diseñado para emplearse de forma automática en citómetros de la propia marca.
La utilización de un protocolo de tinción de lisis de hematíes sin lavado, un solo tubo policromático y el empleo de un coctel de conjugados para dispensarlos en solo paso, hizo muy sencilla la operatoria con mucha rapidez. Esto condujo a una notable reducción de errores de procedimientos y reducción del tiempo de trabajo, y dio la posibilidad de procesar grandes números de muestras con mucha confiabilidad, robustez y reproducibilidad.
La obtención de un tubo policromático permitió obtener el inmunofenotipo periférico de forma rápida y precisa por 6 antígenos linfocitarios simultáneamente, con el empleo de pequeños volúmenes de conjugado y de sangre. Las combinaciones y concentraciones propuestas no generaron interferencia ni distorsiones de las señales. Los valores obtenidos se encontraron dentro de los rangos normales, de los informados para adultos sanos.















