Introducción
La terapia electroquímica (EChT; del inglés, electrochemical treatment) consiste en la aplicación de una corriente eléctrica directa de muy baja intensidad (CED) a un tejido biológico mediante la inserción de dos o más electrodos en este. La CED ha sido dirigida para el tratamiento de tumores benignos y malignos,1,2,3 y úlceras, entre otras aplicaciones.4 En cáncer, la seguridad, efectos adversos en el organismo, efectividad, mecanismos de acción y muerte inducidos por la EChT son reportados en la literatura cuando los electrodos se insertan completamente en el tumor.1,2,3,5,6,7
El daño tisular inducido en el tumor por la aplicación de la CED es alrededor de los electrodos y luego extensivo en espacio y tiempo.6,8 En contraste, la CED induce daño tisular (circular y limitado en espacio-tiempo) alrededor de cada electrodo insertado fuera del tumor. Sin embargo, los efectos locales y sistémicos inducidos por la CED en el organismo no han sido reportados.9 Hasta donde los autores han revisado, tampoco se han documentado los efectos sistémicos y locales de la CED cuando los electrodos se insertan en un organismo sano. El esclarecimiento de esto puede ser de relevancia para el uso de la EChT en múltiples tumores primarios y metástasis en el organismo, como se reporta para la terapia sistémica con campo eléctrico alterno.10 El objetivo de este trabajo es evaluar los efectos de la corriente eléctrica directa de baja intensidad en ratones sanos.
Métodos
Grupos experimentales
Este estudio fue realizado en el Centro de Toxicología y Biomedicina (TOXIMED), Santiago de Cuba, Cuba, en el periodo de enero-mayo de 2017. Los ratones C57BL/6/Cenp (hembras y machos) fueron suministrados por el Laboratorio del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), La Habana, Cuba. Todos los procedimientos con animales fueron realizados de acuerdo con la Guía para el Cuidado, Uso y Reproducción de los Animales de Laboratorio del CENPALAB (Edición 02/07); la Directiva 86/609 del 24 de noviembre de 1996 y las Directrices de la Comisión de Ética Animal de Cuba. Además, se tuvo en cuenta las normativas de protección animal establecidas en TOXIMED. Además, fue garantizado el ciclo de 12 h de luz/oscuridad (luz 7:00-19:00) de los ratones con agua y comida ad libitum.
Fueron empleados 80 ratones C57BL/6/Cenp, 40 de cada género, de 6-7 semanas, con un peso promedio de 16-18 g. Ocho grupos experimentales fueron formados aleatoriamente por cada género (cuatro controles y cuatro tratados), con cinco ratones cada uno. El primer grupo control fue el negativo que no recibió CED (GCN). El segundo grupo control solo recibió la anestesia (GC). A los animales del tercer grupo control se les insertaron subcutáneamente un electrodo en la pata delantera derecha y otro en la pata trasera izquierda, durante 5 min y no se aplicó la CED (GC1). A los animales del cuarto grupo control se les colocaron subcutáneamente un electrodo en cada pata, durante 5 min (GC2).
En el primer grupo tratado, un ánodo (electrodo con polaridad positiva) fue insertado en la pata delantera derecha y un cátodo (electrodo con polaridad negativa) en la pata trasera izquierda de cada animal (GT1). A los animales del segundo grupo tratado (GT2) les fueron insertados dos ánodos (uno en cada pata derecha) y dos cátodos (uno en cada pata izquierda). A los animales del tercer grupo tratado (GT3) les fueron insertados un ánodo en cada pata delantera y un cátodo en cada pata trasera. Los ratones de estos tres grupos tratados recibieron 10 mA durante 5 min, correspondiente a una carga eléctrica de 3 C. El cuarto grupo tratado (GT4) estuvo formado por ratones que recibieron anestesia y fueron colocados entre dos electrodos placas, separadas a 63,5 mm, bajo una diferencia de potencial de 10 V, durante 5 min (modo de tensión eléctrica). El campo eléctrico entre las placas fue considerado homogéneo y su intensidad fue 1,575 V/cm.
Los animales de todos los grupos recibieron anestesia, excepto aquellos del GCN, el cual fue usado como referencia para todos los grupos experimentales. El GC fue la referencia para los GC1, GC2, GT1, GT2, GT3 y GT4; mientras el GC1 fue la referencia para el GT1; el GC2 fue la referencia para los GT2 y GT3. Los valores de la intensidad de la CED y la tensión eléctrica fueron 10 mA y 10 V, respectivamente.3,5 Todos los animales fueron fijados firmemente a un cepo plástico durante el experimento y bajo las mismas condiciones experimentales. El tamaño de los electrodos y la distancia entre ellos fueron medidos con un pie de rey con tornillo de sujeción (Modelo 530-104 de 0,05 mm de precisión, Mitutoyo, Japón).
Peso de los ratones
La balanza Owalabor de precisión ( 0,01 g (modelo BL610, Alemania) fue usada para pesar a los animales. El día 0, todos los animales fueron pesados antes de la aplicación de la CED. A los 7 y 14 días, los animales fueron pesados nuevamente y fue calculada la ganancia de peso corporal (GPC), restando al peso a los 7 y 14 días, el peso del día 0, respectivamente.
Anestesia
La anestesia, dosis única de Tiopental sódico BP 500 mg (Ciron Drugs & Pharmaceuticals PVT. Lt, India) de 25 mg/kg, fue administrada, por vía intraperitoneal. Además, fue realizado un seguimiento diario de los signos y síntomas clínicos, morbilidad y mortalidad de cada animal hasta el momento de su eutanasia.
Electroestimualdor
El equipo ZAY®-6B (China) fue usado para aplicar la EChT y trabajó en los modos de corriente/tensión eléctrica. Las intensidades de la CED y de la tensión eléctrica fueron monitoreadas durante la aplicación de la EChT.
Electrodos
Para la aplicación de la CED fueron usados electrodos agujas de platino de 0,7 mm diámetro y 68,5 mm de largo. Para la aplicación de la tensión eléctrica constante fueron empleados dos electrodos placas de acero de dimensión 122,0 x 62,0 x 0,5 mm.
Eutanasia
A los 14 días, en la mañana, fue realizada la eutanasia de los ratones, por decapitación, acorde a la Norma ISO 10993-211 después de la extracción de la sangre, que fue efectuado por la vena yugular. La sangre fue colocada en tubos plásticos de 1,5 mm (Plastique Gosselin, Hazebrouck, Francia), que contuvieron ácido etilendiaminotetraacético (EDTA-K3E (10 %; del inglés, Ethylenediamine tetraacetic acid).
Parámetros hematológicos
Los parámetros hematológicos determinados fueron: hemoglobina, hematocrito, conteo total leucocitos y conteo diferencial de leucocitos (neutrófilos, linfocitos, eosinofilos, monocitos y basófilos). Todos estos parámetros fueron cuantificados con el analizador automático PENTEA 120 Rentix (Montpellier manufacturer, Francia), de acuerdo con los Procedimientos Normalizados de Trabajo # 003 (Departamento de Hematología del hospital “Dr. Juan Bruno Zayas Alfonso”). El calibrador ABX Minocal (MORIBA ABX SAS, Montpellier, Francia) fue usado para la calibración de este equipo.
Parámetros bioquímicos
Los parámetros bioquímicos de la sangre determinados fueron: creatinina, urea, Gamma glutamil transpeptidasa (GGT), transaminasa glutámico pirúvica (TGP) y transaminasa glutámico oxalacética (TGO), creatina quinasa total (CK) y creatina quinasa isoenzima 2 (CK-MB). La relación entre CK-MB y CK, que fue denominado índice relativo, fue calculada para cada grupo. Estos parámetros fueron cuantificados automáticamente con el autoanalizador HITACHI 902 (Rouche, Japón), de acuerdo al Procedimiento Normalizado de trabajo # 004 (Departamento de Hematología del hospital “Dr. Juan Bruno Zayas Alfonso”). Los Kits fueron suministrados por HELFA® (EPB “Carlos J. Finlay”, Habana, Cuba). El sistema automatizado del calibrador (Preci Control Clin Chem Multi 1, Roche/Hitachi analYZer 902) fue usado para la calibración de este equipo.
Alteraciones macroscópicas y microscópicas de los tejidos
A los 14 días post- tratamiento, fueron observados las posibles alteraciones macroscópicas de todos los tejidos y órganos, tales como cambios en la coloración, consistencia, peso, edema, pus, hemorragia, ente otras. Además, las alteraciones microscópicas fueron estudiadas en el sitio de inserción de los electrodos y en algunos órganos (cerebro/ cerebelo, riñones, hígado y bazo). Las muestras fueron fijadas en solución de formol al 10 % y fueron procesadas por el método de la parafina. La coloración por hematoxilina (Merck, Alemania) y eosina (Titolchimica spa, Pontecchio Polesine, Italia) fue usada, de acuerdo con procedimiento Normalizado de Operaciones # 372001, 372003 y 371021 (Departamento de Anatomía Patológica de TOXIMED, Santiago de Cuba, Cuba). Un microscopio óptico (modelo N-800M, China) con una cámara digital acoplada (modelo HDCE-X5, China) fue empleado.
Criterios estadísticos
La prueba no paramétrica suma de rangos de una cola de Wilcoxon-Mann-Whitney fue empleada para comparar el peso a los 0; 7 y 14 días. El criterio estadístico no paramétrico de Bonferroni fue usado para la comparación de la ganancia de peso y los parámetros hematológicos y bioquímicos de la sangre a los 14 días entre las hembras y los machos de cada grupo. El nivel de significación empleado para ambas pruebas estadísticas fue ( = 0,05. Además, los valores promedios y las desviaciones estándar (errores estándar de la media) de los parámetros hematológicos y los bioquímicos de la sangre fueron calculadas a partir de sus respectivos valores individuales, para cada género y grupo.
Resultados
Todos los animales machos y hembras de los GT1, GT2 y GT3 mostraron intranquilidad ligera y respiración rápida durante la aplicación de la CED. Después de 15 min de anestesia y/o tratamiento, todos los ratones tuvieron estado normal, buena vitalidad y condiciones físicas, excepto en los ratones donde fueron insertados los ánodos (GT1, GT2 y GT3). En los animales de estos tres grupos tratados fue observada dificultad ligera en la actividad motora de las patas, hallazgo que desapareció a las 72 h post-tratamiento. Además, se evidenció corrosión en los ánodos insertados en los ratones de los GT1, GT2 y GT3 después de la aplicación de la CED. La caída del pelo fue producida en algunos ratones de 10-14 días. El tamaño, la forma de la zona afectada y la frecuencia de la caída de pelo fueron variables en los machos y las hembras del GCN (1/10), GC (2/10) y GT4 (1/10).
El peso de los ratones machos fue significativamente mayor que el de las hembras en cada grupo, a los 0, 7 y 14 días después de aplicada la CED. Para cada género, las GPC no fueron estadísticamente significativas cuando los grupos fueron comparados con el GCN, a los 7 y 14 días, excepto en los machos del GT1 y las hembras del GT3 a los 7 días. La desviación estándar de la GPC fue mayor que sus valores medios, a los 7 días (en machos de los GT1, GT2 y GT3, y en las hembras de los GT2 y GT3) y 14 días (machos y hembras del GT3).
Los rangos normales de los parámetros hematológicos y bioquímicos de la sangre fueron específicos de cada laboratorio y por ende los mismos fueron interpretados según las condiciones experimentales establecidas en el laboratorio de Hematología del hospital “Dr. Juan Bruno Zayas”. En cuanto a los parámetros hematológicos, no fueron observadas diferencias estadísticamente significativas cuando fueron comparados las hembras y los machos por cada grupo, a excepción de la hemoglobina y el hematocrito de las hembras de los GC2 y GT3, y los neutrófilos en el GC1. Tampoco existieron diferencias estadísticamente significativas en los parámetros hemoglobina, hematocrito, eosinófilos y monocitos cuando fueron comparados todos los grupos con el GCN y el GC, como se muestra en la tabla 1. Aunque los resultados no fueron mostrados en esta tabla, no se observaron basófilos en ningún ratón. En los machos fue observado aumento significativo del conteo total de los leucocitos (GT4 comparado con el GCN) y de los neutrófilos (GT1 y GT2 contrastados con los GCN y GC, y el GT1 con el GC1). Los linfocitos disminuyeron significativamente cuando los GT1 y GT2 fueron comparados con los GCN y GC, y el GT1 con el GC1. En las hembras fue observado un aumento significativo del conteo total de los leucocitos (GC y GC2 comparado con el GCN) y de los neutrófilos (GC1, GT1 y GT2 cuando fueron contrastados con el GC; y el GT1 fue comparado con el GC1). Además, existió disminución significativa de los leucocitos totales (GT1 y GT2 en comparación con el GC), de los neutrófilos (GC, GT1 y GT2 en contraste con el GCN) y de los linfocitos (GC, GT1 y GT2 en comparación con el GCN; los GC1, GT1 y GT2 comparados con el GC; y el GT1 con el GC1). La desviación estándar de los eosinófilos (machos y hembras del GC1) y monocitos (hembras de los GC1, GT1, GT2 y GT3; y los machos de los GT1 y GT3) fueron mayores a sus respectivos valores medios. También se pudo observar en la tabla 1 que el conteo diferencial de leucocitos mostró un mayor porcentaje de linfocitos que de neutrófilos.
Tabla 1 Parámetros hematológicos
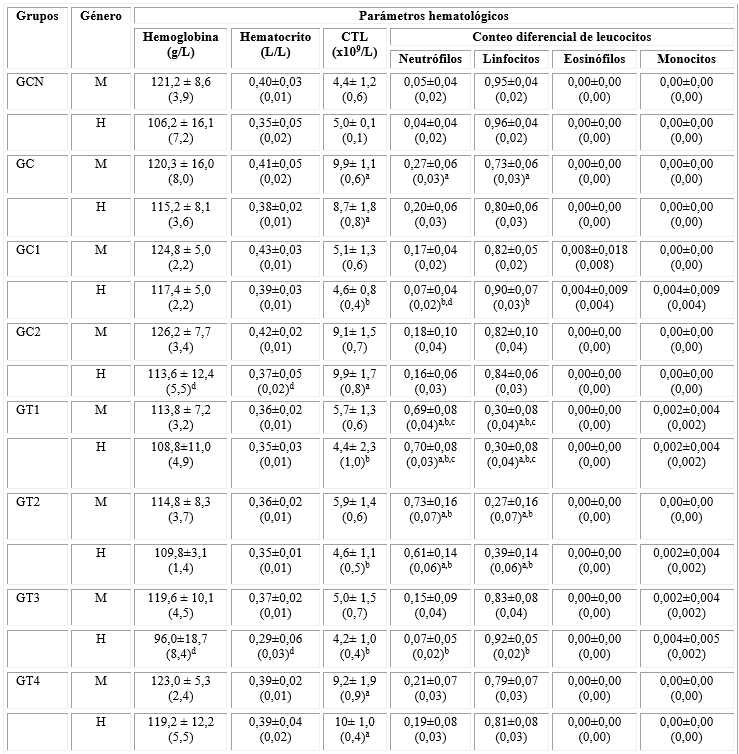
CTL: Conteo Total de leucocitos M: machos, H: hembras.
a La prueba de Bonferroni mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros hematológicos cuando los GC, GC1, GC2, GT1, GT2, GT3 y GT4 fueron comparados con el GCN, en cada género, a los 14 días.
b La prueba de Bonferroni mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros hematológicos cuando los GC1, GC2, GT1, GT2, GT3 y GT4 fueron comparados con respecto al GC, en cada género, a los 14 días.
c La prueba de Bonferroni mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros hematológicos cuando el GT1 fue comparado con el GC1, en cada género.
d La suma de rangos de Wilcoxon-Mann-Whitney de una cola (P < 0,05) en los parámetros hematológicos cuando fueron comparados hembras y machos por cada grupo, a los14 días.
La tabla 2 muestra los datos de los parámetros bioquímicos de la sangre. Se evidenció que no existieron diferencias estadísticamente significativas de estos parámetros cuando los machos y las hembras fueron comparados, en cada grupo, excepto para la urea y la TGP en las hembras del GCN, y la CK-MB en el GC2. En los machos, no existen diferencias significativas en la bioquímica sanguínea. Las hembras no mostraron diferencias significativas en la creatinina, TGP, TGO, CK y CK-MB. Sin embargo, la GGT aumentó significativamente (GC2 comparado con el GCN), la urea (GC1, GT1 y GT3 comparados con el GCN) y el GC1 con el GC2.
La relación CK-MB/CK, para los machos de los GCN, GC, GC1, GC2, GT1, GT2, GT3 y GT4 fue 0,142; 0,116; 0,108; 0,119; 0,409; 0,367; 0,157 y 0,113; respectivamente. Este índice en las hembras para cada grupo fue 0,180; 0,563; 0,395; 0,227; 0,241; 0,440; 0,480 y 0,346, respectivamente.
En las observaciones macroscópicas no se observaron cambios aparentes en los órganos y tejidos de los animales.
Tabla 2 Parámetros bioquímicos de la sangre
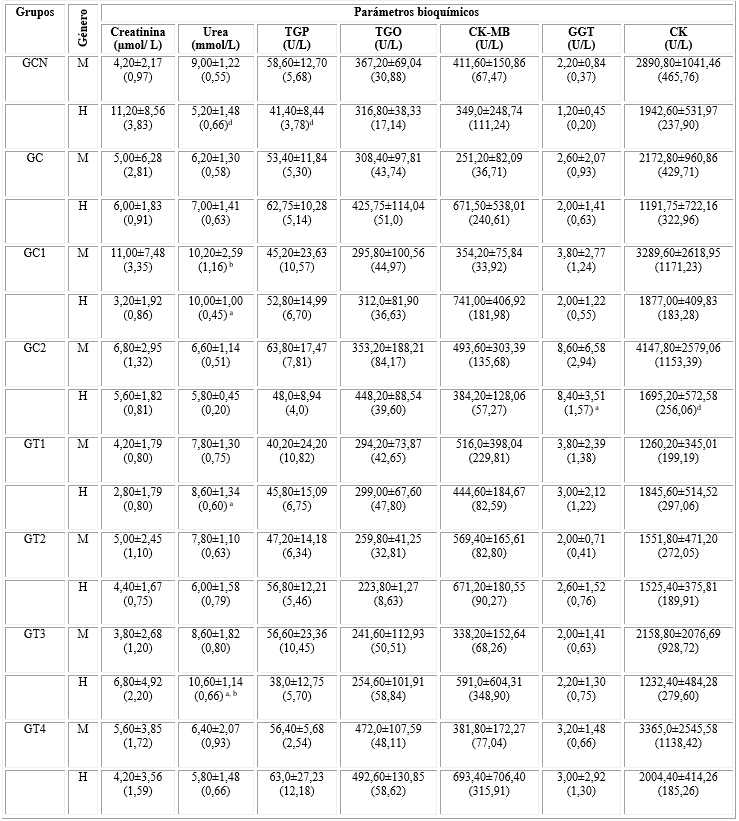
M: machos, H: hembras, TGP: transaminasa glutámico pirúvica, TGO: transaminasa glutámica oxaloacética, CK: creatina quinasa, GGT: gamma glutamil transpeptidasa, CK-MB: creatina quinasa. Isoenzima 2.
a La prueba de Bonferroni mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros bioquímicos cuando fueron comparados los GC, GC1, GC2, GT1, GT2, GT3 y GT4 respecto al GCN, en cada género a los 14 días.
b La prueba de Bonferroni mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros bioquímicos cuando los GC1, GC2, GT1, GT2, GT3 y GT4 fueron comparados con el GC, en cada género, a los 14 días.
c Prueba de Bonferroni mostró la estadística en ambos géneros a los 14 días.
d La suma de rangos de Wilcoxon-Mann-Whitney de una cola mostró diferencias estadísticamente significativas (P < 0,05) en la media de los parámetros bioquímicos cuando hembras y machos fueron comparados por cada grupo a los 14 días.
El resultado de la evaluación histológica después de la eutanasia fue resumido en la tabla 3. No fueron detectadas alteraciones en los machos y las hembras del GCN. Sin embargo, fueron observados cambios en el sitio de inserción de los electrodos y en algunos órganos internos en otros grupos (tabla 3, Figs. 1 y 2). En la zona donde fueron introducidos los electrodos fue observada una miositis ligera en los ratones de ambos géneros de los GC1 y GC2, y miositis moderada en los animales de los GT1, GT2 y GT3 de cada género. La miositis no fue detectada en ninguno de los ratones de los GC y GT4.
La miositis moderada fue caracterizada por necrosis alrededor de los electrodos (Fig. 1a), rodeada por un área de fibrosis e infiltrado inflamatorio (Figs. 1a,b). Fue revelado una respuesta inflamatoria crónica mononuclear intensa con predominio de los linfocitos y acompañada de una proliferación de fibroblastos maduros, algunas fibras musculares estriadas con necrosis de coagulación (caracterizada por una intensa eosinofilia citoplasmática con ausencia de núcleo), y algunas fibras con citoplasma de aspecto turbio. Además, fueron observados basófilos tenues (que pudieron corresponder con la desnaturalización de proteínas celulares) e inflamación aguda severa con neutrófilos y macrófagos alrededor de las fibras necróticas.
Por otro lado, fue observado necrosis circular alrededor del electrodo insertado en el músculo estriado. No fueron detectadas alteraciones en el bazo de los ratones machos y hembras del GT3. Sin embargo, una hiperplasia ligera fue revelada en los ratones de ambos géneros de los GC, GC1, GT2 y GT4; y en los machos de los GC2 y GT1 (Tabla 3). Esta hiperplasia fue caracterizada por folículo linfoide esplénico (pulpa blanca) con presencia de centros germinales incipientes (zona central del folículo con aspecto brilloso (luminoso) por la presencia de linfocitos maduros activados), como fue mostrado en la Fig. 2 a. En el cerebro/cerebelo no fueron observadas alteraciones en las hembras y los machos de los GCN, GC1, GT1, GT2 y GT3, salvo gliosis ligera en los ratones de ambos géneros de los GC, GC2 y GT4 (tabla 3 y Fig. 2 b).
En el corazón fue detectada una miocarditis intersticial ligera en las hembras y los machos del GT1 y en los machos de los GT2 y GT3. En los riñones fue evidenciada una nefritis intersticial ligera, en los ratones de ambos géneros de los GT1, GT2 y GT3.
Tabla 3 Principales alteraciones encontradas en órganos y patas
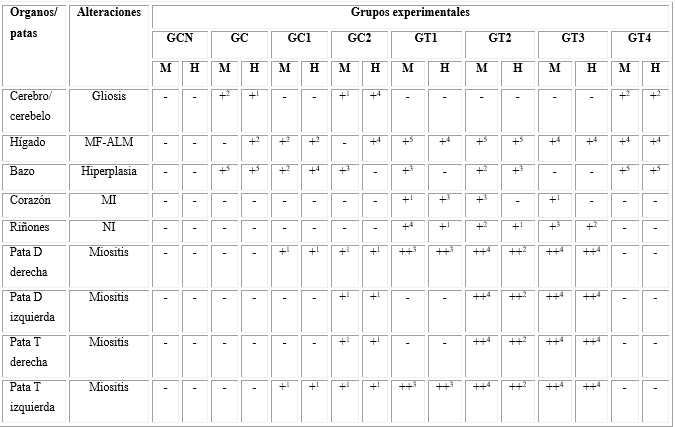
M: machos; H: hembras. Los signos “-, +, ++ y +++” representaron los grados de intensidad de las alteraciones: ninguna, leve, moderada, y severa intensidad respectivamente. El superíndice indicó la cantidad de animales en que fue observada la alteración. MF-ALM: múltiples focos de agregados de linfocitos maduros, MI: miocarditis intersticial y NI: nefritis intersticial.
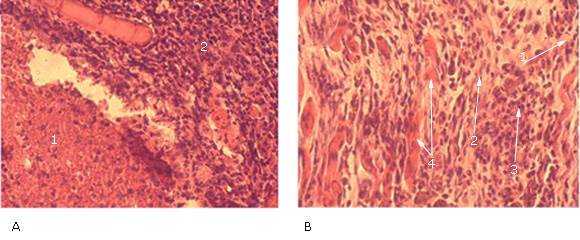
Fig. 1 Alteraciones en el sitio de inserción de los electrodos. (A) Músculo estriado de patas (x40): necrosis (1) y área de fibrosis e infiltrado inflamatorio (2). (B) Detalle de área de fibrosis e infiltrado inflamatorio: linfocitos (1), fibroblastos (2), células mononucleares (3) y necrosis Zenker (4).
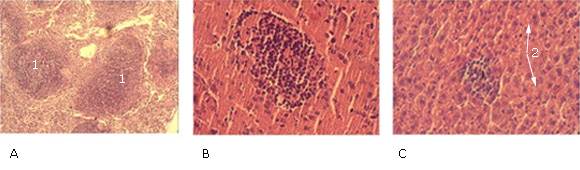
Fig. 2 Alteraciones encontradas en órganos internos. (A) bazo (x10): folículo linfoide esplénico (o nódulo esplénico hiperplásico) (1), (B) cerebro (x40): área de gliosis con presencia de astrocitos, (C) hígado (x40): múltiples focos de agregados de linfocitos (1) y tumefacción de células de Kupffer (2).
En el hígado de los ratones machos de los GC y GC2 no fueron evidenciadas alteraciones. Sin embargo, en los ratones de ambos géneros de los grupos GC1, GT1, GT2, GT3 y GT4 y en las hembras de los GC y GC2 fueron observados múltiples focos de agregados de linfocitos maduros, los cuales no fueron bien visualizados por el infiltrado celular (tabla 3 y Fig. 2 c ). En los GT1, GT2 y GT3 fueron observados agregados de 10-12 linfocitos maduros con muy pocos neutrófilos (1-2) que se distribuyeron en el interior del lóbulo hepático.
Por otro lado, la presencia de algunos linfocitos maduros (tipo población no específica) fue observada en los órganos afectados y en los tejidos intersticiales del corazón y de los riñones.
Discusión
La caída del cabello en las hembras y los machos puede estar asociado al barberismo, como reportan Clark y Schein.12 La intranquilidad de los ratones de los GT1, GT2 y GT3, durante la aplicación de la CED, puede explicarse porque los receptores de daño al calor (por estimulación eléctrica) causan una sensación de hormigueo o cosquilleo, hallazgos que se observan en ratones1 y en pacientes5 portadores de cáncer tratados con CED o tensión constante.
Las diferencias significativas entre los pesos de los machos y las hembras a los 0, 7 y 14 días, en cada grupo, se debe al tamaño de los animales y los niveles de hormonas. Sin embargo, ni la anestesia, ni la inserción de los electrodos y ni la intensidad/tensión eléctrica constante afectan significativamente la GPC de los ratones a los 7 y 14 días.
La desviación estándar de los parámetros hematológicos y bioquímicos de la sangre mayores que sus respectivos valores promedios se puede explicar por la variabilidad e intensidad de los efectos que se inducen en los ratones bajo la acción de la CED, siendo notable para las hembras.
La miositis ligera reversible en los GC1 y GC2 se debe a la ruptura mecánica del tejido muscular por la inserción de los electrodos en las patas de los ratones. Sin embargo, la miositis moderada en los GT1, GT2 y GT3 se explica por la inserción de electrodos y la acción citotóxica de la CED debido a los productos tóxicos provenientes de las reacciones electroquímicas que se inducen en el tejido alrededor de los electrodos por la acción de este agente físico.13 La necrosis circular limitada en espacio y tiempo se puede explicar por la presencia de la proliferación fibroblástica y la inflamación mononuclear que rodea toda la periferia de la zona afectada. La corrosión del ánodo se debe a la hiperpolarización alrededor de este electrodo, como reportan Cury y otros.1
Los múltiples focos de agregados de linfocitos maduros en el hígado pueden estar relacionados con los microfocos de necrosis y/o la ligera inflamación del hígado. La inflamación del hígado, la nefritis intersticial y la miocarditis intersticial ligeras pueden ser causadas por infecciones (virus, bacterias, parásitos y hongos), toxinas, procesos alérgicos, enfermedades inmunológicas y agentes físicos.14 Sin embargo, las infecciones, los procesos alérgicos y las toxinas se descartan porque los eosinófilos, los macrófagos y los basófilos de los grupos controles y tratados no aumentan significativamente respecto a los del GCN. Por otra parte, las enfermedades inmunológicas se descartan porque son ratones sanos y los parámetros hematológicos y bioquímicos de la sangre los grupos tratados no difieren significativamente de los del GCN.
El hecho de que no se observen daños en los riñones y las diferencias no significativas entre los valores de creatinina de los grupos tratados y del GCN indican que la nefritis intersticial ligera no conduce a un daño renal. Los valores altos de la CK y la CK-MB no se pueden explicar por el daño renal (nefritis intersticial ligera). Además, la miocarditis intersticial ligera tampoco explica los valores altos de estos dos parámetros. Por otra parte, los valores del índice relativo (CK-MB/CK) menores que 2,5 confirman que no hay daños irreversibles en el corazón ni en el riñón, en concordancia con los hallazgos histológicos observados en estos órganos.
Los valores altos de la CK con un índice relativo por debajo de 2,5-3 sugieren que el músculo esquelético y otros músculos están dañados (miositis). En esta investigación los valores altos de la CK y la CK-MB no se pueden explicar a partir de la miositis que se observa en los GC1, GC2, GT1, GT2 y GT3 porque los valores de CK y CK-MB en estos grupos no difieren significativamente de aquellos de los GCN, GC y GT4. Además, la gliosis ligera en los GC, GC2 y GT4 puede indicar que los valores de la isoenzima CK-BB no estén elevados. Esto puede indicar que los altos valores de la CK y la CK-MB no se expliquen a partir de la gliosis ligera.
En clínica, los valores de la CK y CK-MB no se detectan normalmente o son muy bajos en los sujetos sanos,15 en contraste a los que se reportan para el GCN. Esto y lo que se discute arriba pueden sugerir que los valores altos de la CK y CK-MB en todos los grupos no se expliquen por los daños que se inducen en los ratones debido a la inserción de los electrodos (GC1 y GC2) y la aplicación de la CED (GT1, GT2 y GT3). Otras dos causas pueden incrementar los valores de la CK y la CK-MB: la taquicardia y el estrés emocional (estrés a corto plazo).15 En la taquicardia severa los valores de la CK-MB y del índice relativo (CK-MB/CK) son elevados,15 en contraste con los resultados de esta investigación, lo que descarta esta posible causa. Sin embargo, el estrés emocional (estrés a corto plazo) que se induce en todos los ratones por la decapitación (forma de eutanasia) puede conducir a la liberación de catecolaminas que activan el sistema simpático y el eje hipotálamo-pituitario-adrenal, los cuales se relacionan con el aumento de los valores de CK y CK-MB.15
Las alteraciones de los parámetros hematológicos, bioquímicos de la sangre y las variables histológicas pueden sugerir la inducción de una respuesta inflamatoria sistémica en ratones C57BL/6/Cenp por los estímulos mecánico (inserción de electrodos en las patas) y eléctrico (intensidad/tensión eléctrica constante). El estímulo eléctrico depende del modo de la EChT y del arreglo de electrodos (geometría, cantidad, polaridad y forma de inserción de los electrodos), en concordancia con simulaciones previas8,16,17,18 para el modo CED, la carga eléctrica de 3 C induce una respuesta inflamatoria sistémica, de acuerdo con Nanda,19 quien reporta que esta respuesta ocurre para cargas eléctricas ( 6 C.
La respuesta inflamatoria sistémica sugiere que el mecanismo dominante es la activación de un proceso inflamatorio sistémico, probablemente por la potenciación del sistema inmune y/o la liberación de mediadores químicos (por ejemplo, las citoquinas). Como resultado, la posible existencia de una respuesta inmune celular tardía. Aunque el sistema inmunológico no se estudia en profundidad, el mismo se activa después de aplicada la intensidad/tensión eléctrica constante.5,6,7,20 Esto puede corroborar que el sistema inmune se activa por la vía de agentes no infecciosos (traumatismos, quemaduras, isquemia y otros) y no por agentes infecciosos (no existen diferencias significativas, entre los eosinófilos, monocitos y basófilos de todos los grupos).
El hecho de que el proceso inflamatorio sistémico prevalece sobre la respuesta inflamatoria aguda, a los 14 días, se confirma en este estudio porque prevalecen los linfocitos en los procesos inflamatorios y no los neutrófilos y los macrófagos. Esto no quiere decir que la respuesta inflamatoria aguda domine los primeros días después de la aplicación de la intensidad/tensión eléctrica constante, como se reporta en la literatura.5,6) Los linfocitos en los procesos inflamatorios pueden explicar, en parte, la linfocitopenia en las hembras y machos de los GT1 y GT2 respecto a los del GCN.
Los resultados evidencian que los efectos biológicos que induce la CED no traen riesgo para la salud de los ratones C57BL/6/Cenp machos y hembras tratados con 10 mA o 10 V durante 5 min de exposición, siendo menos notables estas alteraciones para el modo de tensión eléctrica constante, en concordancia con Holandino y otros.6 Sin embargo, estos resultados no indican que para intensidades de CED ≥ 10 mA y tiempo de exposición ≥ 10 min se induzcan daños irreversibles en el organismo, e incluso la muerte, en concordancia con González y otros.2 Por otra parte, Gomes y otros.21 reportan que la CED no induce daños mutagénicos y genotóxicos. Se concluye que las alteraciones de la EChT en los ratones C57BL/6/Cenp sanos son reversibles y el proceso inflamatorio sistémico es dominado por los linfocitos.














