Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.20 no.2 Ciudad de la Habana Mayo.-ago. 2011
ARTICULOS ORIGINALES
Vigilancia de eventos adversos de la vacuna plisacárida meningocócica A y C durante una campaña de vacunación en Níger
Adverse event surveillance of the polysaccharide meningococcal A and C vaccine during a vaccination campaign in Niger
Meiby de la Caridad Rodríguez,1* Iván Edelberto Cuevas,1** Mayelín Mirabal,1 Luis Ruíz2
1 Instituto Finlay. Centro de Investigación y Producción de Vacunas. Ave. 27 No. 19805, La Lisa, A.P. 16017 Cod. 11600. La Habana, Cuba.
2 Brigada Médica Cubana en Níger,Niger.
*Dra. en Medicina, Especialista en Medicina General Integral y Máster en Epidemiología.
**Dr. en Medicina, Especialista de II Grado en Epidemiología y Máster en Salud Pública. email:cuevas@finlay.edu.cu
RESUMEN
La inmunoprofilaxis constituye la estrategia por excelencia para la prevención y control de las epidemias de meningitis meningocócica provocadas por el serogrupo A de Neisseria meningitidis en el llamado cinturón de la meningitis en África, donde alcanza altas tasas de morbimortalidad. La vacuna liofilizada de polisacáridos purificados de Neisseria meningitidis de los serogrupos A y C fue producida como resultado de un convenio de colaboración entre el Instituto Finlay, Centro de Investigación, Desarrollo y Producción de Vacunas de Cuba y el Instituto de Tecnología e Inmunobiológicos de Bio-Manguinhos de Brasil, a solicitud de la Organización Mundial de la Salud, para cubrir las necesidades de la vacuna en los países africanos en emergencia sanitaria. Durante la campaña de vacunación desarrollada contra un brote epidémico en Níger, en el 2009, se realizó un estudio de vigilancia poslicenciamiento, con el objetivo de describir los eventos adversos consecutivos a la administración de este producto a 303.037 personas. Se utilizaron dos métodos para la recolección de los eventos adversos: notificación espontánea y vigilancia intensiva en los hospitales. Se reportaron un total de 81 eventos adversos, de los cuales solo el 11% fueron categorizados "inducidos por la vacuna" y considerados "muy probablemente relacionados" con esta. Los resultados obtenidos muestran que la vacuna utilizada en la campaña de vacunación de Níger es segura y poco reactogénica y el perfil de seguridad se corresponde con el descrito en el registro sanitario de Brasil.
Palabras clave: Vacuna polisacárida meningocócica AC, serogrupo A y C, farmacovigilancia, eventos adversos.
Immunoprophylaxis is the choice strategy for the prevention and control of meningococcal meningitis epidemics caused by Neisseria meningitidis serogroup A in the so-called meningitis belt of Africa, a disease that reaches high rates of morbidity and mortality. The lyophilized purified polysaccharide vaccine from Neisseria meningitidis serogroups A and C was produced as a result of a collaboration agreement between Finlay Institute, Center for Research, Development and Production of Vaccines, Cuba and the Institute of Technology and Bio-Immunobiologicals Manguinhos of Brazil, at the request of the World Health Organization to meet the needs of the vaccine in African countries in health emergencies. In the vaccination campaign carried out during an outbreak in Niger in 2009, a study of pharmacovigilance was conducted to describe the adverse events following the administration of this product to 303 037 people. Two methods were used to collect adverse events (spontaneous reporting and intensive search in hospitals). A total of 81 adverse events were reported, only 11% were under the category «induced by the vaccine» and considered «very probably related» to this. The results show that the vaccine used in the immunization campaign in Niger is safe, has low reactogenicity and their safety profile corresponds to that described in the sanitary medical registry in Brazil.
Keywords: Meningococcal polysaccharide vaccine, serogroup A and C, pharmaco surveillance, adverse events.
INTRODUCCIÓN
El serogrupo A de Neisseria meningitidis es uno de los principales agentes causales de las epidemias de meningitis que afectan cada año entre 25.000 y 200.000 personas, fundamentalmente a niños, provocando altas tasas de morbimortalidad. En el llamado cinturón de la meningitis en África ocurren epidemias cíclicas de meningitis cada 5-12 años, con picos entre los meses de marzo y abril, al final de la estación seca, que declinan durante la estación de lluvias (1).
Diversos factores contribuyen al desencadenamiento de las epidemias, en particular la pérdida de la inmunidad de las poblaciones frente a las bacterias patógenas, debido a la renovación de las generaciones, con el consecuente aumento del número de individuos que nunca han estado en contacto con ella. El hacinamiento familiar, los grandes desplazamientos de población con motivo de peregrinaciones, mercados regionales tradicionales, así como las condiciones climáticas de la región contribuyen aún más a la difusión del microorganismo (2).
Las tasas de ataque en años epidémicos pueden ser tan elevadas, como 1.000 por 100.000 habitantes, con una tasa de letalidad entre el 10% y 20%. Tres cuartos de los casos ocurren en individuos menores de 15 años (1).
La estrategia de la Organización Mundial de la Salud (OMS) para controlar las epidemias de meningitis meningocócicas en el cinturón de la meningitis africana incluye: la combinación de inmunización masiva usando vacunas polisacarídicas antimeningocócicas de los serogrupos circulantes y el tratamiento adecuado de los casos con terapia antibiótica (3).
Sin embargo, la producción global de las vacunas polisacarídicas con frecuencia no es suficiente para afrontar las grandes epidemias de meningitis que ocurren cada año.
En el año 2006 se produjo una marcada escasez de la vacuna polisacarídica bivalente AC. Ante esta situación la OMS solicitó ayuda al Instituto Finlay, centro productor de la vacuna meningocócica BC y a Bio-Manguinhos, un tradicional productor de la AC. Se estableció una colaboración Sur-Sur, basada en las potencialidades de ambos Institutos para solucionar el problema planteado: el Instituto Finlay, aportaría la producción de los ingredientes farmacéuticos activos (IFA), con los que Bio-Manguinhos completaría el proceso de liofilización final para la elaboración de la vacuna.
A partir de ese momento se realizaron un grupo de acciones en ambas instituciones para garantizar la calidad del proceso tecnológico. Estas acciones posibilitaron la obtención de la Licencia Sanitaria para Operaciones de Producción en el Instituto Finlay por parte de la autoridad reguladora nacional de medicamentos de Cuba (CECMED).
Finalmente, las instalaciones de ambos centros (Finlay y Bio-Manguinhos) fueron visitadas por expertos de la OMS para evaluar el principio de aceptabilidad. En octubre de 2007 se obtuvo la precalificación OMS de la vacuna polisacárida meningocócica A y C, aval imprescindible para comercializarla.
En el año 2009, una gran epidemia afectó principalmente a Nigeria, Níger y Chad. Entre los meses de enero y mayo de ese año estos tres países reportaron un total de 69.529 casos de meningitis, con 2.957 muertes. Nigeria fue el país más severamente afectado: 55.626 casos, incluyendo 2.307 muertes, seguido por Níger con 12.604 casos y 510 muertes. Se demostró la presencia del serogrupo A de Neisseria meningitidis en el 87,7% de los enfermos, a través del aislamiento del microorganismo en el líquido cefalorraquídeo (LCR) o mediante PCR (3-5).
La vacuna polisacárida meningocócica A y C de Bio-Manguinhos proporciona protección contra la enfermedad meningocócica invasiva, causada por cepas de Neisseria meningitidis de los serogrupos A y C; está indicada para la inmunización activa de adultos y de niños mayores de dos años de edad en el curso de brotes de la enfermedad (6).
En el mes de enero de 2009, el Ministerio de Salud de Níger comenzó a vacunar en las regiones más afectadas por la epidemia (4), pero ante la propagación de esta y la capacidad limitada de los recursos, solicitó un incremento del suministro de vacunas antimeningocócicas, momento en el cual se entrega al país la vacuna polisacárida meningocócica A y C de Bio-Manguinhos.
Este producto ha mostrado buena tolerancia y un perfil de seguridad satisfactorio. Las reacciones locales más frecuentes (dolor y enrojecimiento en el sitio de la aplicación), pueden ocurrir en el 40% de los vacunados. Con menor frecuencia suelen producirse reacciones sistémicas, como fiebre en menos del 5% de los adultos. Los eventos severos, como sibilancia y urticaria, no son comunes, pudiendo ocurrir cerca de 1 por 1.000.000 dosis aplicadas (6).
A pesar de que existía una considerable experiencia en el uso de las vacunas polisacarídicas meningocócicas AC y ACW135, eran escasos los estudios de seguridad poslicenciamiento publicados, realizados en campañas de vacunación en el África Occidental. Ante la necesidad de completar la información de seguridad de esta vacuna se consideró realizar este estudio que tuvo como objetivo describir los eventos adversos posteriores a la administración de la vacuna en la campaña de vacunación realizada en los territorios con brotes de meningitis meningocócica en Níger.
MATERIALES Y MÉTODOS
Diseño del estudio
Se realizó un estudio observacional, descriptivo, a partir de la vigilancia de los eventos adversos posteriores a la inmunización con la vacuna polisacárida meningocócica A y C, durante una campaña de vacunación en Níger.
Se seleccionaron los distritos sanitarios donde solo se utilizó la vacuna polisacárida meningocócica A y C de Bio- Manguinhos: de Boboye (Región Dosso), con 362.142 habitantes y el de Bouza (Región Tahoua), con 70.769 habitantes.
La vacuna fue administrada a personas con edades comprendidas entre 2 y 30 años. La cobertura vacunal fue del 70%.
En el distrito de Boboye la vacunación se efectuó entre el 29 de abril y el 1ro de mayo de 2009 y el dato se obtuvo entre el 29 de abril y el 31 de mayo de 2009, y en Bouza la vacunación se efectuó en el periodo comprendido entre el 6 y el 15 de mayo de 2009 y el dato se obtuvo entre el 6 de mayo y el 15 de junio de ese mismo año.
Definiciones:
· Evento adverso consecutivo a la vacunación: Cualquier accidente médico que ocurre después de la vacunación pudiendo estar asociado o no a la aplicación de la vacuna, otros eventos inusuales que pueden ocurrir dentro de las cuatro semanas posteriores a la aplicación de la vacuna y cuya etiología no esté bien precisada (7).
· Un caso fue definido como: Una persona vacunada con la vacuna en estudio, con edad comprendida entre los 2 y 30 años, en la que se reporte al menos un evento adverso consecutivo a la vacunación y que pertenezca a los distritos seleccionados para el estudio.
· Evento adverso grave: Evento adverso consecutivo a la vacunación que resulta en uno o más de los siguientes efectos: muerte, amenaza a la vida, hospitalización o aumento en el tiempo de hospitalización, discapacidad total o parcial (7).
El estudio fue implementado luego de la aprobación por las autoridades del Ministerio de Salud de Níger que asumieran las funciones de Comité de Ética.
La identidad y los datos clínicos de los pacientes, así como la identidad de los profesionales de la salud e instituciones que formularon las notificaciones de sospecha de eventos adversos fueron considerados confidenciales y en ningún informe del estudio aparecen de forma individualizada.
Técnicas y Procedimientos
Métodos para la recolección de los eventos adversos:
· Notificación espontánea: Se recogieron los casos con sospecha de eventos adversos consecutivos a la vacunación de aquellos que acudieron espontáneamente a los servicios de salud a cualquier nivel de atención. Para ello se utilizó el sistema de "Reporte mensual de actividades de inmunización" del Ministerio de Salud de Níger (8).
· Vigilancia intensiva en hospitales: Se realizó una vigilancia intensiva de eventos adversos en los hospitales de los distritos seleccionados para el estudio. Para ello se hizo una revisión de los registros hospitalarios, expedientes médicos e informes estadísticos, con el objetivo de identificar e investigar los eventos adversos posvacunales. Se realizó un análisis de los motivos de consulta, de ingreso, diagnósticos definitivos, informes de laboratorio, registro de fallecidos de todos los pacientes que cumplieron con la definición de caso, sin hacer cambios en el diagnóstico emitido en esos registros.
Para garantizar la calidad de los datos se realizó un entrenamiento al personal sanitario involucrado en la notificación de los eventos adversos, así como al grupo de expertos para el análisis de causalidad.
El grupo de expertos tuvo la responsabilidad de analizar los reportes y clasificar los eventos adversos según las categorías epidemiológicas, así como de establecer la causalidad de los mismos.
Categorías epidemiológicas de los eventos adversos consecutivos a la vacunación:
· Acontecimientos adversos inducidos por la vacuna: Aquellos incidentes médicos causados por la reacción de un individuo particular o una vacuna en concreto. Estos sucesos se deben a las características intrínsecas de la vacuna y a respuestas individuales de la persona.
· Acontecimientos adversos precipitados por la vacuna: Incidentes médicos que se presentan después de la administración de la vacuna, precipitados por una disposición previa. Por ejemplo, una convulsión febril simple tras la inmunización con DTP en un niño predispuesto.
· Acontecimientos adversos relacionados con errores programáticos: Los incidentes médicos causados por algún error en el almacenamiento, manipulación o administración de la vacuna. Por ejemplo, un absceso debido a esterilización no adecuada (6).
· Acontecimientos adversos "coincidentes" o "coincidentales": Incidentes médicos que podrían haber ocurrido tanto si se administra o no la vacuna.
· Reacción a la inyección: También se pueden explicar determinados efectos asociados con la vacunación por la ansiedad o el dolor que puede provocar la inyección, y no tanto por la propia vacuna. Por ejemplo, hipotensiones ortostáticas en los momentos de vacunaciones en grupos escolares.
· Acontecimientos adversos de causas desconocidas: Incidentes médicos posteriores a la administración de la vacuna, cuyas causas no se pueden clasificar en ninguno de los grupos citados.
Análisis de la causalidad se utilizó el algoritmo de "Introspección Global" (9,10). Los eventos se clasificaron en las categorías siguientes:
· Muy probable, definitiva o cierta: Evento clínico que guarda una relación temporal verosímil con la administración de la vacuna y que no puede ser explicado por una enfermedad concurrente o por el efecto de otros fármacos o sustancias químicas.
· Probable: Evento clínico que guarda una relación temporal verosímil con la administración de la vacuna y que no es probable que pueda atribuirse a una enfermedad concurrente o a otros fármacos o sustancias químicas.
· Posible: Evento clínico que guarda una relación temporal razonable con la administración de la vacuna, pero que también podría explicarse por una enfermedad concurrente o por el efecto de otros fármacos o sustancias químicas.
· Improbable: Evento clínico cuya relación temporal con la administración de la vacuna es tal que es improbable la existencia de una relación causal, pero que podría explicarse de forma verosímil por una enfermedad subyacente o por el efecto de otros fármacos o sustancias químicas.
· No relacionada (condicional): Evento clínico temporalmente incompatible con la administración de la vacuna y que podría explicarse por una enfermedad subyacente o por el efecto de otros fármacos o sustancias químicas.
· No clasificable (no evaluable): Evento clínico del que no se dispone de evidencias suficientes que permitan evaluarlo y determinar su causa.
Análisis estadístico
Se determinó la frecuencia de los eventos adversos consecutivos a la vacunación, así como la tasa expresada en casos por 100.000 vacunados por distrito.
Se calculó la proporción de eventos adversos consecutivos a la vacunación de acuerdo a las categorías epidemiológicas y a la asociación causal con respecto al total de eventos adversos reportados por distrito. Se confeccionaron tablas para la visualización de los resultados.
RESULTADOS Y DISCUSIÓN
En las localidades donde se realizó el estudio se vacunaron un total de 303.037 personas: 253.499 pertenecían al Distrito Sanitario de Boboye y 49.538 al Distrito Sanitario de Bouza.
Como se recomienda por la OMS, se aplicó la vacuna polisacárida meningocócica A y C de Bio-Manguinhos para la inmunización activa de adultos y de niños mayores de dos años de la edad en el curso de brotes de la enfermedad (6).
Por la vía de la notificación espontánea de eventos adversos a las vacunas, no se reportó ningún caso. Debemos aclarar que en Níger no existe un sistema de vigilancia de eventos adversos a medicamentos bien establecido, aunque sí disponen de un reporte mensual de actividades de vacunación (8) donde se recogen datos de eventos adversos.
Este tipo de notificación habitualmente suele tener subregistro, con frecuencia los vacunados no acuden al profesional de la salud porque le restan importancia al evento, o por la lejanía etc. En nuestro estudio constatamos que el nivel de acceso de la población a los servicios de salud es muy limitado, lo cual se considera pudo influir en el resultado obtenido por la vía del reporte espontáneo.
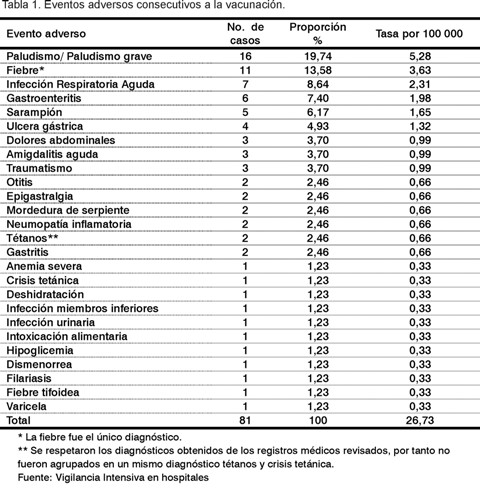
Por el método de vigilancia intensiva en los hospitales distritales se identificaron y analizaron un total de 81 eventos adversos consecutivos a la vacunación (Tabla 1).
Al número total de casos eventos identificados corresponde una frecuencia de 26,7 casos por 100.000 vacunados. Este valor está dentro del rango en el que se clasifican los eventos adversos como raros (1/10.000<evento raro<1/1 000) (9).
En un monitoreo de eventos adversos en una vacunación masiva con la vacuna polisacarídica meningocócica trivalente ACW135, realizado en Burkina Faso (11), los reportes obtenidos fueron a partir de la notificación espontánea, mientras en este fue la vigilancia intensiva en hospitales, la que permitió obtener los datos.
Como puede observarse, el paludismo, la fiebre y las infecciones respiratorias agudas fueron los eventos reportados con mayor frecuencia. Se presentaron en un 19,74%, 13,58 %, y 8,64%, respectivamente.
No se presentaron reacciones anafilácticas ni otras reacciones severas descritas por los fabricantes para esta vacuna (6): sibilancia y urticarias, síndrome de Guillain Barré, ni otras alteraciones neurológicas reversibles.
El paludismo es una entidad que provoca, por sí misma, gran carga de la enfermedad. Esta, junto a la gastroenteritis (7,40% de todos los reportes) y el sarampión (6,17% de todos los reportes), son parte del cuadro de salud en el África Occidental (12).
La fiebre es un evento adverso general que normalmente acompaña a la respuesta inmunitaria. Lamentablemente los reportes no especificaron la temperatura alcanzada, por lo que no fue posible analizar el grado de intensidad. La frecuencia de fiebre encontrada en los sitios de estudio (3,63 por cada 100.000 dosis) está muy por debajo de la reportada para esta vacuna (alrededor del 5% para temperaturas hasta 38,5 °C) y menos del 1% para valores superiores de temperatura (6).
La fiebre es la reacción general más detectada en las vacunas de polisacáridos. En ensayos controlados la frecuencia notificada de reacciones febriles transitorias, con una temperatura de 38,5 °C o más, varía del 0,6% al 3,6% (13).
Según el sistema de vigilancia de eventos adversos de Brasil, la fiebre (mayor o igual a 38,5 °C) ha sido encontrada en 1 caso cada 56 vacunados (14). Si se tiene en cuenta que los casos de fiebre encontrados en el estudio fueron solamente los que acudieron a los hospitales de los distritos puede haber subregistro. Se observa que la proporción de fiebre contra el total de eventos es similar a lo reportado por el sistema español de farmacovigilancia en el primer semestre del año 1998 (15).
En Québec, durante una campaña de vacunación masiva en 1993, usando una vacuna bivalente A+C, la frecuencia notificada de fiebre fue de 1,9%, aunque refieren que la cifra real podría ser más baja (16).
Al realizar la clasificación de los eventos adversos, según las categorías epidemiológicas (Tabla 2), nos encontramos que la mayor proporción corresponde a los eventos "coincidentales" (82,71%), seguidos por los "inducidos por la vacuna" (11,11%) y los de causa "desconocida" en un 6,18%. Ninguno de los eventos adversos presentados fue clasificado de "error programático" ni "precipitados por la vacuna".
En estudio realizado por Bentsi-Enchill (11) relacionado con la búsqueda de eventos adversos a una vacuna de meningococo polisacarídica, los "coincidentales" se presentaron en un 14% y los "inducidos por la vacuna" en un 56%.
En el Distrito Boboye se presentaron pocos eventos adversos en la primera semana posterior a la vacunación (seis casos, 21,43%): Dos casos de fiebre, una crisis tetánica, dos casos de paludismo en menores de 5 años de edad y un caso con epigastralgia en un adulto de 30 años. Después de un análisis detallado de cada uno de ellos se consideró que los dos casos de fiebre estuvieron "inducidos por la vacuna", por la cercana relación de temporalidad con la misma y la ausencia de otras manifestaciones clínicas que hicieran pensar en otra condición patológica.
En las segundas y terceras semanas posteriores a la vacunación, los casos detectados tienen diagnósticos bien definidos desde el punto de vista clínico y con resultados de laboratorio. Ninguno de ellos coincide con los diagnósticos de eventos adversos esperados para este tipo de vacuna, por lo que fueron clasificados como eventos "coincidentales".
En la cuarta semana aparecieron dos casos de fiebre que quedaron incluidos en la categoría de "causa desconocida", ya que por la temporalidad están distantes del acto de la vacunación; la fiebre habitualmente se presenta en las primeras 48 horas según refiere la literatura (7,17).
En el Distrito Bouza se presentaron siete casos de fiebre al cierre de la primera semana, que se consideraron "inducidos por la vacuna", en ausencia de otras manifestaciones clínicas. En la segunda semana todos los eventos fueron clasificados como "coincidentales" con diagnósticos bien definidos.
En la tercera semana se reportaron dos casos de dolores abdominales en los que no se concluyó el diagnóstico y no tuvieron otros síntomas asociados, por lo que se incluyeron en la categoría "causa desconocida".
En la cuarta semana se presentó un caso con dolor abdominal para el que no se concluyó un diagnóstico y fue clasificado como de "causa desconocida". El resto de los eventos fueron clasificados como "coincidentales" por presentar un diagnóstico bien definido desde el punto de vista clínico y de laboratorio.
Para el análisis de causalidad, se utilizó el "Algoritmo de Introspección Global" de la OMS (9,10). Las categorías en los que fueron clasificados dichos eventos se muestran en la Tabla 3.
La mayor proporción de eventos adversos se clasificaron como "no relacionados" con la vacuna (74,07%) por presentar un diagnóstico bien definido desde el punto de vista clínico y de laboratorio. No hubo evidencias que vincularan los eventos adversos a la vacuna o al acto de vacunación y todos pudieron explicarse por una enfermedad subyacente. En la categoría de "improbable" se clasificó el 12,35% de los eventos.
Bentsi-Enchill y cols, encontraron un 17% de eventos no relacionados, no obstante la forma de obtención de los reportes en ese estudio fue diferente al nuestro, al igual que las manifestaciones clínicas y por tanto la causalidad puede mostrarse diferente en estudios realizados en diferentes sitios de observación (11).
La categoría de "muy probable" ocupó el 11,11% de los eventos adversos. Los nueve casos correspondieron al diagnóstico de fiebre, estos guardaron una relación temporal verosímil con la administración de la vacuna y no pudieron ser explicados por una enfermedad concurrente o por el efecto de otros fármacos o sustancias químicas. En la categoría de "posible" se clasificaron dos casos de paludismo (7,14%) que aparecieron en la primera semana posterior a la vacunación, debido a que es un evento que guarda relación temporal razonable con la administración de la vacuna pero que también puede explicarse por una enfermedad concurrente.
En el distrito Boboye se incluyeron tres casos (10,72%) en la categoría "improbable": una crisis tetánica en un niño de 12 años, en un país donde el programa de inmunización solo abarca el primer año de vida hace pensar como muy cierto el diagnóstico de tétanos, y dos casos de fiebre detectados en la cuarta semana posvacunación en personas de 12 y 23 años. En Bouza hubo siete casos (13,21%) que presentaron fiebre y estupor como manifestaciones de entidades definidas: fiebre tifoidea (un caso), paludismo (cuatro casos) y sarampión (dos casos). Estos ocurrieron en la tercera semana después de administrada la vacuna.
La severidad de los eventos adversos es un indicador muy útil e importante para caracterizar el perfil de seguridad de una vacuna. Según este análisis, entre los eventos adversos considerados "muy probables" (nueve casos clasificados) en esa categoría, sólo dos permanecieron ingresados, con una estadía hospitalaria de un día y fueron egresados sin ninguna secuela ni complicaciones.
Aunque por definición de la OMS, el hecho de estar hospitalizado por un evento adverso implica se le considere grave, se consideró que la corta estadía, junto a la evolución rápida y favorable, traduce que la decisión de hospitalizarlos pudo tener otra justificación. El que no estuviese comentada en la historia clínica, no brinda elementos que pudieran cuestionar la seguridad de la vacuna. Los datos de eventos adversos analizados, luego de la administración en campaña de 303.037 dosis de la vacuna polisacárida meningocócica A y C en Níger, constituyen una prueba adicional de que el perfil de seguridad de esta vacuna, que ha tenido gran experiencia de uso en Brasil, son similares en el contexto de esta región del África Occidental, con condiciones sanitarias muy diferentes e incluso cuando esta es utilizada en el transcurso de una situación epidémica.
CONCLUSIONES
La frecuencia de eventos adversos relacionados con la vacuna se corresponde con lo descrito en la literatura para este producto. La vacuna, en las condiciones del presente estudio, demostró ser segura y poco reactogénica.
REFERENCIAS
1. Girard MP, Preziosi MP, Aguado MT, Kieny MP. A review of vaccine research and development: Meningococcal disease. Vaccine 2006;24:4692-700.
2. Djingarey MH, Noazin S, Préziosi MP, Lingani C, Tiendrebéogo S, Touré K, Kiari K, et al. A 20-year retrospective analysis of epidemic meningitis surveillance data in Burkina Faso, Mali and Niger. Presented at: International Pathogenic Neisseria Conference, September 2008; Rotterdam, The Netherlands. Disponible en: http://www.meningvax.org/files/DjingareyIPNC2008RetrospectiveP166.pdf Consultado: 16 de mayo de 2011.
3. World Health Organization. Meningitis in Chad, Niger and Nigeria: 2009 epidemic season. Weekly Epidemiological Record 2010;85 (8):57-68.
4. Blog JANO. Medicina y Humanidades. Cerca de 2.000 muertos por meningitis en África subsahariana sólo en 2009. Emergencia. Epidemia de meningitis en África, 2009. Disponible en:http://www.e-mergencia.com/foro/archive/index.php/t-25953.html Consultado: 9 de mayo de 2011.
5. World Health Organization. Outbreak news: Meningococcal disease, African meningitis belt. Weekly Epidemiological Record 2009;84(15):117-32.
6. Bio-Manguinhos. Vacuna Polisacárida Meningocócica A y C (10 dosis). Prospecto. (Disponible en: http://www.fiocruz.br/bio/media/bulas/vacinas/BMBUL00702V190624ME10%20exp.pdf Consultado:20 de julio 2010.
7. Ministerio de Salud Pública (Cuba). Regulación No 17-2008. Directrices para la investigación de los eventos adversos supuestamente atribuibles a la vacunación o inmunización (ESAVI). La Habana: MINSAP; 2008.
8. Direction Générale de la Sante Publique, Direction de la Lutte contre la maladie. Cahier de Rapport mensuel d'Activités. PEV Systématique. République de Niger: Ministère de la Sante Publique; 2008.
9. Organización Mundial de la Salud. Eventos adversos posvacunales (EAP): Evaluación de la causalidad. Disponible en: http://www.who.int/immunizationsafety/en/ Consultado: 20 de julio de 2009.
10. Collet JP, Mac Donald N, Ashman NC, Pless R & Advisory Committee on Causality Assessment Monitoring signals for vaccine safety. The assessment of individual adverse event report by and expert advisory committee. Bulletin of the World Health Organization 2000; 78(2):178-85.
11. Bentsi-Enchill AD, Zongob I, Khamassia S, Pless R, Thombianod R, Tiéndrebéogo S, et al. Monitoring of adverse events during the 2003 mass vaccination campaing with the trivalent meningococal A/C/W135 polysaccharide vaccine in Burkina Faso. Vaccine 2007; 25S: A72-A78.
12. World Health Organization. Niger, country mortality profile; 2009. Disponible en: http://www.who.int/whosis/mort/profile/mortafronerniger.pdf . Consultado: 18 de febrero de 2010.
13.King WJ, Mac Donald NE, Wells G, et al. Total and functional antibody response to a quatrivalent meningococcal polysaccharide vaccine among children. Journal of Pediatrics 1996;28:196-202.
14. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Manual de vigilância epidemiológica de eventos adversos pós-vacinação/Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância Epidemiológica. Brasília: Ministério da Saúde; 2008
15. De Abajo FC, Álvarez Requejo A, Ayani I, Carrillo JA, Carvajal A, Castillo JR, Cuchi T, et al. Seguridad de la vacuna antimeningocócica A+C. Datos recogidos por el Sistema Español de Farmacovigilancia. Gaceta Sanitaria 1999;13(6):462-7.
16. Saintonge F. Évaluation des reactions adverses associées au vaccine anti-méningococcique polysaccharideque de groupe A et de groupe C. Montréal, Canada. Direction de la Santé Publique de Montréal- Centre; 1995.
17. Fiocruz. Polysaccharide meningococcal A and C vaccine is pre-qualified by the WHO; 2007. Disponible en: http://www.fiocruz.br/bioeng/cgi/cgilua.exe/sys/start.htm? Consultado: 8 de julio de 2009.
Recibido: Marzo de 2011
Aceptado: Abril de 2011