Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.23 no.2 Ciudad de la Habana Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Evaluación de cuatro métodos de extracción del ADN de Histoplasmacapsulatum y su uso en reacciones de PCR
Evaluation of four Histoplasma capsulatum DNA extraction methods and their use in PCR reactions
Ernesto Xavier Monroy-Vaca,* Carlos Manuel Fernández-Andreu, Raúl Díaz-Rodríguez, Gerardo Martínez-Machín, María Teresa Illnait-Zaragozí, Mayda Perurena-Lancha
*Departamento de Bacteriología-Micología, Vicedirección de Microbiología, Instituto de Medicina Tropical Pedro Kourí, IPK. Autopista Novia del Mediodía, km 6½, CP 601, Marianao 13, La Habana, Cuba.
email:erno@ipk.sld.cu
*Licenciado en Microbiología; MSc Bacteriología-Micología; Aspirante a Investigador.
RESUMEN
Histoplasmacapsulatum es un hongo endémico de Cuba y el agente causal de la histoplasmosis. Esta micosis se presenta en forma de brotes epidémicos, afecta a las personas, independiente de su estado inmunológico. Su diagnóstico se realiza mediante técnicas microbiológicas, serológicas e histológicas que tienen una sensibilidad moderada y son demoradas. Por lo que se hace necesario la estandarización de métodos moleculares rápidos y eficientes para el diagnóstico de esta micosis. Se evaluaron cuatro métodos de extracción del ADN (enzimático, mecánico y dos químicos: tiocianato de guanidinio y Tritón X-100) a partir de una cepa de H. capsulatum en fase filamentosa. Se determinó la concentración, la pureza, el rendimiento y la integridad del ADN mediante espectrofotometría y electroforesis en gel de agarosa. Se evaluaron dos técnicas de PCR con el ADN obtenido, con cebadores específicos de especie y otro con un cebador arbitrario. Los mejores resultados de concentración, pureza, rendimiento e integridad se obtuvieron con el método de extracción enzimático. Se logró la estandarización de las PCR con cebadores específicos, confirmándose así las 16 cepas estudiadas como H. capsulatum. Con el cebador arbitrario se amplificaron secuencias diferentes en las cepas ensayadas. Se demostró que el método de extracción enzimática brindó un ADN de buena calidad para su utilización en PCR. Este trabajo facilita el diagnóstico rápido y confiable de H. capsulatum en Cuba y brinda la posibilidad de identificar cepas con estructuras relacionadas genéticamente con los marcadores de patogenicidad y la virulencia, útiles para conformar un inmunógenovacunal.
Palabras clave: detección molecular, extracción de ADN, Histoplasma capsulatum var. capsulatum, histoplasmosis, PCR.
ABSTRACT
Histoplasma capsulatum is a fungus endemic from Cuba and it is the etiologic agent of histoplasmosis. This mycosis appears as epidemic outbreaks and affects people regardless their immunological status. Diagnosis of histoplasmosis is based on microbiological, histopathological and serological methods, which show moderated sensitivity or are time-consuming. Rapid and efficient molecular tools are highly demanding. Four DNA extraction methods (enzymatic, mechanic, and two chemistry: guanidine tiocianate and TX-100) were evaluated from a H. capsulatum strain in the mold phase. DNA concentration, purity, integrity and yield were estimated by spectrophotometry and agarose gel electrophoresis. Two PCR techniques were tested using specific and arbitrary primers. The best DNA extraction method results were obtained with the enzymatic procedure. Sixteen different Cuban H. capsulatum strains were confirmed by the PCR standardized with specific primers. Different sequences were amplified using the arbitrary primer. The enzymatic protocol is the best option for obtaining a good quality DNA for molecular analysis. This work has created a platform a faster and reliable diagnosis of H. capsulatum in Cuba, and provides the ability to identify strains with genetically related structure of pathogenicity and virulence markers useful as vaccine immunogen.
Key words:molecular detection, DNA extraction, Histoplasma capsulatum var. capsulatum, histoplasmosis, PCR.
INTRODUCCIÓN
La histoplasmosis es una infección fúngica sistémica causada por Histoplasmacapsulatumvar. capsulatum. Este hongo dimórfico habita en los suelos enriquecidos con el guano de los murciélagos y las excretas de aves. Aunque su distribución es cosmopolita, predomina en los climas tropicales y subtropicales, siendo el continente americano el de mayor endemicidad (1).
Sanguily y colaboradores (2) junto con Barquet y colaboradores (3) notifican en 1951 los primeros casos de histoplasmosis en Cuba. Desde entonces esta enfermedad se presenta en forma de brotes epidémicos en todas las provincias. Se considera una micosis ocupacional asociada con algunos grupos de riesgo y ocupa el cuarto lugar en orden de frecuencia entre las micosis oportunistas en las personas infectadas con el virus de la inmunodeficiencia humana (4).
El diagnóstico de laboratorio de la histoplasmosis se basa en el aislamiento y la identificación de su agente causal mediante métodos morfológicos, su confirmación se logra mediante la prueba de exoantígenos y la demostración de su dimorfismo in vitro. La detección de anticuerpos es de gran utilidad, aunque se pueden presentar reacciones cruzadas en los pacientes con otras micosis sistémicas (5). En cambio, la detección del antígeno polisacarídico en la orina y el suero se considera una técnica de alta sensibilidad y especificidad, muy útil en el diagnóstico de los pacientes inmunocomprometidos (6). No obstante, esta resulta de difícil adquisición al no estar disponible comercialmente.
En los últimos años se diseñan otros métodos alternativos basados en la detección de los ácidos nucleicos. Existen procedimientos no cuantitativos basados en la PCR, dirigidos a genes específicos, como el que codifica para el antígeno M o para la proteína de 100 kDa de H. capsulatum (7-9). Asimismo, se describen métodos de PCR en tiempo real (PCR-TR) que demuestran su utilidad diagnóstica en los enfermos con histoplasmosis; además, permiten evaluar la carga fúngica y la respuesta al tratamiento (10, 11).
Para lograr una adecuada amplificación por PCR, se debe asegurar una extracción y purificación correcta del ADN que proporcione resultados confiables y rápidos para su utilización en el diagnóstico y la caracterización.
Esta técnica constituye una poderosa herramienta para el diagnóstico temprano de diversas enfermedades infecciosas (12), como la histoplasmosis, y contribuye así al mejor conocimiento de esta micosis en Cuba.
Además, los estudios moleculares permitirán conocer la estructura genética de las cepas circulantes de H. capsulatum y la determinación de algunos marcadores de patogenicidad y virulencia que pudieran valorarse como inmunógenovacunal.
Este trabajo tuvo como objetivo comparar diferentes métodos de extracción de ADN y evaluar sus productos mediante técnicas de PCR para la detección de H. capsulatum en fase filamentosa, con vista a la selección de un método adecuado para su uso en el diagnóstico y la caracterización molecular.
MATERIALES Y MÉTODOS
Se utilizaron 16 cepas de H. capsulatum, identificadas previamente por métodos morfológicos y serológicos, se conservaron en agua destilada estéril y pertenecientes a la colección del Laboratorio de Micología del Instituto Pedro Kourí (LMIPK).
Extracción del ADN
Se compararon cuatro métodos de extracción del ADN, según la metodología y las recomendaciones descritas por algunos autores (10-13) y se tuvieron en cuenta también otras modificaciones (9, 14, 15).
Para ello se preparó una suspensión acuosa (10 mL) de la cepa H.capsulatumLMIPK-004 en fase filamentosa, que se consideró la suspensión madre. Cada método se evaluó por triplicado. Para estimar la masa celular a emplear en cada experimento se determinó el peso húmedo de cada réplica:
Método enzimático (ME)
Se utilizó el método de Löffler y colaboradores (12), con las modificaciones de Harkins (14) y Lugert y colaboradores (13). Se tomó una alícuota de 400 mL de la suspensión madre y se introdujo en un tubo de crioconservación de 1,8 mL (Corning, EUA), con 1 mL de solución amortiguadora salina fosfato, se centrifugó a 12 000 g por 3 min en una centrifuga 5410 (Eppendorf, Alemania) y se descartó el sobrenadante. Se adicionaron 500 mL de solución amortiguadora de lisis [Tris-HCl (pH 7,6) 10 mmol/L; EDTA 10 mmol/L; NaCl 50 mmol/L; SDS 0,2%; proteinasa K 200 mg/L (Promega, EUA)] seguido de incubación por 45 min a 65°C. La muestra se expuso a tres ciclos de nitrógeno líquido y 95 °C por 1 min.
Método mecánico (MM)
Se ensayó el método utilizado por Buitrago y colaboradores (10). Una alícuota de 400 mL de la suspensión madre se introdujo en un tubo de crioconservación de 1,8 mL con tres perlas de vidrio de 5 mm de diámetro. La muestra se expuso a tres ciclos de nitrógeno líquido y 95°C por un min, y se agitó vigorosamente en agitador mecánico AG220 (GallenKamp, Inglaterra) por 30 s.
Tiocianato de Guanidinio (TG)
Se empleó el método descrito por Sandhu y colaboradores (15), con modificaciones según Colella y colaboradores (9). A un tubo de 1,5 mL se le adicionaron 400 µL de la suspensión madre, se centrifugó a 12 000g por 3 min y se descartó el sobrenadante. Se agregaron 600 µL del reactivo TG [tiocianato de guanidinio 6 mol/L (Biochemical, Inglaterra); acetato de sodio 20 mmol/L; Tris-HCl (pH 8,0) 50 mmol/L]. El contenido se mezcló y se expuso a 95°C por 30 min. La mezcla se agitó vigorosamente por 20 s.
Tritón X-100 (TX)
Se empleó el método utilizado por Martagon-Villamil y colaboradores(11) con las modificaciones descritas por Colella y colaboradores (9). A un tubo de 1,8 mL se le adicionaron 400 mL de la suspensión madre y 400 µL del reactivo TX [(Tritón X-100 1% (Merck, Alemania); Tween 20 0,5% (Merck); Tris-HCl 10 mmol/L (pH 8,0)]. La suspensión se agitó en vórtex por 1 min y se incubó a 95°C por 45 min.
Purificación del ADN de las muestras
La purificación del ADN se realizó de la misma forma para los cuatro métodos analizados (14).Se adicionaron 400 µL de agua ultrapura y 400 µL de fenol-cloroformo-alcohol isoamílico (25:24:1) saturado con Tris-HCl 100 mmol/L (pH 8,0) y se mezcló por inversión, seguido de centrifugación a 12000 gpor 10 min. Se transfirieron 600 mL del sobrenadante a un tubo de 1,5 mL y que contenía 600 mL de isopropanol. Seguidamente, se centrifugó a 12000 g por 10 min a la temperatura ambiente (TA) y luego, se descartó el sobrenadante. Al precipitado se le agregaron 750 mL de etanol frío al 70%, se mezcló por inversión, se centrifugó de igual forma y se descartó el alcohol. La muestra se dejó secar a TA durante 30 min y se resuspendió en 50 mL de Tris-HCl (pH 8,0) 10 mmol/L; EDTA 1 mmol/L. Se conservó a 4°C hasta su uso.
Cuantificación y estimación de la pureza del ADN extraído
Para estimar la concentración (C) y determinar las impurezas proteicas (P) del ADN presentes en cada muestra, se utilizó un espectrofotómetro V-630 (Jasco, Japón), siguiendo procedimientos habituales (14).
Cálculo del rendimiento (R)
Para determinar el rendimiento se empleó la siguiente relación (14):
R= Cantidad de ADN (mg)/Masa húmeda (mg)
Donde:
Cantidad de ADN (mg) = C(Xi)xVf
C (Xi): Concentración de ácidos nucleicos; y Vf: volumen final de 50 mL.
Visualización de la integridad del ADN
Se observó la integridad del ADN extraído de H. capsulatum en una electroforesis submarina en gel de agarosa al 0,8%, con solución amortiguadora de Tris-borato-EDTA (TBE) teñida con bromuro de etidio (0,5 mg/L). La corrida de los ácidos nucleicos se realizó a 120 V durante 10 min. Para visualizar el ADN se utilizó un transiluminador de luz UV N90 (Konrad Benda, Alemania) y los resultados se fotografiaron con una cámara digital Coolpix 3700 (Nikon, Japón) para su posterior interpretación. La integridad del ADN extraído se determinó por apreciación visual.
Elección del método de extracción de ADN
Se seleccionó el método que brindó los mejores resultados en cuanto a la concentración, la pureza, el rendimiento, la cantidad e integridad del ADN, prosiguiéndose a la extracción y cuantificación del ADN de las 16 cepas de H. capsulatum, a partir de masas húmedas de 400-700 mg.
Amplificación de ADN por PCR
1. PCR con cebadores arbitrarios (RAPD, siglas en inglés)
Para la verificación de la integridad del ADN por el método de RAPD se escogieron de forma aleatoria 6 suspensiones de H. capsulatummediante el cebador universal OPA-2 (Opa Kit A, Operon Technologies, EUA).
La mezcla de reacción (20 mL) contenía: 4 mL de solución amortiguadora GoTaq® Flexi Green (Promega, EUA), MgCl2 3 mmol/L, dNTP 1,5 mmol/L, GoTaq®Flexi ADN polimerasa (Promega, EUA) 0,5 U, cebador OPA 2 50 pmol/L y 2 mL de ADN purificado (diluido 1:20 ó 1:30, según su concentración). La PCR se realizó con una preincubación de 2 min a 95 °C seguida de 45 ciclos de desnaturalización
(30 s a 95 °C), anillamiento (1 min a 30 °C), y extensión (2 min a 72 °C) y finalmente 5 min a 72 °C.
2. PCR con cebadores específicos
En la Tabla 1 se describen los cebadores utilizados (Centro de Ingeniería Genética y Biotecnología, Cuba) para la amplificación de los fragmentos del genoma correspondientes a las cepas de H. capsulatum.
Para estandarizar las reacciones de PCR simples con los juegos de cebadores específicos (volumen final de 20 mL), se agregaron 4 mL de GoTaq®Flexi Green (Promega, EUA), MgCl2 1,5 a 3 mmol/L, cebadores 0,3 a 0,9 mmol/L, GoTaq® Flexi ADN polimerasa (Promega, EUA) 0,5 a 2 U, dNTPs 0,8 mmol/L y 2 mL de ADN purificado (diluido 1:20 ó 1:30, según su concentración). Respecto a las condiciones del PCR, se realizó una preincubación de 5 min a 95 °C seguida de 45 ciclos de desnaturalización (30 s a 95 °C), anillamiento (30 s a 52 °C), y extensión (30 s a 72 °C) y finalmente 5 min a 72 °C.
Todas las reacciones de PCR se realizaron en un termocicladorMastercycler personal (Eppendorf, Alemania).
3. Visualización de los fragmentos amplificados
El ADN amplificado se visualizó mediante electro-foresis en gel de agarosa al 2% con TBE teñido con bromuro de etidio. La corrida de los ácidos nucleicos se ajustó a 70 V por 60 min, usando 100 pbladder (Promega) como marcador molecular. Para la visualización de los productos amplificados se siguió la metodología descrita anteriormente.
RESULTADOS Y DISCUSION
Evaluación de los métodos de extracción del ADN de H. capsulatum
Los resultados de la comparación de los cuatro métodos de extracción de ADN se describen en la Tabla 2.
Al comparar la integridad del ADN que se obtuvo por los diferentes métodos de extracción por electroforesis en gel de agarosa (Fig. 1) se observó que el ME mostró bandas cromosomales íntegras y regiones donde el ADN está fragmentado, no así con las otras técnicas que exponen zonas donde el ADN está degradado o no es visible. Los resultados referidos en la Tabla 2 están en concordancia con lo descrito por Lugert y cols. 2006, quienes comparan seis técnicas de extracción de ácidos nucleicos totales, siendo el ME el que expone los mejores resultados, al brindar valores superiores a los métodos que emplean la ruptura mecánica y térmica sin enzimas proteolíticas (13).Los métodos que utilizan proteinasa K son más eficientes para obtener un ADN de alto peso molecular, ya que rompe el entrecruzamiento entre los ácidos nucleicos y las proteínas, liberando así un ADN de mayor talla molecular (16).
Elección del método de extracción de ADN
Al hacer un análisis integrado de los parámetros evaluados se determinó que el ME brindó los mejores resultados en las cinco variables analizadas (Tabla 2), por lo que se seleccionó para la extracción de ADN de las 16 cepas de H. capsulatum en fase filamentosa, lográndose un ADN con una concentración (entre 16 y 79 mg/L), pureza (de 1,66 y 1,92) e integridad adecuadas para su amplificación (Fig. 2).
Evaluación del ADN con cebadores arbitrarios (RAPD)
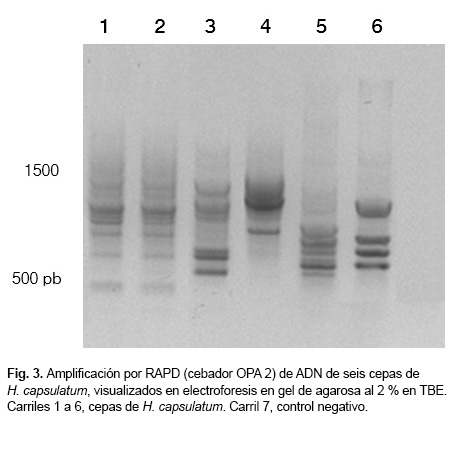
Al realizar la amplificación por RAPD, para comprobar la calidad del ADN y evidenciar si el material genético era amplificable, se obtuvieron de 5 a 10 bandas de un peso molecular correspondiente a 500-1 500 pb (Fig. 3).
En la Figura 3 se observan disímiles patrones, no obstante, los carriles 1 y 2 mostraron bandas idénticas.
Este último resultado se esperaba, ya que las cepas se aislaron de un mismo paciente a partir de muestras de diferentes orígenes (sangre y biopsia de piel) en distintos estadios de su evolución clínica, mostrando que el ADN obtenido a partir de la utilización del ME es útil para los estudios de caracterización molecular del patógeno.
Las huellas genéticas logradas por RAPD están basadas en la generación de múltiples productos por PCR con movilidades electroforéticas diferentes.
Estos productos facilitan el descubrimiento de dos tipos de variaciones genéticas: (i) diferencias en la longitud del DNA y (ii) alteraciones en las secuencias de las regiones a amplificar (17), aportando información acerca de la variabilidad genética entre los aislamientos, así como de la diversidad de H. capsulatum en Cuba.
PCR con cebadores específicos
Se encontró que los mejores valores de concentración para: MgCl2 fue de 1,6 mmol/L; cebadores 0,9 mmol/L, para la GoTaq®Flexi ADN polimerasa 1 U.Las PCR realizadas con los cebadores específicos para la región ITS 1 con ADN de dos cepas de H. capsulatum(LMIPK-0294 y LMIPK-074), brindaron bandas esperadas de 182 y 191 pb en ambos casos (Fig. 4).
Manteniendo las mismas condiciones de PCR descritas anteriormentey los cebadores específicos, se logró la amplificación de las muestras de ADN de las 16 cepas estudiadas, donde se observó una buena reproducibilidad, abriendo un futuro promisorio en Cuba como una técnica de diagnóstico para la histoplasmosis.Los resultados obtenidos permiten confirmar que las 16 cepas previamente identificadas mediante métodos fenotípicos se correspondieron con la especie H.capsulatumy se crearon las bases para el desarrollo de técnicas moleculares para el diagnóstico de la histoplasmosis y la caracterización molecular de su agente causal en el Laboratorio de Micología del IPK.Existen varios métodos para la detección del ADN de H. capsulatumen un modelo murino, muestras clínicas y cultivos puros (8, 9, 18-20). Algunos se basan en técnicas de PCR convencional (simple y anidada) y otras en PCR cuantitativa como la PCR-TR (10, 11), dirigidas a los distintos genes de este hongo. La especificidad y sensibilidad reportadas para esta técnica son satisfactorias, pero no es posible extender a los laboratorios de bajos recursos debido a su complejidad, escasa automatización y falta de protocolos estandarizados (10).
Muñoz y cols. (20), al normalizar una PCR convencional para detectar H. capsulatuma partir de muestras respiratorias, biopsias y fluidos corporales, con una sensibilidad y especificidad de 100 y 92,4%, respectivamente, concluyen que esta prueba es útil para el diagnóstico de la histoplasmosis en las regiones endémicas.
Este trabajo constituye el primer acercamiento en materia de estudios moleculares en H. capsulatumen Cuba. El mismo crea una plataforma no solo para el diagnóstico rápido y fiable en los pacientes afectados por este patógeno, sino que también abrirá las puertas a una amplia gama de estudios, como la morfogénesis y sus vías regulatorias, la resistencia a las drogas antifúngicas, la tipificación molecular, la diferenciación genotípica y la evaluación de estructuras relacionadas genéticamente que puedan valorarse como un inmunógenovacunal. Los resultados que se deriven contribuirán a un mejor conocimiento de la histoplasmosis y su agente causal en Cuba, lo cual redundará en beneficio de los individuos enfermos y susceptibles.
REFERENCIAS
1. Arenas GR. Micología Médica Ilustrada, 2da ed. México DF: Mc Graw - Hill Interamericana; 2003.p. 65-70.
2. Sanguily J, Fernández O, León F. Histoplasmosis en Cuba. Reporte de un caso con breve revisión de la literatura. ArchSocEstClinHab 1951;44:1-44.
3. Barquet A, Chediak M, Magriñat G. Histoplasmosis: resumen de la enfermedad. Presentación de un caso diagnosticado por punción ganglionar. Rev Kuba 1951;7:143-53.
4. Fernández-Andreu CM. Histoplasmosis en Cuba: Contribución a su diagnóstico, prevención y control [Tesis Doctoral]. La Habana: IPK; 2004. Disponible en: http://www.ipk.sld.cu/biblioweb/tesis.htm
5. Kauffman CA. Diagnosis of histoplasmosis in immunosuppressed patients. Cur OpiInfec Dis 2008;21:421-5.
6. Wheat LJ. Histoplasmosis: a review for clinicians from non-endemic areas. Mycoses 2006;49:274-82.
7. Bialek R, Ernst F, Dietz K, Najvar L, Knobloch J, Graybill J, et al. Comparison of staining methods and a nested PCR assay to detect Histoplasmacapsulatum in tissue sections. Am J ClinPathol 2002;117:597-603.
8. Bracca A, Tosello ME, Girardini JE, Amigot SL, Gómez C, Serra E. Molecular detection of Histoplasmacapsulatumvar. capsulatum in human clinicalsamples. J ClinMicrobiol 2003;41:1753-5.
9. Colella MT, Mata S, Hartung C, Pérez C, Roselló A, Olaizola C, et al. Identificación de Histoplasmacapsulatum en muestras clínicas mediante la técnica de PCR en dos rondas. Kasmera 2007;35:156-63.
10. Buitrago MJ, Gómez-López A, Monzón A, Rodríguez-Tudela JL, Cuenca-Estrella M. Evaluación de una técnica de PCR cuantitativa para el diagnóstico clínico de la histoplasmosis importada. EnfermInfeccMicrobiolClin 2007;25:16-22.
11. Martagon-Villamil J, Shrestha N, Sholtis M, Isada CM, Hall GS, Bryne T. Identification of Histoplasmacapsulatumfrom culture extracts by real-time PCR. J ClinMicrobiol 2003;41:1295-8.
12. Löffler J, Hebart H, Brauchle U, Schumacher U, Einsele H. Comparison between plasma and whole blood specimens for detection of Aspergillus DNA by PCR. J ClinMicrobiol 2000;38:30-3.
13. Lugert R, Schettler C, Gross U. Comparison of different protocols for DNA preparation and PCR for detection of fungal pathogens in vitro. Mycoses 2006;49:298-304.
14. Harkins EW, editor. Current protocols in molecular biology. New York: John Wiley & Sons Inc; 2005.
15. Sandhu G, Kline BC, Stockman L, Roberts GD. Molecular probes for diagnosis of fungal infections. J ClinMicrobiol 1995;33:2913-9.
16. de Armas Y, Capo V, Lopez L, Mederos L, Diaz R. Comparison of three DNA extraction methods from paraffin embedded tissues. Biotecnología Aplicada 2011;28:40-3.
17. Muniz M, Morais M, Tavares S, Meyer W, Nosanchuk J, Zancope-Oliveira M. Comparison of Different DNA-Based Methods for Molecular Typing of Histoplasmacapsulatum. ApplEnvironMicrobiol 2010;76(13):4438-47.
18. Bialek R, Feucht A, Aepinus C, Just-Nubling G, Robertson VJ, Knobloch J. Evaluation of two nested PCR assays for detection of Histoplasmacapsulatum DNA in human tissue. J ClinMicrobiol 2002;40:1644-7.
19. Bialek R, Fisher J, Feucht A, Najvar L, Dietz K, Knobloch J, et al. Diagnosis and monitoring of murine histoplasmosis by a nested PCR assay. J ClinMicrobiol 2001;39(4):1506-9.
20. Muñoz C, Gómez BL, Tobón A, Arango K, Restrepo A, Correa MM, et al. Validation and clinical application of a molecular method for identification of Histoplasmacapsulatum in human specimens in Colombia, South America. Clin Vaccine Immunol 2010;17(1):62-7.
Recibido: Julio de 2013
Aceptado: Agosto de 2013