Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor vol.24 no.1 Ciudad de la Habana abr. 2015
ARTÍCULO ORIGINAL
Obtención de un diagnosticador rápido de cólera, basado en partículas de látex acopladas a un anticuerpo monoclonal contra lipopolisacárido de Vibrio cholerae O1
Obtaining of a rapid diagnostic test for Cholera, based on latex particles coupled with a monoclonal antibody against Vibrio cholerae O1 lipopolysaccharide
Maribel Cuello-Pérez, 1* Oscar Otero-Alfaro, 1 Fátima Reyes-López, 1 Frank Camacho-Casanova, 1 Giovanni Duranti, 2 Marta María Morales-Leslie, 3 Regla Zenaida Mora-Guerra, 3 Sonsire Fernández-Castillo, 1 Elisabeth González-Aznar, 1 Claudio Piermatte, 2 Daniel Tomás Cardoso-González, 1 Luis Guillermo García-Imías 1
1 Instituto Finlay. La Habana, Cuba.
2 CPM scientific, Italy.
3 Centro Provincial de Higiene y Epidemiologia de La Habana, La Habana, Cuba.
email: mcuello@finlay.edu.cu
* Dra. en Ciencias Químicas, Investigador Titular y Jefa del Grupo de Anticuerpos Monoclonales y Diagnóstico. Dirección de Investigaciones. Instituto Finlay.
RESUMEN
El cólera es una enfermedad infecto-contagiosa intestinal aguda, causada por la ingestión de alimentos o agua contaminada con los serotipos O1 y O139 de la bacteria Vibrio cholerae. Se caracteriza por diarrea secretora abundante que llevan rápidamente a la deshidratación. Sin tratamiento adecuado produce la muerte en horas, por lo que el diagnostico precoz es muy importante sobre todo porque al inicio es difícil diferenciarla de otras enfermedades diarreicas agudas. La prueba diagnóstico de oro es el coprocultivo; sin embargo, no garantiza una detección rápida de la enfermedad. Recientemente se desarrollaron ensayos rápidos, se basan en tiras reactivas y aglutinación con partículas de látex, muy efectivos, pero difíciles de adquirir por sus altos precios. El objetivo de este trabajo fue obtener un diagnosticador rápido basado en partículas de látex acopladas a un anticuerpo monoclonal (AcM) contra el lipopolisacárido de V. cholerae O1, el cual se obtuvo en el Instituto Finlay. Se usaron partículas de látex de 0,8 µm en una suspensión al 10% a las que se acopló durante 2 h a 37°C el AcM a 0,25 mg/mL. Se evaluó la sensibilidad, especificidad y el desempeño en 84 muestras de heces de pacientes con diagnóstico presuntivo de cólera. El diagnosticador que se obtuvo no evidenció reactividad cruzada frente a cepas no-O1, ni contra otros enteropatógenos. El diagnosticador látex presentó valores de sensibilidad, especificidad y eficacia de 97,87; 97,29 y 97,6 % respectivamente, muy similares al diagnosticador comercial CTK-Biotech. El diagnosticador látex que se obtuvo se puede utilizar en el diagnóstico rápido de la enfermedad.
Palabras clave: anticuerpos monoclonales, Vibrio cholerae , diagnóstico, látex.
ABSTRACT
Cholera is an acute contagious intestinal disease caused by ingestion of food or water contaminated with O1 and O139 serotypes of the bacterium Vibrio cholerae . Cholera is characterized by abundant secretory diarrhea leading to dehydration. Death occurs within hours without treatment, so early diagnosis is very important, especially at the beginning of the disease, because it is difficult to differentiate from other acute diarrheal diseases. The diagnostic golden test is the stool culture; however, it does not guarantee a rapid detection of the disease. Rapid tests have been recently developed; they are based on test strips and agglutination with latex particles, which are very effective, but difficult to acquire for their high prices. The objective of this research was to obtain a quick assay based on latex particles coupled with a monoclonal antibody (mAb) against V. cholerae O1 lipopolysaccharide obtained in Finlay Institute. Latex particles of 0.8 µm were used in a 10% suspension, and they were coupled to the mAb (0.25 mg/ml) for 2 hours at 37°C. The sensitivity, specificity and performance were evaluated in 84 stool samples from patients with presumptive diagnosis of cholera. The diagnostic test obtained showed no cross-reactivity against no-O1 strains and other enteropathogens. Latex diagnostic test showed values of sensitivity, specificity and efficacy of 97.87; 97.29 and 97.6% respectively, very similar to the commercial diagnostic test CTK-Biotech. The latex reagent obtained can be used in the rapid diagnosis of the disease.
Key words: monoclonal antibodies, Vibrio cholerae O1, diagnostic, latex.
INTRODUCCIÓN
El cólera es una enfermedad infecto-contagiosa intestinal aguda, causada por la ingestión de alimentos o agua contaminada con la bacteria Vibrio cholerae. Se identificaron más de 200 serogrupos (definidos por el antígeno somático O) pero solo los serogrupos O1 y O139, causan brotes epidémicos , el O1 es el de mayor incidencia. Las cepas distintas de la O1 y la O139 causan diarrea leve, pero no dan origen a epidemias (1). La enfermedad es endémica en más de 50 países de diferentes áreas de Asia, África, el Mediterráneo y más recientemente, América Central y del Sur. En otras regiones se presenta como epidemias muy desbastadoras con un patrón estacional, aparece de forma explosiva en varios focos simultáneamente (2) . La incidencia de la enfermedad a nivel mundial aumentó de manera constante desde el año 2005, produce entre 3 y 5 millones de casos de cólera por año y entre 100.000 y 120.000 defunciones. En el 2012, la OMS notificó 245.393 casos de cólera, de ellos más del 49% se produjeron en la región de las Américas (3, 4). Cuba, a raíz de la epidemia que ocurrió en Haití a finales del 2010, revitalizó la vigilancia para el diagnóstico oportuno de la enfermedad y dos años más tarde se detectaron los primeros casos en la provincia Granma, con 701 casos confirmados en todo el país hasta la semana epidemiológica 8 del 2014 (5, 6).
El cólera es una enfermedad de aparición brusca, con periodo de incubación corto, diarrea de tipo secretora, copiosa, e indolora, semejantes al agua de arroz (7). Estos síntomas son producto a que la bacteria produce una enterotoxina (toxina colérica, TC) que causa una excesiva secreción intestinal de agua y electrolitos (sodio, bicarbonato y potasio) (8).
Cuando la enfermedad comienza, alrededor del 80-90% de los episodios tienen carácter leve o moderado, difíciles de distinguir clínicamente de otras enfermedades diarreicas agudas (EDAs). Sin embargo, si no se recibe tratamiento oportuno, la enfermedad evoluciona en horas a la rápida deshidratación del enfermo y a la muerte en muchos casos. La rehidratación intensiva es la medida más importante, con lo cual la mortalidad baja de un 50% a menos de un 0,2% (9, 10).
La aparición brusca de la enfermedad, difícil de diferenciar de otras EDA en los estadios iniciales, con una rápida y tórpida evolución, que sin un tratamiento oportuno puede llevar a la muerte en horas, hacen que el desarrollo de métodos de diagnósticos rápidos, específicos, sensibles y económicos sean de suma importancia (11). La detección temprana de la bacteria, no solo permite suministrar oportunamente el tratamiento específico, sino también iniciar de manera ágil y racional las medidas de control epidemiológico, pues aunque otras EDAs requieren del mismo tratamiento de rehidratación, únicamente cuando se trata de V. cholerae es indispensable establecer medidas inmediatas de control epidemiológico que permitan limitar la propagación de la enfermedad (12).
Contradictoriamente la prueba de oro para el diagnóstico de la enfermedad lo constituye el coprocultivo, que si bien tiene importancia para el aislamiento y serotipificación de la bacteria, no tiene relevancia clínica, pues el resultado de la misma demora entre uno y tres días en dar resultados confiables. Este procedimiento, además, requiere de una infraestructura de laboratorio relativamente compleja, cuando en muchos de los países afectados por el cólera, la disponibilidad de laboratorios con capacidad para realizar cultivos bacteriológicos es reducida (11, 13).
En los últimos años se desarrollan varios métodos para el diagnóstico rápido de V. cholerae O1 y O139. Los primeros métodos desarrollados empleaban anticuerpos policlonales, que permiten identificar la bacteria directamente a partir de medios de aislamiento primario. Posteriormente se aumentó la especificidad de estas pruebas con el desarrollo de AcM específicos contra diferentes factores de virulencia de la bacteria, principalmente contra la TC y contra el lipopolisacarido (LPS) (12). Estos AcM se emplean en diferentes sistemas diagnósticos, los de mayor uso son la técnica de aglutinación y los sistemas inmunocromatográficos, conocidos como tiras reactivas (dipstick).
Dentro de los diagnosticadores que emplean la técnica de aglutinación se encuentran: Cholera Screen® (New Horizons Diagnostics Corp., Columbia, Maryland, USA), que se basa en la co-aglutinación de células de Staphylococcus aureus recubiertas con un AcM contra antígenos de V. cholerae O1, Pathogen Detection Kit® (PDK, Intelligent Monitoring Systems, Gainsville, Florida, USA), en el que los AcM anti LPS se absorben sobre partículas de látex y Cholera SMART® (Sensitive Membrane Antigen Rapid Test, New Horizons Diagnostics Corp., Columbia, Maryland, USA) donde los AcM anti LPS que reaccionan con el V. cholerae O1 presentes en la muestra, se marcan con oro coloidal (14, 15).
Dentro de las tiras reactivas se encuentran el CTK Biotech® (OnSite Cholera Ag Rapid Tes, CTK Biotech, Inc., San Diego, USA) y el SD BIOLINE® Cholera Ag O1/O139 (SD, Standard Diagnostics, Inc., Kyonggi-do, Korea), entre otros (16). Todos estos métodos revolucionaron el diagnóstico de la enfermedad, son muy efectivos en el diagnóstico precoz de la enfermedad, pero son pruebas muy caras que no están al alcance de todos, sobre todo, teniendo en cuenta que el cólera es una enfermedad de países pobres o sub desarrollados.
Cuba, a partir de la aparición de casos de cólera en el 2012, compra en el mercado diagnosticadores comerciales, aún con sus altos precios, por lo que desarrollar pruebas que permitan el diagnóstico rápido de la enfermedad a un menor costo, constituye un reto para el país.
El Instituto Finlay es un centro que se dedica a la investigación, desarrollo y producción de vacunas, dentro de sus fortalezas se encuentra el tener experiencia en la obtención de AcM contra diferentes microrganismos, entre los que se incluye V. cholerae (17, 18).
En el año 2011, Falero y cols obtuvieron un AcM contra el LPS de V. cholerae O1 (16) con potencialidades para su uso en el diagnóstico de la enfermedad. El objetivo de este trabajo es obtener un diagnosticador rápido de cólera mediante partículas de látex que se acoplan al AcM contra LPS de V. cholerae O1.
MATERIALES Y MÉTODOS
Reactivos
Hibridoma productor de AcM anti LPS V. cholerae O1: El clon 6G1E12F10 se adquirió de la colección de hibridomas, del departamento de AcM y diagnosticadores del Instituto Finlay. Se obtuvo según Falero y cols (16).
Partículas de látex: Las partículas de poliestireno se donaron por la firma CPM SA (Italia). Son partículas de 0,8 µm de diámetro en una suspensión al 10%.
LPS de V. cholerae O1: Se purifico de la cepa C 7258 de V. cholerae O1 Ogawa por el método de fenol-agua. Presentó una concentración de 20 µg/mL.
Cepas: Se emplearon cepas de V. cholerae del serogrupo O1, biotipos Clásico y El Tor, serotipos Ogawa e Inaba. También se utilizaron cepas de V. cholerae no O1 y de varios enteropatógenos: Salmonella typhimurium, Salmonella typhi, Shigella sonnei, Shigella flexneri, Escherichia coli enterotoxigénica y Escherichia coli enteropatogénica. Todas pertenecientes a la colección de la dirección de investigaciones del Instituto Finlay.
Producción in vivo del AcM anti LPS de V. cholerae O1
Para la producción de AcM se emplearon 25 ratones BALB/c entre 18 y 20 g de peso, se les administró 0,5 mL de Pristane (Sigma) por vía intraperitoneal (ip). Siete días después se les inoculó por vía ip, las células del hibridoma 6G1E12F10 anti LPS V. cholerae O1 a una concentración de 10 6 células/mL por animal.
Entre los días 10 y 12 post-inoculación de las células, se realizó la extracción del líquido ascítico por punción por vía ip. El líquido que se extrajo se centrifugó a 1620 G y se conservó a -20ºC hasta su posterior purificación y caracterización.
Purificación y caracterización del anticuerpo monoclonal
La purificación del AcM presente en el líquido ascítico se realizó por cromatografía de afinidad, se empleó la columna Protein G Sepharose 4 Fast Flow (GE Healthcare, Germany), al seguir las recomendaciones del fabricante.
Al purificarse el AcM se procedió a su desalinización contra tampón de acoplamiento (glicina 0,1 M / NaCl 0, 17 M pH= 8,2) mediante cromatografía de exclusión molecular, se utilizó una columna empacada con Sephadex G-25M.
Para determinar la concentración de proteínas se empleó el método del ácido bicinconínico, se empleó el estuche comercial BCA TM según las recomendaciones descritas por el fabricante (Pierce, USA.). La pureza se verificó mediante una electroforesis en gel de poliacrilamida con dodecilsulfato sódico (SDS-PAGE) en condiciones reductoras. Se utilizó el gel de poliacrilamida al 12,5%.
Acoplamiento del AcM anti LPS de V. cholerae O1 a las partículas de látex
Para el proceso de acoplamiento la concentración del AcM que se utilizó fue de 0,25 mg/mL (se determinó en estudios previos) en tampón de acoplamiento. Por cada mL de AcM se añadieron 150 µL de la suspensión de partículas de látex al 10%. La mezcla se incubó 2 h a 37°C en agitación orbital. Luego se añadió albúmina de suero bovino (Sigma) como agente estabilizador y tiomersal como preservo para una concentración final de 0,2% y 0,02% respectivamente. El reactivo látex (RL) obtenido se conservó a 4°C hasta su posterior evaluación.
Por ciento de acoplamiento (%A): El por ciento de AcM que se acopló a las partículas látex se calculó mediante la fórmula: %A= ((CP I -CP L ) x 100)/CP I , donde CP I : Concentración de proteína inicial, CP L: Concentración de proteína libre, que se definió como la concentración de proteínas del sobrenadante después de centrifugado el RL.
La concentración de proteínas se determinó por el método del ácido bicinconínico descrito en el acápite purificación y caracterización del AcM.
Procedimiento de ensayo del reactivo látex obtenido
La prueba se basó en la aglutinación de las partículas de látex acopladas al AcM anti LPS de V. cholerae O1 , frente al antígeno (LPS) presente en las muestras. Para realizar la prueba de ensayo, se usó una tarjeta de aglutinación con fondo oscuro, donde se colocaron 25 µ L de LPS .
Como control negativo se aplicaron 25 µ L de solución salina fisiológica. Se añadió a cada preparación 25 µ L del RL, con el uso de un aplicador pl á stico se homogeniz ó la mezcla y se agit ó suavemente por rotaci ó n manual de la tarjeta durante 3 min. Se consider ó como resultado positivo la aparici ó n de grumos hasta 3 min de iniciada la reacción.
Evaluación de la especificidad y sensibilidad del RL
La especificidad y sensibilidad se evaluó frente a cepas de V. cholerae O1, No O1 y frente a otros enteropatógenos (Salmonella typhi, Salmonella typhimurium, Shigella sonnei, Shigella flexneri y Escherichia coli Enterotoxigénica y enteropatogénica). Estas se cultivaron en medio caldo triptona soya (BIOCEN, Cuba) a 37ºC y con agitación a 7 G.
Luego de 4 h, se tomó una muestra para la determinación de unidades formadoras de colonias (UFC) y se procedió a la inactivación de los cultivos a 56ºC durante 20 min en un baño termostatado con agitación (HAAKE SWB).
Para la evaluación de la especificidad y sensibilidad, los cultivos se ajustaron a 10 8 UFC/mL y se almacenaron a 4°C hasta su uso. Como control positivo del estudio se utilizó LPS de V. cholerae.
Sensibilidad analítica: A partir de la suspensión de 10 8 UFC/mL de los cultivos de las cepas que se mencionaron anteriormente, se prepararon diluciones seriadas 1:10 con agua.
Cada dilución se evaluó con el RL y se determinó la mayor dilución de UFC/mL en la cual se observó reacción de aglutinación.
Evaluación preliminar del desempeño del RL como diagnosticador
Muestras: Se estudiaron un total de 84 muestras de heces provenientes de pacientes en edad pediátrica con diagnóstico presuntivo de cólera, estas muestras se recibieron en el Centro Provincial de Higiene y Epidemiología de La Habana, Cuba.
Análisis de las muestras: Las muestras se analizaron mediante el RL que se obtuvo, el diagnosticador comercial CTK Biotech, USA) y el coprocultivo como prueba de referencia.
(A) Coprocultivo: Las muestras de heces se enriquecieron en agua de peptona alcalina a pH=8,9-9,1 (APA, 1% de bacto-peptona y NaCl 1%) durante 4-6 h a 37 °C. Después se tomó una asada de la superficie y se cultivó en agar tiosulfato con citrato, sales biliares y sacarosa (TCBS, Difco Laboratories, Detroit, USA). Luego de 18-24 h de incubación a 37 °C, las colonias amarillas características de V. cholerae se aislaron e identificaron mediante técnicas bioquímicas y serológicas convencionales. Se utilizó como control positivo la cepa V. cholerae O1 (VC 12) y como control negativo se utilizó la solución salina fisiológica.
(B) Diagnosticador RL: El procedimiento que se utilizó fue similar al descrito en el acápite procedimiento de ensayo del reactivo látex obtenido . En este caso se colocaron 25 µ L de la muestra de heces y 25 µ L del RL. Como control positivo de la t é cnica se us ó el LPS de V. cholerae y como control negativo se utilizó solución salina fisiológica.
(C) Diagnosticador comercial: CTK Biotech ( OnSite Cholera Ag Rapid Test , CTK Biotech, Inc ., San Diego, USA). Se empleó según las instrucciones del fabricante.
Indicadores evaluados: Se evaluó el desempeño de los dos diagnosticadores (RL y CTK Biotech), cada uno frente al coprocultivo como ensayo de referencia. Para esto se confeccionaron las tablas de contingencia 2x2 (Tabla 1) y se calculó la sensibilidad (S=(A/(A+C)) x 100%), la especificidad (E= (D/ (B+D)) x 100%) y los valores predictivos positivos (VPP=(A/(A+B)) x 100%) y negativos (VPN= (D/(C+D)) x 100%) de cada uno (19).
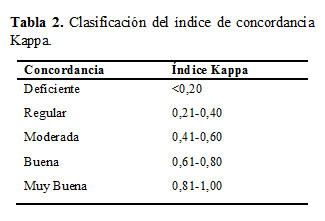
Estudio de Concordancia: Se utilizó el índice Kappa (K) para evaluar la concordancia de los diagnosticadores evaluados respecto al coprocultivo (Tabla 2) (19).
RESULTADOS
Obtención, Purificación y Caracterización del AcM anti LPS de V. cholerae O1
Se obtuvo un volumen total de 50 mL de líquido ascítico en los ratones inoculados con el hibridoma anti LPS de V. cholerae O1, equivalente a 2 mL/ratón. El líquido ascítico se purificó por cromatografía de afinidad y posteriormente se desalinizó (Fig. 1).
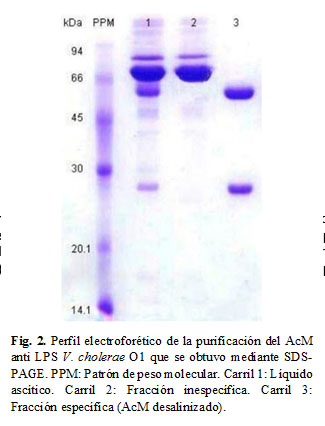
El primer pico de la cromatografía de afinidad (Fig. 1 A.I) corresponde a la fracción no retenida en la columna (contaminantes del líquido ascítico) y el segundo (Fig.1 A.II) al AcM eluido a pH=2,7. El perfil B muestra la fracción del AcM después de desalinizado contra tampón de acoplamiento, de esta forma, el AcM quedó en las condiciones adecuadas para el ensayo de acoplamiento a las partículas de látex. La concentración de proteínas totales del AcM desalinizado fue de 1,8 mg/mL y el recobrado del proceso de purificación se estimó en 1,26 mg de AcM por mL de líquido ascítico. El AcM mostró una alta pureza, lo cual se evidencia en la Figura 2, se muestra el perfil electroforético de cada una de las fracciones que se involucraron en el proceso de purificación.
El carril 1 corresponde al líquido ascítico, se observa que además de las bandas correspondientes al AcM existen otros contaminantes. El carril 2 corresponde a la fracción inespecífica, se observa la presencia exclusiva de los contaminantes, lo cual sugiere una eficiente adsorción de las inmunoglobulinas a la matriz de proteína G. El carril 3 muestra al AcM purificado, se visualizan las bandas correspondientes a las cadenas pesadas (50 kDa) y ligeras (25 kDa) de la IgG de ratón.
Acoplamiento del AcM anti LPS de V. cholerae O1 a las partículas de látex
El AcM anti LPS de V. cholera O1 se acopló a las partículas de látex mediante una metodología fácil y reproducible, obteniéndose un RL con un porcentaje de acoplamiento del 100%.
Evaluación de la especificidad y sensibilidad del RL
La sensibilidad del RL se evaluó frente a diferentes cepas V. cholerae O1 y al LPS como control positivo, mostró una alta sensibilidad, con aglutinación franca en todos los casos y con un límite de detección de 10 2 UFC/mL (Tabla 3).
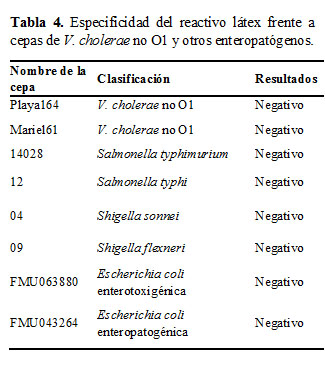
De igual forma se evaluó la especificidad del RL frente a cepas de V. cholerae no O1, y frente a otros enteropatógenos ( Salmonella Typhi, Salmonella Typhimurium, Shigella sonnei, Shigella flexneri, Escherichia coli ). Se observa en la Tabla 4, que el RL presentó una alta especificidad y no se observó reactividad cruzada en ninguno de los casos.
Desempeño preliminar del RL como diagnosticador
Se estudiaron un total de 84 muestras de heces que se analizaron con el RL y con el diagnosticador comercial CTK Biotech, se comparó cada uno frente al coprocultivo como ensayo de referencia. Para esto se confeccionaron las tablas de contingencia 2x2. La Tabla 5 muestra las tablas de contingencia para cada diagnosticador. De las 84 muestras que se analizaron con el RL como diagnosticador, se observó que 47 muestras (55,95%) resultaron positivas y 37 (44,04 %) resultaron negativas al RL, con respecto al total de muestras que se analizaron (Tabla 5A).
De estas 47 muestras positivas al RL, 46 fueron verdaderos positivos, para un VPP del 97,87 %. De las 37 muestras negativas al RL, 36 fueron verdaderos negativos para un VPN del 97,29%. Se observó un falso positivo y un falso negativo para un 1,19% respecto al total de muestras que se analizaron.
El RL como diagnosticador mostró una sensibilidad del 97,87% y una especificidad del 97,29%. De igual forma las 84 muestras se analizaron con el uso del diagnosticador comercial CTK Biotech, del total de muestras que se analizaron, 54 (64,28%) fueron positivas y 30 (35,71 %) fueron negativas al CTK (Tabla 5B).
De las 54 muestras positivas al CTK, 47 fueron verdaderos positivos, para un VPP del 87,03 % y de las 30 muestras negativas al CTK, todas fueron verdaderos negativos, para un VPN del 100%. Sin embargo, se observaron 7 falsos positivos respecto al total de muestras que se analizaron para un 8,33%. El CTK mostró una sensibilidad del 100% y una especificidad del 81,07%.
Los resultados de los indicadores para ambos diagnosticadores se muestran en la Figura 3.
Ensayo de concordancia
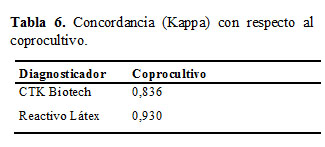
En la Tabla 6 se observa que en ambos casos, K fue superior a 0,81 lo que significa una concordancia muy buena con respecto al coprocultivo, siendo superior para el RL (19).
DISCUSIÓN
El brote de cólera que comenzó en el 2010 en Haití y que se extendió a la República Dominicana, afectó también a países de Centroamérica y del Caribe, incluyendo a Cuba (5, 6). La aparición de los primeros casos en el 2012 y la prevalencia de la enfermedad hasta la actualidad, llevó a las autoridades nacionales y regionales de salud a tomar medidas para evitar su expansión (5).
El desarrollo de métodos diagnósticos rápidos, específicos, sensibles y económicos para la detección temprana de V. cholerae O1 es de suma importancia para el tratamiento oportuno de la enfermedad y para su control epidemiológico, sobre todo si tenemos en cuenta el alto costo que implica movilizar recursos humanos y poner en marcha las medidas para frenar los brotes de cólera.
En este trabajo se presenta la obtención de un diagnosticador rápido de cólera, que se basó en un AcM contra el LPS de V. cholerae O1, desarrollado en el Instituto Finlay, el cual se acopló a partículas de látex. El RL se obtuvo por una metodología sencilla, con un 100% de acoplamiento. La funcionabilidad del mismo se basa en la aglutinación que ocurre cuando las partículas de látex acopladas al AcM reaccionan con el LPS de V. cholerae O1 presente en las muestras.
Los resultados del presente estudio muestran que el RL que se obtuvo presenta una alta sensibilidad y especificidad, no se evidenció reactividad cruzada al evaluarse frente a cepas de microorganismos productores de otras EDAs como son: Salmonella Typhi, Shigella sonnei, Shigella flexneri , y Escherichia coli.
En los estadios iniciales del cólera los episodios de diarreas son muy similares a los que se producen por otras EDAs, por lo que contar con un diagnosticador capaz de reaccionar de forma específica frente al V. cholerae O1 y discriminar entre otros enteropatógenos es un resultado de gran valor diagnóstico. Es esta una de las ventajas del uso de AcM sobre los anticuerpos policlonales, así como la afinidad por el antígeno (1), lo cual reafirma el uso de AcM como reactivos diagnósticos.
Otro de los resultados importantes lo constituye el valor de sensibilidad analítica del RL: 10 2 UFC/mL. Este valor es similar al que obtuvieron Choo y cols (18), donde usan el AcM del Instituto Finlay, pero acoplado a nanopartículas de oro, se basa en el principio de inmunocromatografía. Sin embargo, el valor de sensibilidad analítica del RL es muy superior a los que se declaran para otros diagnosticadores comerciales, como el CTK Biotech 10 5 UFC/ml, Cholera-SMART ® y PDK 10 7 UFC/mL (12). La alta sensibilidad del RL, permitirá su uso en el futuro, no solo como diagnosticador de la enfermedad, sino también como reactivo para la detección de cepas de V. cholerae O1 en muestras de agua y alimentos, las cuales constituyen las principales fuentes de infección para el humano.
Como parte del estudio también se realizó una evaluación preliminar del desempeño del RL como diagnosticador. Para esto se estudiaron un total de 84 muestra de heces provenientes de pacientes en edad pediátrica con diagnóstico presuntivo de cólera, recibidas en el Centro Provincial de Higiene y Epidemiología de La Habana, Cuba. Las muestras se analizaron con el RL que se obtuvo en este estudio y el diagnosticador comercial de CTK Biotech (USA), ambos comparativamente con el coprocultivo, como prueba de oro en el diagnóstico de la enfermedad. Se utilizó el CTK Biotech, por ser el diagnosticador que en el momento del estudio, se utiliza en los centros de salud pública de Cuba para el diagnóstico de la enfermedad. En el estudio preliminar del desempeño, el RL como diagnosticador presentó valores elevados de sensibilidad, especificidad y concordancia al compararse con el coprocultivo. Aunque con el uso d el diagnosticador comercial CTK Biotech se obtuvieron valores de sensibilidad del 100%, 7 muestras presentaron resultados falsos positivos, por lo que la especificidad, el valor predictivo positivo y la correlación con el coprocultivo fueron menores que los obtenidos con el RL.
Resultados similares declararon Choo y cols (18), donde obtuvieron un 92,95% de sensibilidad y un 100% de especificidad, con la tira reactiva al utilizar el AcM del Instituto Finlay. Otros diagnosticadores Cholera-SMART ® y PDK, en el estudio de campo que realizaron Bolaños y cols (12), mostraron valores de sensibilidad y especificidad del 100% para el SMART, mientras que el PDK presentó valores de 100% y 85,7 % respectivamente.
Conocer que el RL se puede utilizar como diagnosticador de la enfermedad es un logro, sobre todo por los valores que se alcanzaron de especificidad, sensibilidad, límite de detección y concordancia con el coprocultivo, estando a nivel de los indicadores de varios de los diagnosticadores comerciales que se utilizan a nivel mundial. Por otra parte, hay que tener en cuenta que los diagnosticadores rápidos en general y el RL en particular son pruebas que se diseñan para el tamizaje, por lo que su empleo no excluye la necesidad de realizar otras pruebas para tipificar la bacteria (serogrupo, serotipo, biotipo), identificar la toxina colérica, vigilar la resistencia a los antibióticos y realizar estudios filogenéticos, todo ello de gran importancia frente a los brotes de la enfermedad.
CONCLUSIONES
Se obtuvo un diagnosticador de cólera, su tecnología se basó en un AcM anti LPS V. cholerae O1 que se acopló a partículas de látex. El RL que se obtuvo permitirá llegar a un diagnóstico certero de cólera en poco tiempo, además no requiere de instrumental complejo, ni de personal técnico altamente calificado y tiene un desempeño satisfactorio en condiciones preliminares de campo. Los resultados demostraron que el RL tuvo valores de especificidad y sensibilidad similares a otros diagnosticadores, con posible reducción de los costos actuales del diagnóstico de la enfermedad. Permite recomendar su empleo para la vigilancia del cólera en Cuba y en áreas con escasos recursos, en las que esta enfermedad constituye un grave problema de salud pública. Sin embargo, se recomienda estudiar el desempeño a partir de protocolos aprobados por los organismos regulatorios como el Centro para el Control Estatal de los Medicamentos y Dispositivos Médicos (CECMED) y los centros evaluadores como el Instituto Pedro Kourí y el Centro Provincial de Higiene y Epidemiología, así como producir los lotes para realizar estudios de estabilidad.
AGRADECIMIENTOS
Le agradecemos a Nevis Amin, Isis Tamargo, Mabel Guerra, Daily Serrano, Osmir Cabrera, Roselín Martínez y Aleida Mandiarote, por su valiosa ayuda en la revisión y realización de este estudio.
REFERENCIAS
1. Faruque SM, Albert MJ, Mekalanos JJ. Epidemiology, genetics, and ecology of toxigenic Vibrio cholera e. Microbiol Mol Biol Rev 1998;62:1301-14.
2. Ali M, López AL, You YA, Kim YE, Sah B, Maskery B, et al. The global burden of cholera. Bull World Health Organ 2012;90(3):209-18.
3. World Health Organization (WHO). Cholera, 2012, Monthly report on dracunculiasis cases, January-May 2013. Weekly Epidemiological Record 2013;88(31):321-36.
4. Global Health Observatory (GHO). Cholera. Geneva: WHO; 2013. Disponible en: http://www.who.int/gho/ epidemic_diseases/cholera/
5. Organización Panamericana de la Salud (OPS). Actualización Epidemiológica del cólera 20 de marzo 2014. Washington, DC: OPS; 2014. Disponible en: http://www.paho.org/hq/ index.php?option=com_docman&task=doc_view&gid=24600&Itemid
6. Global Health Observatory (GHO) . Number of reported cholera cases. Geneva: WHO; 2013. Disponible en: http://www.who.int/gho/epidemic_diseases/cholera
7. Instituto Nacional de Enfermedades Infecciosas ANLIS CARLOS G. MALBRAN. III Curso Avanzado de Diagnóstico de Vibrio Cholerae y Salmonella. Buenos Aires: OMS; 2010.
8. Waldor MK, Mekalanos JJ. Lysogenic conversion by a filamentous phage encoding cholera toxin. Science 1996;272(5270):1910-4.
9. Farmer JJ, Kelly T. Enterobacteriaceae. In: Balows A, Hausler NJ, Herrmann KL, Isenberg HD, Shadomy HJ, eds. Manual of clinical microbiology. Washington, DC: ASM Press; 1991.p.360-83.
10. Holmgren J. Actions of cholera toxin and the prevention and treatment of cholera. Nature 1981;292(5822):413-7.
11. Centro para el Control y Prevención de las Enfermedades. Centro Nacional para las Enfermedades Infecciosas. Métodos de laboratorio para el diagnóstico de Vibrio cholerae . Atlanta: CDC; 1994.
12. Bolaños HM, Acuña MT, Serrano AM, Obando X, Mairena H, Cháves L, et al. Desempeño de los sistemas Cholera-SMART ® y Pathogen-Detection-Kit ® en el diagnóstico rápido del cólera. Rev Panam Salud Pública 2004;16(4):233-41.
13. Kelly MT, Hickman-Brenner FW, Farmer JJ. Vibrio. In: Balows A, Hausler NJ, Herrmann KL, Isenberg HD, Shadomy HJ, eds. Manual of clinical microbiology. Washington, DC: ASM Press; 1991.p.384-95.
14. Sinha A, SenGupta S, Ghosh S, Basu S, Sur D, Kanungo S, et al. Evaluation of a rapid dipstick test for identifying cholera cases during the outbreak Indian. J Med Res 2012;135(4):523-8.
15. Choo YY, Geik YA, Ang LC, Elina HT, Su YL, Falero G, et al. Dry-Reagent Gold Nanoparticle-Based Lateral Flow Biosensor for the Simultaneous Detection of Vibrio cholerae Serogroups O1 and O139. Journal of Microbiological Methods 2011;86(3):277-82.
16. Nato F, Boutonnier A, Rajerison M, Grosjean P, Dartevelle S, Guénolé A, et al. One-step immunochromatographic dipstick tests for rapid detection of Vibrio cholera O1 and O139 in stool samples. Clin Diagn Lab Immunol 2003;10(3):476-8.
17. Reyes F, Amín N, Otero O, Aguilar A, Cuello M, Valdés Y, et al. Four monoclonal antibodies against capsular polysaccharides of Neisseria meningitidis serogroups A, C, Y and W135: its application in identity tests. Biologicals 2013;41(4):275-8.
18. Falero G, Rodríguez BL, Rodríguez I, Campos J, Ledon T, Valle E, et al. Production and characterization of monoclonal antibodies to E1 Tor toxin co-regulated pilus of Vibrio cholerae Hybrid. Hybridomics 2003;22(5):315-20.
19. Ochoa RF. Técnicas inmunoenzimáticas en el desarrollo clínico de vacunas. La Habana: Finlay Ediciones; 2013. p.25-41.
Recibido: Octubre de 2014
Aceptado: Noviembre de 2014