Introducción
Salmonella enterica es una bacteria Gram negativa de la cual se han descrito más de 2600 serovares y muchos de estos pueden causar enfermedades tanto en humanos como en animales.1 La salmonelosis es uno de los brotes de enfermedades más frecuentes transmitidas por los alimentos en todo el mundo. Si bien la mayoría de los casos de salmonelosis son leves, algunas veces la enfermedad puede ser mortal. La gravedad de la enfermedad depende de factores propios del huésped y del serotipo de Salmonella.2 La enfermedad invasiva por Salmonella enterica se manifiesta de dos formas, fiebre entérica y enfermedad invasiva por Salmonella no tifoidea. La fiebre entérica es causada principalmente por Salmonella Typhi y S. Paratyphi A y la enfermedad invasiva por Salmonella no tifoidea principalmente por S. Typhimurium y S. Enteritidis, siendo los niños menores de 2 años e individuos infectados por el virus de la inmunodeficiencia humana (VIH) los grupos de mayor riesgo.3
En los últimos años, el desarrollo de la resistencia a los antimicrobianos entre los patógenos transmitidos por los alimentos, como Salmonella enterica, se ha asociado con un mayor número de muertes humanas, mayor duración de la estancia hospitalaria y altos costos de tratamiento debido al fracaso de la terapia.4,5 La incidencia global de este microorganismo se estima en 93,8 millones de casos por año, incluidas 155.000 muertes por enfermedad diarreica y 690.000 muertes por enfermedad invasiva.6,7 Aunque las vacunas para la fiebre tifoidea se han desarrollado y utilizado durante décadas, las vacunas para la fiebre paratifoidea, S. Typhimurium y S. Enteritidis están en estudio y aún no han sido licenciadas.8
Este trabajo tiene como objetivo evaluar, mediante Western blot, la reactividad de los sueros de ratones inmunizados con formulaciones basadas en VME derivadas de Salmonella Paratyphi A, Salmonella Enteritidis y Salmonella Typhimurium, contra los respectivos lisados celulares, para identificar la formulación que induce la mejor respuesta inmunológica cruzada.
Materiales y Métodos
Cepas y condiciones de cultivo
S. Enteritidis (Donado por el Departamento de Microbiología del Instituto de Medicina Tropical Pedro Kouri, La Habana, Cuba), S. Typhimurium (Donado por el Departamento de Biología Molecular del Instituto de Biotecnología de la Universidad Nacional Autónoma de México, México), S. Paratyphi A (Donado por el Instituto de Investigación en Medicina Molecular, Health Campus University Sains Malaysia, 16150 KubangKerian, Kelantan, Malasia).
Todas las cepas se cultivaron en caldo CASO (Merck) a 37°C y 200 rpm (RFI-125 Inkubator, Infors AG, Bottmigen, Basilea, Suiza) durante 6 h.
Preparaciones VME
Los sedimentos celulares obtenidos después de la centrifugación (33.000 x g durante 30 min) de cada cultivo bacteriano, se homogeneizaron con tampón Tris 200 mM, que contenía EDTA 2 mM, pH 8,5 a 100-200 mg/mL. Luego, se añadió desoxicolato de sodio (Merck, RFA), preparado al 10%, en una proporción de 0,1-1 mL/g de biomasa bacteriana. La mezcla se incubó durante 2 h y se centrifugó a 33.000 x g durante 30 min. Todos los sobrenadantes se recogieron, se sometieron a una secuencia de procesos de micro y ultrafiltración y finalmente se filtraron usando una unidad Sartorius Minisart-plus de 0,2 μm (Sartorius Stedim Biotech GmbH, Alemania). La VME obtenida se almacenó a 4°C hasta su posterior uso.
Obtención de sueros anti-VME
Para la obtención de los sueros anti-VME se emplearon ratones BALB/c (hembras, 3-4 semanas, 12-14 g), procedentes del Centro de Producción de Animales de Laboratorios (CENPALAB, La Habana, Cuba), los cuales permanecieron bajo condiciones controladas de temperatura (21-24˚C), humedad (20-25%), ciclos alternados de luz/oscuridad de 12 h, y recibieron alimentación y agua acidulada con HCl a un pH de 2,5 ad libitum. La manipulación de estos animales se realizó de acuerdo a las normas institucionales establecidas.
Los animales fueron distribuidos en cuatro grupos de 10 ratones cada uno. Los grupos 1, 2 y 3 fueron inmunizados con VME derivada de S. Paratyphi A, S. Typhimurium y S. Enteritidis, respectivamente. Todos los ratones recibieron dos dosis de 20 μg de VME y 0,25 mg de hidróxido de aluminio por vía subcutánea (125 µL), espaciadas a 21 días de intervalo entre una y otra. El grupo 4 fue considerado Placebo y se le administró solución salina (NaCl 0,9%) e hidróxido de aluminio. Todos los ratones fueron desangrados 21 días después de la última dosis y se extrajeron los sueros respectivos. Posteriormente se evaluaron los sueros mediante un ELISA indirecto y se seleccionaron los sueros de los ratones con títulos de anticuerpos superiores a 1/1.000. Se obtuvo una mezcla a partir de los sueros seleccionados y se almacenó a -20˚C hasta su uso.
Obtención de lisados celulares
Para la obtención de los lisados celulares se cultivaron las cepas en Agar Triptona Soya y se incubaron a 37ºC durante 18 h. Luego las células se recogieron con la ayuda de un hisopo estéril y se resuspendieron en solución salina tamponada con fosfato (PBS: NaCl, KCl, KH2PO4 y Na2HPO4, pH 7,4). La suspensión celular resultante se ajustó a una densidad óptica de 0,8 unidades a (=530 nm y se centrifugó a 1.500 rpm durante 30 min en una centrífuga de mesa refrigerada (Centrifuge 5415 D, Eppendorf). Se desechó el sobrenadante y el sedimento obtenido se resuspendió, a razón de 0,5 mg/µL, en tampón de lisis (Tris, NaCl, desoxicolato de sodio al 1%, pH 7,4).
Electroforesis
Para la evaluación del perfil electroforético de las VME obtenidas, así como de los lisados celulares, se realizó una electroforesis en gel de poliacrilamida con dodecilsulfato sódico (SDS-PAGE, de sus siglas en inglés: sodium dodecyl sulfate polyacrylamide gel electrophoresis) como lo describió Laemmli.9 Las muestras correspondientes a las VME se ajustaron previamente a 1 mg/mL y los lisados, ajustados previamente por densidad óptica, se usaron puros; en ambos casos se aplicó 10 μL por pozo en el gel de poliacrilamida 12,5%. La corrida electroforética se realizó a un amperaje constante (35 mA). Las bandas fueron reveladas mediante tinción con Coomassie.
Western Blot
Se utilizaron sueros anti VME- S. Paratyphi A, anti VME- S. Typhimurium y anti VME- S. Enteritidis. El procedimiento se realizó como lo describió Burnett.10 Las preparaciones (lisados celulares de S. Paratyphi A, S. Typhimurium y S. Enteritidis) se aplicaron a 10 μL por pozo, por triplicado, en una electroforesis en SDS-PAGE.9 Posteriormente los antígenos se transfirieron a un papel de nitrocelulosa, los perfiles electroforéticos transferidos se independizaron y se incubaron con los sueros anti-VME en cubetas independientes. Tras bloqueo de la membrana se añadió anti-IgG de ratón conjugada a peroxidasa (Sigma Chemical Co., St. Louis, MO) a una dilución 1:5000. Para el revelado se utilizó Diaminobencidina/Peróxido de Hidrógeno, hasta la aparición de las manchas. La reacción se detuvo con agua destilada.
Resultados y Discusión
Para evaluar la reactividad de los sueros de ratones inmunizados con VME derivadas de Salmonella Paratyphi A, Salmonella Enteritidis y Salmonella Typhimurium contra los respectivos lisados celulares, la primera tarea consistió en obtener las VME y con ello evaluar el perfil electroforético de cada una. La Figura 1 muestra el perfil de proteínas, obtenidos en el SDS-PAGE, de cada una de las VME derivadas de las cepas de Salmonella.
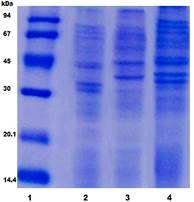
Fig. 1 Perfil de proteínas de cada VME derivada de las cepas de Salmonella obtenido en el SDS-PAGE (12,5% de acrilamida). Línea 1: PPM, Línea 2: VME-S. Paratyphi A, Línea 3: VME- S. Enteritidis, Línea 4: VME-S. Typhimurium.
En los perfiles correspondientes a VME- S. Paratyphi A y VME-S. Enteritidis, se observan bandas de proteínas ubicadas principalmente entre 30 y 100 kDa. En el caso de la VME-S. ParatyphiA destacan cuatro bandas de proteínas (dos bandas cercanas a 30 kDa y otras dos cercanas a 45 kDa). En el perfil de la VME-S. Enteritidis destacan tres bandas (una entre 30 y 45 kDa, una cercana a 45 kDa y otra por encima de 94 kDa). Mientras que en el perfil proteico correspondiente a la VME-S. Typhimurium se observan nueve bandas de mayor intensidad ubicadas entre 30 y 100 kDa, que al igual que en la VME-S. Paratyphi A, se observan dos bandas cercanas a 30 kDa y otras dos cercanas a 45 kDa.
Los perfiles proteicos que arrojaron estos resultados muestran cierta similitud con los anteriormente descritos para VME de bacterias Gram negativas, donde en su mayoría se encuentran ubicados entre 15 y 100 kDa. En el caso específico de Salmonella, solo se han descrito estudios en VME nativas, lo cual impone una diferencia en cuanto a las proteínas presentes en esta y a su tamaño molecular, por lo que no son comparables en cuanto a su perfil de proteínas.11,12
Una vez obtenido el pool de los sueros de los ratones inmunizados con las diferentes VME se evaluó la reactividad frente a los lisados celulares mediante Western blot. La Figura 2 muestra el perfil electroforético de los lisados teñidos con Coomassie, así como los perfiles una vez enfrentados a cada suero.

Fig 2 . SDS-PAGE de los lisados celulares (A): Línea 1: Lisado celular de S. Paratyphi A, Línea 2: Lisado celular de S. Enteritidis, Línea 3: Lisado celular de S. Typhimurium. Western blot de los lisados celulares enfrentados a: suero Anti-VME-S. Paratyphi A (B), suero Anti-VME-S. Enteritidis (C) y suero Anti-VME-S. Typhimurium (D). En todos los casos la Línea 1 corresponde a: Lisado celular de S. Paratyphi A, Línea 2: Lisado celular de S. Enteritidis, Línea 3: Lisado celular de S. Typhimurium, Línea 4: PBS y Línea 5: PPM.
La Figura 2 A muestra la corrida electroforética de los lisados celulares cuando fueron aplicados en un SDS-PAGE y revelados con tinción de Coomassie. En la misma se observa un gran número de bandas que van desde los 10 hasta los 100 kDa, donde de manera cualitativa se puede decir que las más intensas se ubican entre 30 y 100 kDa. En todos los perfiles se observan dos bandas cercanas a los 30 kDa, dos cercanas a los 45 kDa, dos sobre los 67 kDa y tres sobre los 94 kDa, las cuales son más intensas que el resto. Mientras que el perfil proteico correspondiente al lisado celular de S. Typhimurium muestra una banda entre los 67 y 94 kDa.
Por otra parte, la Figura 2 B, C y D muestran los resultados obtenidos cuando los lisados celulares fueron transferidos a un papel de nitrocelulosa y enfrentados a los diferentes sueros de anti-VME de Salmonella. El análisis cualitativo realizado muestra una alta reactividad de todos los sueros frente a los lisados celulares, lo cual impide establecer diferencias en cuanto a la reactividad de los mismos. Esto sugiere que entre estas cepas existe una gran cantidad de antígenos muy similares estructuralmente que pudieran ser conservados entre ellas, lo que sin duda favorece el diseño y la concepción de un candidato vacunal basado en VME capaz de inducir una respuesta inmune cruzada.
En la Figura 2 B, cuando el lisado fue enfrentado al suero anti-VME S. Paratyphi A, se observa una banda cercana a los 30 kDa la cual es similar para los tres lisados, así como tres bandas sobre los 45 kDa y dos bandas sobre los 94 kDa que no son muy intensas. En el caso de S. Typhimurium hay una banda entre los 30 y 45 kDa.
Por otra parte, en la Figura 2 C se observan bandas sobre los 30 kDa, lo cual difiere entre los lisados, ya que S. Paratyphi A y S. Typhimurium muestras dos bandas intensas y S. Enteritidis solo una. En la misma figura también se observa una banda marcada por debajo de los 45 kDa que es similar para todos los lisados. Se observan, además, una banda en los 45 kDa en los tres lisados y en el caso de S. Enteritidis se muestran dos. Tanto en los 67 kDa como por encima de los 97 kDa se observa una banda en los tres casos.
En la Figura 2 D se observan perfiles similares a los anteriormente descritos, donde las bandas más intensas se ubican sobre los mismos pesos moleculares. En los tres lisados se observan dos
bandas cercanas a los 30 kDa y una por debajo de los 45 kDa. Se observan dos bandas, aunque no muy intensas, en las líneas correspondientes a S. Paratyphi A y S. Enteritidis, y solo una en el caso de S. Typhimurium, todas en los 45 kDa. Para los tres lisados se observan bandas sobre los 97 kDa.
De manera general, algunas de las bandas marcadas corresponden a las identificadas como bandas de proteínas de mayor intensidad en la Figura 1, además de identificarse bandas que no habían sido relevadas. Aparentemente también hubo reconocimiento contra las bandas que podrían corresponder al Lipopolisacárido en cada caso (bandas cercanas a los 14 kDa).
Las bandas de reconocimiento, obtenidas en el Western blot, con pesos moleculares entre los 30 y 60 kDa se corresponden con lo reportado por varios autores que plantean que proteínas como Tol C (55 kDa), nmpC (39,6 kDa), FadL (47,6 kDa), FimH (35 kDa) y la porinas (34-40 kDa) pueden ser empleadas como antígenos vacunales contra Salmonella enterica mostrando resultados satisfactorios.11,13,14,15
Por otro lado, las VME de las bacterias Gram negativas han mostrado ser reactivas frente a cepas heterólogas en diversas investigaciones. Un estudio realizado por Liu y colaboradores demuestra la capacidad protectora de una VME nativa de Salmonella Typhimurium frente a diferentes cepas de Salmonella.16
Estos resultados indican el camino a seguir, pero deben considerarse como resultados preliminares. Se deben realizar estudios de inmunogenicidad en ratones con las VME, seguidos de ensayos de reto letales o subletales con cepas de Salmonella homólogas y heterólogas.
Conclusiones
Estos resultados sugieren que las VME están compuestas por antígenos posiblemente conservados en los tres serotipos de Salmonella (S. Paratyphi A, S. Enteritidis y S. Typhimurium) incluidos en este estudio y que potencialmente pueden inducir una respuesta inmune de amplio espectro y protección cruzada. En tal sentido, se debe continuar con los ensayos respectivos para seguir evaluando las VME como posibles candidatos para la preparación de vacunas frente a Salmonella.














