INTRODUCCIÓN
Los estafilococos son responsables de más del 80 % de las enfermedades supurativas que se encuentran en la práctica médica, provocan la mayoría de las infecciones de la piel, pero pueden invadir y producir infecciones severas en cualquier otra parte del cuerpo. Se encuentran entre las bacterias patógenas más versátiles y exitosas; aunque se han introducido numerosos antibióticos anti-estafilocócicos, el control de las infecciones continúa siendo un importante problema médico, debido al rápido desarrollo de resistencia a los antibióticos.1,2
La infección de la piel por estafilococo es la más común de todas las infecciones bacterianas en el hombre. La forma superficial de esta es la foliculitis, en la cual se observa una infección del folículo piloso. Una extensión hacia el tejido subcutáneo da como resultado la formación de una lesión supurativa local llamada forúnculo. Aproximadamente el 20 % de los pacientes con forúnculo presentan una o más recidivas durante el año siguiente y cierto número presenta forunculosis recidivante crónica durante meses o años.1
El Staphylococcus aureus (S. aureus) es un germen comensal y es comúnmente parte de la flora microbiana normal en fosas nasales, sujeto a mecanismos de tolerancia en estas localizaciones anatómicas no causan ningún tipo de enfermedad aparente.3 No obstante, produce gran número de factores de virulencia como toxinas que pueden contribuir a su patogenicidad, lo cual contribuye a que la respuesta inmunitaria contra este germen sea inadecuada, ya que una infección primaria no protege al individuo contra la reinfección. Las cepas de Staphylococcus aureus que tienen cápsula generan anticuerpos protectores, pero estas cepas no son patógenas. Se ha demostrado que los pacientes que desarrollan formas graves de infección tienen bajos niveles de IgG y que los que desarrollan mejor mecanismo de respuesta poseen valores adecuados de este anticuerpo, los pacientes portadores de robustos mecanismos de memoria inmune al S. aureus poseen mecanismos de protección a complicaciones serias de la invasión bacteriana.4
La identificación de condiciones genéticas que predisponen a las infecciones por S. aureus revelan nuevas interioridades de la respuesta inmune, con especial relevancia las de la piel; pacientes que sufren de infecciones cutáneas recurrentes severas poseen limitaciones con la expresión y función del receptor de IL-1 (IL-1R), señalización de Toll-like receptor (TLR) (como resultado de diferenciación mieloide primaria de proteína 88 (MYD88) o ambas, la deficiencia de IL-1R-asociado a kinasa 4 (IRAK4) y la depresión de respuesta de células T cooperadoras 17 (TH17 cell), que trae como resultado el síndrome de hyper-IgE y su alta predisposición a las infecciones por S. aureus.2,5
Los informes de infecciones por S. aureus en el mundo se han incrementado; se sospecha que las condiciones que propician las epidemias son multicausales y para el estudio del fenómeno se deben contemplar aspectos inherentes al medio ambiente, al germen y al hospedero. La caracterización del patrón de respuesta inmune Th1-Th2, según subclases de IgG, y valores de IgE expresado en pacientes y controles, es nuestro propósito. No siempre la alergia es consecuencia de la IgE y muchas reacciones alérgicas se desarrollan en ausencia de alergenos. La IgG4 tiene un papel fundamental en los mecanismos naturales de control de la atopia y es el camino favorable que puede tener la inmunoterapia contra las alergias.
MÉTODOS
Se realizó un estudio analítico transversal conformado por dos grupos de 25 individuos cada uno.
El primer grupo estuvo integrado por 25 pacientes, de cualquier edad, remitidos a consulta de Inmunología por los especialistas de sus áreas de salud, por presentar lesiones cutáneas recidivantes y rebeldes al tratamiento, en las cuales se había hecho el aislamiento previo de S. aureus. El segundo grupo fue conformado por 25 individuos supuestamente sanos, cuya muestra fue proveniente del banco de sangre.
A todos los pacientes se les indicó la toma de muestra de suero, para la determinación de las subclases de inmunoglobulina G (IgG) y los niveles de IgE. La toma de muestra se realizó en ayunas, y se les extrajo 5 ml de sangre en tubo seco, la cual posteriormente se separó y decantó por centrifugación, para obtener (1,5ml) de suero, que fue alicuotado y congelado a - 400C, y luego enviado al Instituto Carlos J. Finlay, para la realización del ELISA.
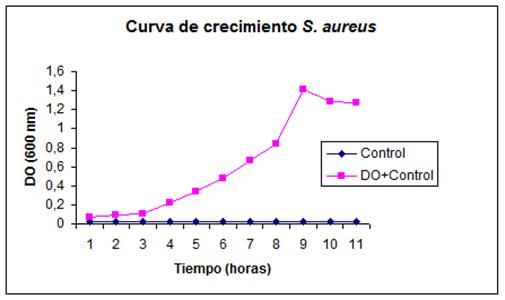
Se elaboró un antígeno (Bacterina de S. aureus), con la aplicación de los parámetros básicos para el cultivo de las cepas estándar,6,7 para lo que se utilizó como medio de cultivo el agar Mueller Hinton (DIFCO), caldo B.H.l (Infusión-cerebro-corazón), para la estandarización de la curva de crecimiento de las cepas patrón de S. aureus. (Figura 1)
Se procedió con la metodología de normalización y validación de ensayos inmunoenzimáticos para cuantificar IgG humana.8
Los resultados se expresaron en densidad óptica (DO), y gráficamente con la relación matemática (IgG1/3) para Th1 e (IgE/IgG4) para Th2, en el suero de los pacientes.9
Para el análisis estadístico de los resultados del trabajo se utilizó una microcomputadora Acer Intel Pentium, en la que se instaló el paquete estadístico Prisma, oficializado por la Sociedad Cubana de Inmunología. Se utilizó una base de datos, confeccionada a partir de los resultados obtenidos en el presente estudio, para obtener los gráficos que ilustran el comportamiento de cada una de las variables estudiadas. Previo a la comparación de las variables, según grupo, se analizó la normalidad de los datos mediante la prueba de Shapiro Wilk, al no existir esta se utilizó la alternativa no paramétrica U de Mann-Witney, para explorar diferencias en el rango medio de las variables.
RESULTADOS
Se obtuvo respuesta IgE anti S. aureus en pacientes.
A esta longitud de onda (405nm), la lectura del equipo ELISA evidenció una mayor dispersión en los pacientes, que fueron altamente significativos respecto al grupo control. (Figura 2)
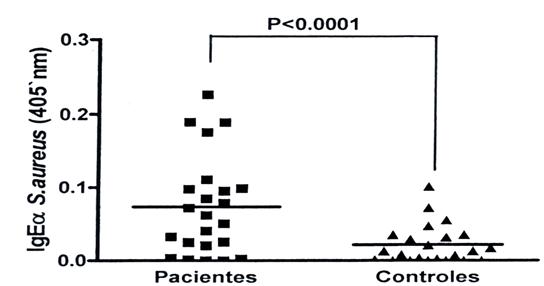
Figura 2 Densidad óptica (DO) de la lectura del anti-suero IgE anti S. áureus de las muestras de pacientes
Se obtuvo respuesta IgG1 e IgG4 en pacientes y controles.
A esta longitud de onda, la lectura del equipo ELISA, evidenció una mayor dispersión en los controles negativos, tanto para los anti-sueros de IgG1 como IgG4, que fueron altamente significativos en ambos casos. (Figura 3)

Figura 3 Densidad óptica (DO) de la lectura del anti-suero IgG1 e IgG4 anti S. áureus de las muestras de pacientes y controles negativos.
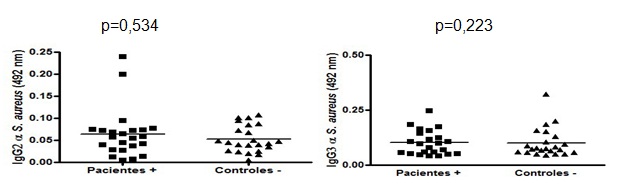
No se obtuvo respuesta IgG2 e IgG3 en pacientes y controles.
No hubo significación en cuanto al valor de la DO determinada al analizar los anti-sueros IgG2 e IgG3 anti S. áureus, en ninguno de los grupos estudiados. (Figura 4)
DISCUSIÓN
Respuesta IgE anti S. aureus
La literatura consultada sobre la temática es bastante escasa, no obstante, la predisposición del individuo alérgico a padecer infecciones por Staphylococcus aureus en cualquier forma de presentación, está ampliamente descrita por Isabella Núñez y col.,10 en su artículo Staphylococcus aureus y alergias. ¿Mito o realidad? y coincide con nuestros resultados, donde se obtuvo una evidente respuesta IgE anti-estafilocóccica en el grupo de pacientes enfermos. Aunque no se controló la variable Nivel de predisposición alérgica en los datos primarios de la investigación, se conoce que un porcentaje elevado de los pacientes enfermos presentan algún grado de atopia, y al enfrentarse a determinado antígeno, activan la respuesta del patrón Th2, con una consecuente elevación de los niveles de IgE, lo que trae consigo una respuesta inmune alérgica.11 Por su parte, los pacientes sanos no desarrollaron una respuesta Th2 evidente ante el contacto con el antígeno, por lo que sus niveles de IgE se mantuvieron estables, esto se debe a que el S. aureus es un componente normal de la biota de la piel, y estos pacientes ya han estado previamente expuestos al antígeno estafilocóccico, y no reaccionan ante él, a menos que la piel, como primera barrera de defensa, se vea comprometida, y en este caso el propio sistema inmune desarrolla mecanismos de defensa inducidos por el patrón de respuesta Th1, en lugar de un cuadro alérgico mediado por el patrón Th2. Tal vez como la población cubana tiene un alto sustrato alérgico, este sea uno de los factores más importantes que coadyuven a la alta expresión de dicho patrón. Se ha demostrado que las células Th17 participan de manera importante en el desarrollo de varias enfermedades alérgicas, las cuales de manera clásica se habían considerado inducidas por las células Th1 y Th2. El S. aureus es capaz de activar a la IL-17 en las células dendríticas y en los monocitos,13 14 cuyo papel es fundamental en el reclutamiento de neutrófilos y en la defensa del organismo contra las infecciones cutáneas por S. aureus, por lo que la deficiencia de Th17 pudiera explicar el incremento de la susceptibilidad de los pacientes con síndrome de hiper-IgE y otras dermatologías atópicas, a padecer una infección por S. aureus.12
Respuesta IgG1 e IgG4 en pacientes y controles
Nuestros resultados indican que el grupo control ha estado previamente expuesto al S. aureus, ya que este microrganismo forma parte de la biota de la piel y, por tanto, ha desarrollado una respuesta hacia el patrón Th1 (IgG1), y anticuerpos bloqueadores (IgG4), probablemente como resultado de una prolongada estimulación antigénica, con lo que controla la entrada y colonización de la bacteria. Por el contrario, los pacientes enfermos desarrollaron una respuesta Th2, con una consecuente producción de IgE, y la infección. Nuestros resultados coinciden con Lucas,14 quien plantea que predominan las subclases IgG1 e IgG4 como respuesta a gran variedad de alergenos. Estos patrones son reproducibles entre individuos normales y atópicos, que han sido inmunizados de manera terapéutica o natural (previa exposición al estafilococo en la piel). Nuestros resultados también coinciden con los obtenidos por Monteil y col.,15 donde el nivel de IgG1 fue significativamente alto en pacientes atópicos con infecciones por S. aureus, a pesar de que nuestro estudio se basó en una muestra heterogénea de pacientes atópicos y sanos. Por otra parte, Ashbee y col.,16 en su estudio sobre las subclases de IgG específicas contra S. epidermidis y Propionibacterium acnes en pacientes con acné vulgaris, no obtuvieron una respuesta significativa ante esta especie de estafilococo, cuyos niveles de las subclases de IgG se mantuvieron en el mismo rango y no difirieron entre grupos, lo que evidenció una baja patogenicidad del S. epidermidis en esta enfermedad, aunque sí obtuvieron diferencias significativas en los niveles de IgG anti-P. acnes, donde la IgG1 fue significativamente alta, lo que puede deberse a la alta concentración de esta subclase en suero, así como a la sensibilidad de los pacientes con un estado severo de la enfermedad. La respuesta IgG4 se considera indicativa de exposición repetida o por largo tiempo a un antígeno. En un estudio realizado a portadores nasales, sanos, sanos no portadores e infectados en varias localizaciones, de varios países, se encontró respuesta IgG1 y también IgG4, pero con una alta variabilidad inter casos, y el tipo de infección o la localización geográfica no revelaron un patrón de defensa conservado.16,17
Respuesta IgG2 e IgG3 en pacientes y controles
De acuerdo a lo planteado por Timon y col., la respuesta IgG3 ha sido asociada con mecanismos de control y protección contra bacterias, virus y parásitos intracelulares y es un potente mediador de funciones efectoras, tales como: La citotoxicidad mediada por células (ADCC), opsonofagocitosis, activación de complemento y neutralización. Posee características que la distinguen del resto de las subclases de IgG: región de la bisagra alargada, gran polimorfismo, flexibilidad molecular y sitios adicionales de glicosilación, por lo que es muy promisorio para ser usado en la fabricación de vacunas contra estas infecciones.18
Las subclases IgG3 son ricas en anticuerpos contra proteínas, tales como las toxinas producidas por las bacterias de la difteria y el tétanos, así como anticuerpos contra proteínas virales. En contraste, los anticuerpos contra el revestimiento (cápsula) de polisacáridos (azúcares complejos) de algunas bacterias que causan enfermedades (e.g. neumococo y Haemophilus influenzae) son predominantemente del tipo IgG2.19 La IgG2 posee propiedades terapéuticas diferentes de la IgG1, IgG3 e IgG4. La IgG2 es la segunda subclase de IgG más abundante, con capacidad de unión a receptores FcγRII/FcγRIII, pero no al FcγRI o receptor C1q del complemento.20
Nuestro estudio no arrojó diferencias significativas entre los pacientes y el grupo control. La subclase IgG3, a pesar de ser frecuente en la respuesta ante antígenos proteicos, presenta baja afinidad por la proteína A (SpA). Por otra parte, la superficie de la bacteria se encuentra recubierta por una cápsula de polisacárido, que por lo general posee escasa concentración de proteínas y péptidos pequeños, lo que podría explicar la poca activación de esta subclase frente a una infección por S. aureus.
CONCLUSIONES
La caracterización del patrón de respuesta inmune Th1-Th2, según subclases de IgG, y valores de IgE en pacientes y controles, mostró respuesta IgG1 e IgG4 en ambos grupos, se obtuvo respuesta IgE anti S. aureus en pacientes y no se obtuvo respuesta IgG2 e IgG3 ni en pacientes ni controles, lo que es indicativo de una evidente respuesta IgE anti-estafilocóccica en el grupo de pacientes enfermos, si bien se debe continuar profundizando en la temática