Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.25 no.2 Ciudad de la Habana Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Infección de las vías urinarias: prevalencia, sensibilidad antimicrobiana y factores de riesgo asociados en pacientes con diabetes mellitus tipo 2
Urinary tract infection: prevalence, antimicrobial resistance and associated risk factors in type 2 diabetes mellitus patients
MSc. Alberto González Pedraza Avilés,I QBP. Rocío Dávila Mendoza,I Dr. Oscar Acevedo Giles,II Enfermera María Elena Ramírez Martínez,II Dra. Saret Gilbaja Velázquez,II QFB. Claudia Valencia Gómez,II Tec. Lourdes Cruz Zamora,II Enfermera Araceli Iriarte MolinaII
IDivisión de Estudios de Posgrado. Facultad de Medicina de la Universidad Nacional Autónoma de México (UNAM). México DF, México.
IIClínica de Medicina Familiar "Dr. Ignacio Chávez". Instituto de Seguridad y Servicios Sociales para Trabajadores del Estado (ISSSTE). México DF, México.
RESUMEN
Objetivos: determinar la prevalencia de infección de vías urinarias, la sensibilidad antimicrobiana y los factores de riesgo asociados en pacientes con diabetes mellitus tipo 2.
Métodos: estudio descriptivo, transversal y prospectivo, a 300 pacientes con diagnóstico de diabetes mellitus tipo 2, seleccionados mediante muestreo no probabilístico. Se aplicó ficha de identificación, y se realizó diagnóstico clínico y microbiológico de infección de vías urinarias. El análisis estadístico se realizó a través de razón de momios, intervalos de confianza y chi cuadrado, con el programa estadístico SPSS versión 17.
Resultados: el porcentaje total de infección de vías urinarias fue de 17 %, y se presentó 12,5 % de bacteriuria asintomática y 38,4 % de bacteriuria sintomática (p= 0,000; OR= 4,38; IC 95 % 2,09-8,99). Se obtuvo una prevalencia de infección de vías urinarias de 6,5 % para hombres y 22,8 % para mujeres (p= 0,000; OR= 4,22; IC 95 % 1,78-11,51). Escherichia coli se aisló en 68,6 %, seguido de Klebsiella spp. en 13,7 %. En relación con la sensibilidad a los antibióticos, E. coli presentó 74,3 % de resistencia a la ciprofloxacina y 68,6 % a la ampicilina.
Conclusiones: E. coli y Klebsiella spp. fueron las bacterias de mayor prevalencia, con porcentajes altos de resistencia a la ampicilina y la cefalosporina, 2 de los antimicrobianos mayormente utilizados en estos procesos. De los factores de riesgo analizados, solo el sexo se asoció a infección de vías urinarias en el paciente diabético.
Palabras clave: infección de vías urinarias, diabetes mellitus, factores de riesgo, bacteriuria sintomática, bacteriuria asintomática.
ABSTRACT
Objectives: to determine the prevalence of urinary tract infection, antimicrobial resistance and associated risk factors in type 2 diabetes mellitus patients.
Methods: prospective, descriptive and cross-sectional study conducted in 300 patients diagnosed with type 2 diabetes mellitus and selected by non-probabilistic sampling. The identification card was used and the clinical and microbiological diagnosis of urinary tract infection was performed. The statistical analysis used the SPSS statistical program version 17 through the odds ratio, the confidence intervals and the chi square test.
Results: total percentage of urinary tract infection was 17 %, asymptomatic bacteriuria reached 12.5 % and symptomatic 38.4 % (p= 0.000; OR= 4.38; IC 95 % 2.09-8.99). The prevalence of urinary tract infection was 6.5 % for men and 22.8 % for women (p= 0.000; OR= 4.22; IC 95 % 1.78-11.51). Escherichia coli was isolated in 68.6 % of cases, followed by Klebsiella spp. in 13.7 %. Regarding the antimicrobial resistance, E. coli exhibited 74.3 % resistance to ciprofloxacin and 68.6 % to ampicillin.
Conclusions: E. coli and Klebsiella spp. were the preponderant bacteria with high percentages of resistance to ampicillin and to cephalosporin, two of the mostly used antimicrobials to control these processes. Sex was the only risk factor associated to urinary tract infection in the diabetic patient.
Keywords: urinary tract infection, diabetes mellitus, risk factor, symptomatic bacteriuria, asymptomatic bacteriuria.
INTRODUCCIÓN
Las infecciones de vías urinarias (IVU), en pacientes con diabetes pueden ocasionar complicaciones graves como la bacteremia, la necrosis papilar, el absceso perinefrítico, la cistitis o las pielonefritis enfisematosas.1 Entre los factores de riesgo que favorecen la mayor incidencia de infecciones del tracto urinario en pacientes con diabetes se han mencionado el sexo, la glucosuria, la edad avanzada, la disfunción inmune y la mayor adhesividad del epitelio urinario a las fimbrias tipo 1 de E. coli.2
Debido a que la etiología de la cistitis es predecible y el espectro antimicrobiano conocido, se ha aceptado su tratamiento de manera empírica.3 En los sujetos diabéticos el tratamiento debe prescribirse por 7 a 14 días y no están indicados los esquemas cortos. La combinación de trimetoprimsulfametoxazol (TMP-SMX) ha sido por mucho tiempo el tratamiento de primera elección, debido a su espectro antimicrobiano, su toxicidad baja, y su costo.4 Otros medicamentos recomendados para el tratamiento de la cistitis han sido la ciprofloxacina y la nitrofurantoína. El TMP-SMX y la ciprofloxacina alcanzan niveles altos no solamente en la orina, sino en los tejidos del tracto urinario, por lo que se han preferido en pacientes diabéticos.5
Sin embargo, en la última década se ha observado en diversos países un aumento en la resistencia de cepas de E. coli y Klebsiella spp. a TMP-SMX y a cefalosporinas de tercera y cuarta generación.6 Yeshitela y otros, reportan que más del 60 % de sus aislamientos bacterianos fueron resistentes a la ampicilina, TMP-SMX y a la tetraciclina.7 Boroumand y otros, en un estudio desarrollado en Irán en mujeres diabéticas, obtuvieron una alta resistencia al co-trimoxasol, al ácido nalidíxico y la ciprofloxacina en la mayoría de los microorganismos aislados.8
Por lo anterior, autores como Guillausseau y otros,9 mencionan que el tratamiento antibiótico sistémico para estos pacientes es obligatorio, y que la búsqueda intencionada de IVU y la determinación de sus patrones de sensibilidad antimicrobiana, deben realizarse, al menos, una vez al año.
Los objetivos de este estudio fueron determinar la prevalencia de la IVU, identificar los factores de riesgo asociados, determinar el agente etiológico y evaluar la susceptibilidad antimicrobiana, en una población de pacientes con diabetes mellitus (DM) tipo 2.
MÉTODOS
Se realizó un estudio descriptivo, transversal y prospectivo en el módulo de diabetes de la Clínica de Medicina Familiar (CMF) "Dr. Ignacio Chávez", del ISSSTE, en Ciudad de México. El muestreo fue no probabilístico por conveniencia en pacientes con diagnóstico de DM 2, que aceptaron participar en el estudio mediante la firma del consentimiento informado. El cálculo del tamaño de la muestra para estudios descriptivos fue con nivel de confianza de 95 % y error de 0,06 (N= 266).
Se aplicó una ficha de identificación y registro, para obtener datos como: el sexo, la edad, el tiempo de diagnóstico, el valor de hemoglobina glucosilada y la presencia de sintomatología urinaria. Se consideró paciente controlado, aquel que presentó un valor de hemoglobina glucosilada menor a 7 %. El diagnóstico clínico de IVU sintomática se consideró con la presencia de disuria, y uno o más de los síntomas siguientes: poliuria, tenesmo y/o urgencia. El diagnóstico microbiológico se realizó por urocultivo, mientras que el aislamiento, la identificación bacteriana y las pruebas de susceptibilidad, se realizaron según estándares establecidos, utilizando para ello el aparato Auto SCAN-4 DADE BEHRING, West Sacramento, California, EE.UU. Se evaluó la susceptibilidad antimicrobiana a los antibióticos siguientes: ampicilina, ciprofloxacina, trimetoprim-sulfametoxazol, ceftriaxona, ceftazidima y cefuroxima.
Se calculó odds ratio o razón de momios, con intervalos de confianza al 95 %. Se realizó estadística descriptiva y estadística inferencial, y prueba de chi cuadrado con nivel de significación de 0,05. El programa estadístico fue SPSS versión 17. El trabajo fue aprobado por el Comité de Investigación y Ética de la CMF "Dr. Ignacio Chávez", y fue registrado en la Dirección Médica del ISSSTE con el número 206-2012.
RESULTADOS
Se incluyeron en el estudio a 300 pacientes con diagnóstico de DM 2, y la edad promedio fue de 59,2±10,3 años. La prevalencia total de IVU fue del 17 %. Se presentó 12,5 % de bacteriuria asintomática (BA) y 38,4 % de bacteriuria sintomática (BS), con diferencia significativa entre ambas (p= 0,000; OR= 4,38; IC 95 % 2,09-8,99). Para el sexo, se obtuvo una prevalencia de IVU de 6,5 % para hombres y 22,8 % para mujeres, con significación estadística (p= 0,000; OR= 4,22; IC 95 % 1,78-11,51). Para al control glucémico, el 20 % de los pacientes descontrolados presentaron IVU contra el 14,3 % de los pacientes controlados, sin diferencia significativa entre ambas (p= 0,196; OR= 1,49; IC 95 % 0,78-2,87) (tabla 1).
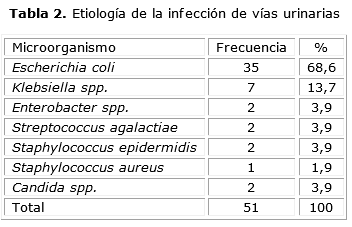
Con relación al cuadro etiológico, E. coli fue la de mayor prevalencia con 35 de los aislamientos (68,6 %), seguido de Klebsiella spp. con 7 (13,7 %). Se presentaron 5 bacterias Gram positivas (9,7 %) y 2 Candida spp. (3,9 %) (tabla 2).
Con respecto a la sensibilidad antimicrobiana por género, E. coli presentó 74,3 % de cepas con resistencia a la ciprofloxacina y 68,6 % para la ampicilina; mientras que para Klebsiella spp., se obtuvo 100 % de resistencia para la ampicilina, 28,6 % para cefuroxima y 0 % para trimetoprim-sulfametoxazol (tabla 3). Para la totalidad de las 44 cepas de bacterias Gram negativas, se obtuvo una resistencia de 72,7 % para la ampicilina, 65,9 % para la ciprofloxacina y 50 % para el trimetoprim-sulfametoxazol, además de un 13,6 % para la cefuroxima, 6,8 % para la ceftriaxona y 4,5 % para la ceftazidima.
DISCUSIÓN
Diferentes estudios han demostrado que el riesgo de desarrollar infección es mayor en los pacientes con diabetes, y que las vías urinarias es el sitio principal para ello.5,10 En este estudio se obtuvo una prevalencia de 17 % en total (12,5 % de BA y 38,4 % de BS). Yeshitela y otros,7 en su estudio con 413 diabéticos, obtuvieron una prevalencia de 10,9 % en total, con 10,4 % de BA y 13,6 % de BS. Al-Rubeaan y otros11 obtuvieron una prevalencia total de 25 %. Otros autores, como Renko y otros,12 realizaron un metaanálisis con 21 artículos sobre BA, y encontraron un promedio de prevalencia de 12,2 %. La mayoría de los autores coinciden que es más común la BS que la BA; y en el nuestro, no solo se concuerda con ello, sino que, además, la diferencia entre ambas fue estadísticamente significativa. De acuerdo con lo aquí reportado, el paciente diabético con sintomatología urinaria tiene más de 4 veces la posibilidad de presentar una IVU, que un paciente sin síntomas.
De los factores de riesgo referidos para desarrollar IVU, el sexo tal vez sea el mayormente reconocido. En este estudio se obtuvieron diferencias estadísticas significativas y un OR= 4,22. Al-Rubeaan y otros11 obtuvieron 7,2 % para hombres y 41,1 % para mujeres (RR= 6,1; IC 95 % 4,3-8,5). Hammar y otros, por su parte,13 obtuvieron un RR de 3,4 (IC 95 % 2,3-5,1), y en el mencionado metaanálisis de Renko y otros,12 obtuvieron 2,3 % en hombres y 14,2 % en mujeres (OR= 2,6; IC 1,6-4,1).
Otro factor involucrado es la edad. En el estudio se dividió la población en 2 grupos sobre la base de la definición de adulto mayor de la OMS para países en vías de desarrollo -menores y mayores de 60 años- y se obtuvo prevalencias de 13,0 y 20,7 % respectivamente, sin diferencias significativas. Al-Rubeaan y otros,11 y Turan y otros,10 tampoco la asocian con la edad. El mismo resultado fue obtenido por Renko y otros,12 al realizar un análisis multivariado ajustado en su metaanálisis.
De las variables propias de la DM, el tiempo de diagnóstico también ha sido referido como un factor de riesgo para el desarrollo de IVU. En este estudio no se obtuvo significación estadística. Boroumand y otros,8 tampoco obtuvieron relación entre estas variables, al igual que Renko y otros12 después de su análisis multivariado.
Un factor de riesgo que ha generado controversia en la literatura internacional, es el valor de hemoglobina glucosilada (HbA1C) asociada a IVU.8,13 En este estudio se obtuvo una prevalencia de 14,3 % para pacientes con HbA1C, por debajo de 7 % y de 20,0 % para pacientes con HbA1C con 7 % y más, sin diferencias significativas. La mayoría de autores como Boroumand y otros,8 Al-Rubeaan y otros11 y Renko y otros,12 no encontraron relación entre ambas variables. Por lo anterior, parece poco claro que el control glucémico de la DM se relacione con la presencia de IVU.
Con relación al cuadro etiológico, 68,6 % de nuestros aislamientos correspondieron a E. coli y 13,7 % al género Klebsiella spp. Turan y otros,10 obtuvieron el mismo porcentaje para E. coli, pero 23 % para Klebsiella spp.Chávez y otros14 mencionan a E. coli como el microorganismo más frecuentemente aislado, seguido de Enterococcus spp. y Klebsiella pneumoniae. Gallardo Luna y otros15 refieren 93,7 % de aislamientos de E. coli. Es claro que, independientemente de los porcentajes de prevalencia, E. coli es la bacteria mayormente aislada en las IVU.
En este estudio se determinó la resistencia de E. coli y Klebsiella spp. a los fármacos más comúnmente empleados en el tratamiento de IVU en pacientes diabéticos, y se obtuvieron porcentajes de resistencia de 68,6 y 100 % respectivamente para la ampicilina, 74,3 y 42,9 % para la ciprofloxacina, así como 57,1 y 0 % para el trimetoprim-sulfametoxazol; además de porcentajes de resistencia que variaron desde 2,9 hasta 28,6 % para las cefalosporinas. Para E. coli vs. ciprofloxacina, los resultados consultados presentan una fluctuación que va desde el 52,9 % de Petrovici y otros,16 el 19 % de Karlowsky y otros,17 hasta el 60,5 % de Mandal y otros18 y el 64,3 % de Boroumand y otros.8 Para trimetoprim-sulfametoxazol vs. E. coli, destacan los trabajos realizados en México por Chávez y otros,14 con 55 % de cepas resistentes, y el de Gallardo Luna y otros,15 con 82,8 %.
Los altos porcentajes de resistencia obtenidos en nuestro trabajo y que concuerdan en buena medida con los reportados internacionalmente, corroboran lo ya mencionado y conocido, que se está frente un problema serio de salud, sobre todo, si se considera que los 3 antibióticos comentados son los indicados en las guías de práctica clínica,19 y por lo mismo, los de mayor disponibilidad en las instituciones de salud pública.
Las cefalosporinas se presentan como alternativa a lo anterior, sobre todo, en los pacientes diabéticos. Los porcentajes de resistencia obtenidos en este trabajo, y en los referidos en la literatura, permiten considerarlo así. Ello, sin dejar de ponderar la disponibilidad que de ellos se tenga, y los reportes de considerable resistencia, como el 13,6 % total obtenido en este trabajo para cefuroxima, o el 15 % para la ceftazidima y la ceftriaxona contra E. coli reportado por Yeshitela y otros.7
El conocimiento de la susceptibilidad local de los microorganismos, es un punto crucial al elegir un tratamiento empírico para las IVU en pacientes ambulatorios, ya que la mayoría de clínicos no realiza un urocultivo antes de iniciar el tratamiento, o lo inicia antes de tener el resultado. Esto cobra particular importancia en pacientes diabéticos y sus complicaciones renales conocidas.
E. coli y Klebsiella spp. fueron las bacterias de mayor prevalencia, con porcentajes altos de resistencia a la ampicilina y la cefalosporina, 2 de los antimicrobianos mayormente utilizados en estos procesos. De los factores de riesgo analizados, solo el sexo se asoció a la IVU en el paciente diabético.
REFERENCIAS BIBLIOGRÁFICAS
2. Geerlings S, Fonseca V, Castro-Diaz D, List J, Parikh S. Genital and urinary tract infections in diabetes: impact of pharmacologically-induced glucosuria. Diabetes Res Clin Pract. 2014 Mar;103(3):373-81.
3. Dalal SH, Nicolle L, Marrs C, Zhang L, Harding G, Foxman B. Long-Term Escherichia coli Asymptomatic Bacteriuria among Women with Diabetes Mellitus. Clin Infect Dis. 2009 Aug 15;49(4):491-7.
4. Parasca OM, Gheaţă F, Pânzariu A, Geangalău I, Profire L. Importance of sulfonamide moiety in current and future therapy. Rev Med Chir Soc Med Nat Iasi. 2013 Apr-Jun;117(2):558-64.
6. Leal AL, Cortés JA, Arias G, Ovalle MV, Saavedra SY, Buitrago G, et al; GREBO. Emergence of resistance to third generation cephalosporins by Enterobacteriaceae causing community-onset urinary tract infections in hospitals in Colombia. Enferm Infecc Microbiol Clin. 2013 May;31(5):298-303.
7. Yeshitela B, Gebre-Selassie S, Feleke Y. Asymptomatic bacteriuria and symptomatic urinary tract infections (UTI) in patients with diabetes mellitus in Tikur Anbessa Specialized University Hospital. Addis Ababa, Ethiopia. Ethiop Med J. 2012 Jul;50(3):239-49.
8. Boroumand MA, Sam L, Abbasi SH, Salarifar M, Kassaian E, Forghani S. Asymptomatic bacteriuria in type 2 Iranian diabetic women: a cross sectional study. BMC Women's Health. 2006;6:4.
10. Turan H, Serefhanoglu K, Nur Torun A, Kulaksizoglu S, Kulaksizoglu M, Pamuk B, et al. Frequency, Risk Factors, and Responsible Pathogenic Microorganisms of Asymptomatic Bacteriuria in Patients with Type 2 Diabetes Mellitus. Jpn J Infect Dis. 2008;61(3):236-8.
11. Al-Rubeaan KA, Moharram O, Al-Naqeb D, Hassan A, Rafiullah MR. Prevalence of urinary tract infection and risk factors among Saudi patients with diabetes. World J Urol. 2013 Jun;31(3):573-8.
12. Renko M, Tapanainen P, Tossavainen P, Pokka T, Uhari M. Meta-analysis of the Significance of Asymptomatic Bacteriuria in Diabetes. Diabetes Care. 2011;34(1):230-5.
13. Hammar N, Farahmand B, Gran M, Joelson S, Andersson SW. Incidence of urinary tract infection in patients with type 2 diabetes. Experience from adverse event reporting in clinical trials. Pharmacoepidemiol Drug Saf. 2010 Dec;19(12):1287-92.
14. Chávez-Valencia V, Gallegos-Nava S, Arce-Salinas CA. Bacterial drug resistance and etiology of non-complicated urinary tract infections. Gac Med Mex. 2010 Jul-Aug;146(4):269-73.
15. Gallardo Luna MG, Magaña Aquino M, Andrade Rodríguez HJ, Jiménez de la Torre MJ, Sánchez Álvarez K, Fragoso Morales LE. Resistencia a fármacos empleados en infección de vías urinarias en pacientes de primer contacto en una Unidad de Medicina Familiar del IMSS. Enf Inf Microbiol. 2008;28(1):13-8.
16. Petrovici CG, Dorobăţ C, Matei M, Teodor A, Luca V, Miftode E. Aspects of the antimicrobial resistance profile in infections with Escherichia coli and Klebsiella pneumoniae in diabetic patients. Rev Med Chir Soc Med Nat Iasi. 2011 Jul-Sep;115(3):769-75.
17. Karlowsky JA, Lagacé-Wiens PR, Simner PJ, DeCorby MR, Adam HJ, Walkty A, et al. Antimicrobial resistance in urinary tract pathogens in Canada from 2007 to 2009: CANWARD surveillance study. Antimicrob Agents Chemother. 2011 Jul;55(7):3169-75.
18. Mandal J, Acharya NS, Buddhapriya D, Parija SC. Antibiotic resistance pattern among common bacterial uropathogens with a special reference to ciprofloxacin resistant Escherichia coli. Indian J Med Res. 2012;136(5):842-9.
19. Guía de práctica clínica. Diagnóstico y Tratamiento de la Infección Aguda, no Complicada del Tracto Urinario en la Mujer [página en Internet]; Número de Registro IMSS-077-08, México [citado 2 de agosto de 2013]. Disponible en: http://www.cenetec.salud.gob.mx/descargas/gpc/CatalogoMaestro/077_GPC_InfAgnocompdeltractourinariomujer/GPCRAPIDAtractourinario.pdf
Recibido: 17 de diciembre de 2013.
Aprobado: 31 de marzo de 2014.
Alberto González Pedraza Avilés. Facultad de Medicina. Universidad Nacional Autónoma de México. Circuito Interior. Ciudad Universitaria. Avenida Universidad # 3 000, México Distrito Federal, Delegación Política Coyoacán, CP 04510. México DF, México. Correo electrónico: albemari@unam.mx