Introducción
El glioblastoma multiforme (GBM) es la forma más agresiva de glioma maligno que representa más del 50% de todos los gliomas.1 A pesar de la cirugía, la quimioterapia y la radiación máximas, la heterogeneidad histológica de GBM hace imposible la erradicación total, debido a que las células cancerosas residuales invaden el parénquima, que de otro modo no se ve en las imágenes radiográficas. La delimitación visual de los márgenes del tumor con técnicas quirúrgicas comunes es un desafío que enfrentan muchos cirujanos.2
Los GBM abarcan GBM secundarios (aproximadamente el 5% de los casos) que se desarrollan a partir de astrocitoma difuso de grado inferior (grado II de la OMS) o astrocitoma anaplásico (grado III de la OMS), y GBM primarios (aproximadamente el 95% de los casos) que surgen rápidamente de novo. La comprensión de los detalles moleculares de estos mecanismos y la identificación de posibles objetivos farmacológicos han surgido como tareas vitales para mejorar el tratamiento.3
A pesar de los avances en radioterapia, quimioterapia y los tratamientos de resección quirúrgica agresiva, el pronóstico sigue siendo sombrío. Después del diagnóstico, los pacientes tienen una supervivencia media de 15 meses y una tasa de supervivencia de 2 años del 25%.4,5
Diferentes factores moleculares como la mutación de P53, el índice de marcaje de MIB-1 y la metilación de O-6-metilguanina-ADN metiltransferasa (MGMT) se han correlacionado con la recurrencia en GBM.6,7
Con la presente revisión se describen, en un marco actual, las principales alternativas de tratamiento del glioblastoma multiforme.
Material y método
Se realizó una revisión sistemática de los principales artículos publicados en inglés y español, en revistas de alto impacto a nivel mundial, acerca de los principales avances en el tratamiento del glioblastoma multiforme, donde se destacan numerosos estudios experimentales que evidencian descubrimientos que constituyen dianas para contrarrestar la proliferación y progresión de dicha lesión, así como los últimos avances en materia de conducta quirúrgica que demuestran la elevada precisión en la resección del glioblastoma.
Discusión
Avances neuroquirúrgicos en la resección del glioblastoma
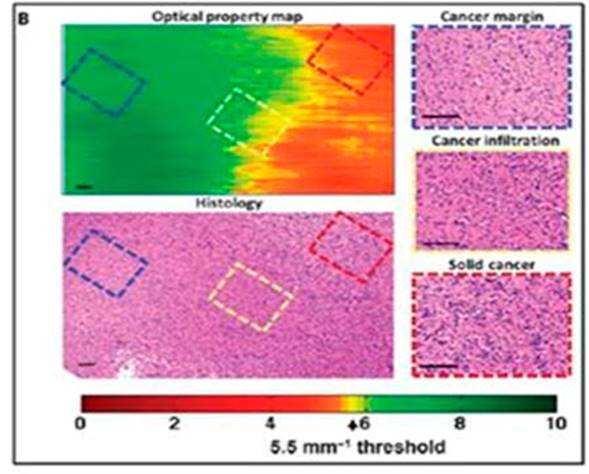
Constituye una técnica no invasiva, basada en la interacción de la emisión de la luz y el tejido, que ilustra las adquisiciones de imágenes en dos y tres dimensiones en un mapa codificado por colores. Con OCT es posible capturar imágenes de mayor resolución desde estructuras más profundas en tejidos (hasta 2 mm, aproximadamente).8 Además de ilustrar la hipercelularidad del tumor, la TCO también identificó las áreas necróticas que se muestran como señales hipointensas en el mapa: la angiogénesis tumoral y el flujo sanguíneo cerebral.9,10 Se observa el margen de tumor sólido, margen del tumor y tejido sano de glioblastoma en una rata. (Fig. 1).
Cirugía guiada por fluorescencia (FGS)
Moore,et al.11 en 1948 aplican por primera vez un marcador fluorescente exógeno, usado para resecar tumores cerebrales.
La fluorescencia de porfirina inducida por ácido 5-aminolevulínico, sustancia fotosensible precursora de la protoporfirina IX (PpIX) (visible principalmente con una longitud de onda de 375-475 nm), se convierte en una señal de emisión fluorescente roja después de la metabolización mitocondrial. Unos 44 estudios clínicos han usado 5-ALA para la cirugía del glioma; estos han demostrado un grado de resección tumoral (GTR) del 65% con 5-ALA, en comparación con el GTR del 35% para el grupo sin el fluoróforo. Además, se logró un aumento en la supervivencia (PFS) de 3.8 meses.12-14
Craneotomía de vigilia
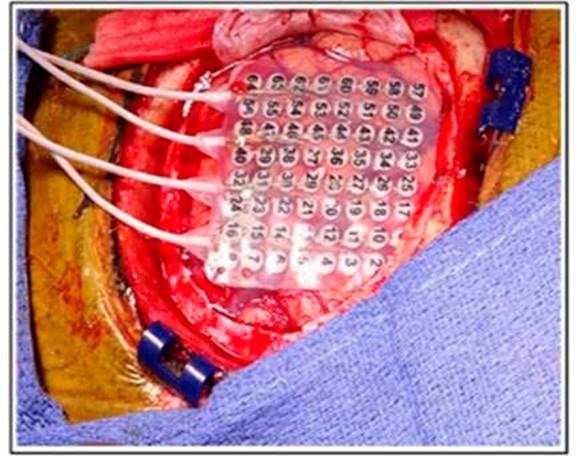
Hay casos durante la craneotomía despierta repetida donde el tumor puede desplazar las áreas elocuentes debido a la plasticidad cerebral; por lo tanto, el cirujano no puede confiar en la imagen de resonancia magnética (RM) y en la anatomía en sí misma para la extensión de la resección. El mapeo cortical de estas áreas (a través de un conjunto de electrodos directos que estimulan o inhiben las funciones corticales) sigue siendo la opción óptima para delinear la relación del tumor con la corteza elocuente y evitar daños en los tejidos que pueden comprometer el lenguaje o las habilidades de movimiento en los pacientes.15
En un informe clínico del año 2017, realizado por Quiñones, et al.16 los pacientes sometidos a craneotomía de vigilia (CV) tuvieron una resección total más amplia. Además, presentaron un mejor estado funcional posoperatorio y una reducción de las morbilidades posoperatorias en comparación con los pacientes sometidos a anestesia general, para la resección de los gliomas localizados en áreas elocuentes (93.3% vs. 81.1% respectivamente).
En el 2017, Lau, et al.17 evaluaron la precisión de los límites quirúrgicos proporcionados por CV y encontraron una precisión general de 79.6% de la percepción intraoperatoria de la resección total o subtotal, lograda bajo anestesia general. Se aprecia el mapeo cortical de las áreas elocuentes por electrodos. (Fig. 2).
Terapia térmica intersticial (LITT) con láser para la ablación por glioblastoma multiforme (GBM)
Terapia termocoaguladora en la que la radiación láser se transmite por vía percutánea a un tejido que causa una necrosis del tejido generada por el calor y, por tanto, ablación de la lesión dirigida. Esta coagula el tejido mediante la transmisión selectiva de la energía del láser focal con hipertermia intersticial. Un estudio multicéntrico evaluó 34 GBM consecutivos de difícil acceso, tratados con LITT en tres instituciones diferentes de los EE. UU. Encontró una relación significativa entre el efecto citorreductor de la hipertermia y la PFS. Todos los pacientes habían recibido TMZ y mostraron una supervivencia media de 9,4 meses; sin embargo, con LITT, su supervivencia media aumentó a 11,2 meses.18
Microscopía intraoperatoria confocal.
La endomicroscopía confocal del infrarrojo cercano (NIR) se utilizó por primera vez para delimitar el GBM infiltrativo in vivo como modelo preclínico en roedores en 2011.
El estudio determinó que la longitud de onda NIR con esta técnica microscópica, combinada con verde de indocianina (ICG), detecta la fluorescencia de las células tumorales. La identificación de varias citoarquitecturas de los diferentes tumores, a partir de imágenes confocales intraoperatorias, es coherente con los resultados de la patología.19
Espectrometría de masas intraoperatoria (EM)
Constituye una técnica analítica que identifica y caracteriza las moléculas, según sus masas y patrones de fragmentación, respectivamente, a escala nanométrica. Al utilizar una tecnología de desorción / ionización por láser asistida por matriz, la EM es un enfoque importante para investigar la disposición espacial de moléculas en tejidos biológicos, de una manera sensible y específica. Los cirujanos pueden usarlo como una guía en tiempo real para delinear tumores mediante la adquisición de información molecular compleja en tiempo real. Los datos preliminares de diez pacientes también demostraron una sensibilidad global del 93% y una especificidad del 83% de la demarcación quirúrgica a través de una estimación del alto porcentaje de células tumorales, proporcionado por cirugía estereotáxica más EM.20
En la figura 3 se observa la espectrometría de masas intraoperatoria de un oncometabolito para guiar la resección del tumor cerebral.
Frotis teñido con H&E (izquierda), sección de tejido congelado (centro) e inmunohistoquímica, utilizando un anticuerpo específico de mutación puntual IDH1 R132H en muestras de oligoastrocitoma de grado III.
Representación 3D del volumen del tumor que muestra la señal de 2-hidroxiglutarato (2-HG) normalizada y representada con una escala de color cálido (de la más baja (amarilla) a la más alta (roja).
Espectros de masas DESI en modo de ión negativo obtenidos de un frotis (izquierda) y una sección de un oligoastrocitoma grado III (derecha).
Investigaciones acerca de la biología molecular de los glioblastomas vinculados con dianas terapéuticas
En la investigación realizada por Huang P.21 se plantea la hipótesis de que la resistencia del glioblastoma a la terapia se debe en parte a las células madre del cáncer; este utiliza la tecnología de visualización de fagos en el cáncer para identificar, atacar y obtener imágenes de las células tumorales.
Anteriormente, demostraron que los fagos in vivo muestran biopanning contra líneas de células primarias de glioblastoma xenoinjertadas en ratones inmunocomprometidos y es una estrategia eficaz para aislar secuencias de péptidos de células madre de glioma (GSC). El CD38 se expresa en el 25% de los macrófagos de microglia tumorales que forman el 40% de la mayor parte del glioma. Con el empleo de esta estrategia, se identificó Vav3, un factor de intercambio de guanina que desempeña un papel en el mantenimiento de las células madre de glioma (GSC). Estos estudios validan la efectividad de la utilización de diferentes estrategias de biopanning en el despliegue de fagos, para aislar proteínas nuevas que pueden desempeñar un papel vital en el mantenimiento de los glioblastomas.26
Otros estudios como el de Aulakh S,22 utilizan el CD38 como un objetivo potencial, especialmente con la disponibilidad de Daratumumab; un anticuerpo monoclonal anti-CD38 aprobado por la FDA. Daratumumab más Temozolomida (TMZ) causa apoptosis directa, en células GBM derivadas de humanos en sus experimentos in vitro.
Yang JM,23 ha caracterizado las mutaciones de PTEN en el cáncer cerebral donde se revela que la monoubiquitinación PTEN promueve la estabilidad de las proteínas y la localización nuclear. Asimismo, proporciona un mecanismo molecular para los defectos de PTEN, asociados con el cáncer, lo que conduciría a un tratamiento para el cáncer cerebral que se dirige a la monoubiquitinación de PTEN.
Erasimus E,24 ha estudiado los mecanismos de reparación del ADN y su impacto clínico en el glioblastoma, donde plantea que los GBM se caracterizan por una importante heterogeneidad intertumoral e intratumoral, tanto a nivel celular como genómico. En las células no neoplásicas, la reparación precisa del ADN es esencial para prevenir la inestabilidad genética, una fuerza impulsora en la tumorigénesis.
Por lo tanto, las células cancerosas a menudo muestran alteraciones genéticas o epigenéticas que afectan los factores de reparación del ADN. Paradójicamente, los mecanismos de reparación del ADN también son fundamentales para la eliminación de las lesiones inducidas por agentes antitumínicos genotóxicos y contribuyen al desarrollo de la resistencia y la recaída del tumor.
Las lesiones de ADN más graves, causadas por las radiaciones ionizantes (IR), son roturas de doble cadena (DSB) que se reparan por dos mecanismos, cada uno compuesto por varias vías de recombinación homóloga (HR) y unión final no homóloga. Otras formas de daño en el ADN inducido por IR incluyen daño en la base y roturas de una sola hebra. Por otro lado, las principales lesiones inducidas por TMZ son N7-metilguanina (N7-meG) y N3-metiladenina (N3-meA), reparadas principalmente por BER y O6-metilguanina (O6-meG).
Kristoffersen K,25 afirma que la recaída del glioblastoma multiforme (GBM) puede deberse a células madre cancerosas (CSC), que representan solo el 1% de las células tumorales totales. Las células iniciadoras de tumores cerebrales (BTIC) son células cancerosas con propiedades similares a las células madre neurales (NSC), que se encuentran en el devastador tumor cerebral glioblastoma multiforme (GBM). Se supone que los BTICs están involucrados en la iniciación del tumor, la progresión, la resistencia al tratamiento y la recaída.
Pengcheng Li, (26) por otro lado, determinó que la hipoxia mantuvo el estado indiferenciado de las células primarias del glioma y desaceleró el crecimiento de las células del glioma que estaban en una etapa relativamente inactiva. Asimismo, aumentó la eficiencia de formación de colonias y la migración de las células del glioma, y elevó la expresión de marcadores de las células madre; pero la expresión de marcadores para la diferenciación de células madre se redujo después del tratamiento de hipoxia. Concluyó que la hipoxia puede inducir la "desdiferenciación" de las células de glioma diferenciadas y promover la adquisición de la capacidad madre en estas células.
Llongueras J, (1) investiga el intercambiador de Na + / H + NHE9, gran familia de proteínas de transporte que conduce el contratransporte electroneutral de cationes con protones a través de bicapas lipídicas. Se ha demostrado recientemente que un intercambiador se localiza en una región perinuclear correspondiente a los endosomas de reciclaje, donde se piensa que regula el pH luminal, controla el tráfico y la degradación de la carga.
Con el empleo de cultivos celulares de GBM primarios con niveles naturalmente altos o bajos de NHE9, se encontró que la alteración de esos niveles regula la tumorogénesis y la capacidad migratoria in vitro. Además, el aumento de los niveles de NHE9 alcaliniza el pH luminal de los endosomas, lo que inhibe la degradación de EGFR y promueve la señalización oncogénica. Sus hallazgos demuestran que la modificación de este intercambiador afecta la progresión tumoral de los glioblastomas humanos al alterar el pH endosomal. (1)
Conclusión
Son muchas las investigaciones publicadas que demuestran el avance con respecto a la terapéutica del glioblastoma, tanto en el ámbito de abordajes quirúrgicos para su resección como en la terapia coadyuvante. Se espera que en un futuro próximo se encuentre una vía para detener la progresión tumoral y concretar su cura definitiva.