Introducción
El síndrome de Brugada (SB) fue descrito en 1992 como un cuadro de muerte súbita por fibrilación ventricular en pacientes con patrón electrocardiográfico de bloqueo de rama derecha y supradesnivel ST persistente en precordiales derechas, sin anormalidades cardiacas estructurales.1 El síndrome consiste una alteración de los canales iónicos que participan en el funcionamiento eléctrico de la célula miocárdica. Es una enfermedad que se transmite de padres a hijos por un patrón de herencia autosómica dominante y predispone a la aparición de arritmias y de muerte súbita. Está presente en el 4 % de todas las muertes súbitas, y hasta en el 20 % de las muertes súbitas en pacientes que no tienen defectos cardíacos estructurales. Concretamente, está causado por mutaciones del gen SCN5A que codifica la subunidad alfa de los canales cardiacos de sodio y como consecuencia se produce una reducción de las corrientes de entrada de este ión durante el potencial de acción, sobre todo a nivel epicárdico, por lo que se establece una heterogeneidad transmiocárdica de los periodos refractarios que es la causante de las arritmias por reentrada.2
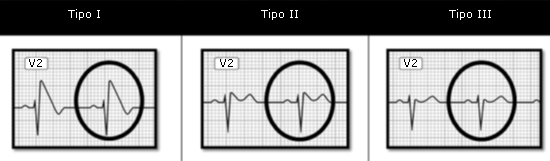
Se reconocen 3 patrones electrocardiográficos (Fig. 1):
Tipo I. Es diagnóstico del síndrome per se. Se caracteriza por elevación con aspecto convexo del ST mayor de 2 mm, con onda T negativa en las derivaciones precordiales derechas (V1 y V2).
Tipo II. La elevación del ST, mayor de 2 mm, tiene forma peculiar denominada en «silla de montar». La onda T es positiva o bifásica.
Tipo III. La elevación del ST es menor de 2 mm y presenta cualquiera de las 2 configuraciones anteriores. La onda T es positiva.
Aunque los 3 patrones pueden observarse en el mismo paciente en diferentes momentos, solo el tipo I se considera diagnóstico, pero debe asociarse con al menos uno de los siguientes criterios clínicos: fibrilación ventricular documentada, taquicardia ventricular polimórfica documentada, inducibilidad de arritmias ventriculares durante el estudio electrofisiológico, síncope o respiración agónica nocturna, historia familiar de muerte súbita en edad previa a los 45 años o patrón ECG tipo I en otros miembros de la familia. Dado que el patrón ECG de los pacientes con síndrome de Brugada es variable, incluso puede ser transitoriamente normal, el uso de pruebas farmacológicas de provocación con bloqueadores del canal de sodio se ha hecho rutinario. La ajmalina es el más eficaz, pero por cuestión de disponibilidad se suele realizar con flecainida, a pesar de que presenta sensibilidad, especificidad y valor predictivo negativo menores. Se considera que se trata de síndrome de Brugada si tras la prueba de provocación aparece o se acentúa el patrón ECG tipo I.3
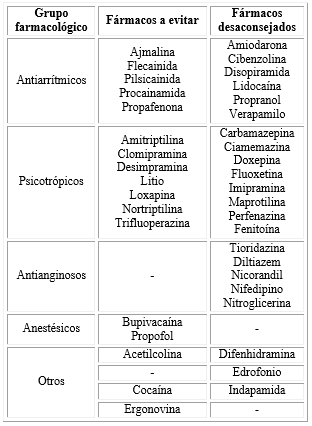
Los pacientes con síndrome de Brugada son en su mayoría asintomáticos, pero entre el 17-42 % de ellos presentan síncope o muerte súbita como consecuencia de una arritmia ventricular en algún momento de su vida. Las arritmias aparecen, característicamente, en situaciones de predominio vagal, como el reposo o incluso el descanso nocturno.4 Presenta una mayor expresividad con un fenotipo 8-10 veces más frecuente en varones que en mujeres.1 Ciertos fármacos (tabla 1) o un estado febril pueden también desencadenar el patrón I e inducir arritmias.5
El diagnóstico debe sospecharse en pacientes que presenten un electrocardiograma sugestivo, pacientes con síncopes en reposo y/o que han presentado un episodio de muerte súbita reanimada.
El tratamiento consiste en un desfibrilador automático implantable si el paciente presenta síntomas (síncopes o muerte súbita reanimada); si no presenta síntomas, no hay evidencia clara de que algún tratamiento farmacológico pueda ser útil para reducir el riesgo de muerte súbita, por lo que hay que decidir si tiene un riesgo lo, suficientemente, elevado como para justificar la implantación de un desfibrilador.6
Desde el punto de vista anestésico, dado su carácter impredecible, el síndrome de Brugada constituye un verdadero reto. Entre las consideraciones anestésicas debe tenerse en cuenta los anestésicos locales utilizados y que son, realmente, fármacos antiarrítmicos (clase Ib), los cuales se encuentran entre los fármacos arritmogénicos ya que bloquean los canales de sodio, actuando en la fase 0 del potencial de acción.
Así mismo, los cambios autonómicos pueden precipitar arritmias.5 Es importante asegurar adecuados niveles de profundidad anestésica y minimizar los cambios posturales. El mantenimiento de la normotermia debe ser una de las prioridades. La hipertermia es uno de los factores que acentúa los cambios del patrón de Brugada y lleva a una inactivación prematura de los canales de sodio. En cuanto al posoperatorio, se recomienda que los pacientes se mantengan bajo observación con telemetría por 36 h luego de la cirugía dado que es más frecuente que las arritmias ocurran en el posoperatorio.7
Caso clínico
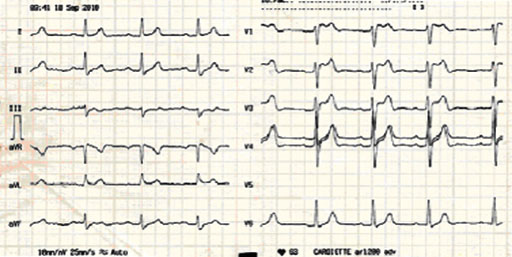
Se presenta el caso de un paciente de sexo masculino de 69 años programado para herniorrafía inguinal izquierda con antecedentes de hipertensión para lo cual tomaba Enalapril 10 mg cada 24 h. En el ECG basal realizado en la consulta de preanestésica se evidenció bloqueo Av de primer grado, supradesnivel del segmento ST >2 mm en V1-3, con morfología en silla de montar, seguido de onda T bifásica por lo que se realizó interconsulta a cardiología ante la sospecha de síndrome de Brugada desconocido (Fig. 2), cardiología indicó prueba de provocación con Ajmalina que resultó positiva por lo que es diagnosticado de síndrome de Brugada tipo II. Luego de valorar el caso, el cardiólogo consideró que no existía inconveniente para realizar el procedimiento y recomendó la monitorización del ritmo cardiaco con análisis de arritmias, así como evitar el uso de fármacos que se conocen asociados a incremento de los trastornos de repolarización en este síndrome.
La intervención se realizó bajo anestesia general y dispositivo supraglótico para el control de vía aérea. Se colocaron electrodos en el tórax, conectados a un desfibrilador externo. Se monitorizó PANI, SpO2, EtCO2, temperatura, TOF, BIS y ECG, incluyendo V2. Se colocó manta térmica (de aire caliente) bajo sábana para mantener la normotermia.
Se premedicó con 2 mg de midazolam y 100 microgramos de fentanilo, la inducción se realizó con 15 mg de etomidato y el mantenimiento con Sevoflurano® al 1,5 % a través de mascarilla laríngea LMA® del número 5, previo al inicio de la cirugía se realizó bloqueo del plano transverso abdominal (TAP) izquierdo ecoguiado administrándose lidocaina al 1 % con adrenalina con un total de 200 mg de lidocaína.
El proceso transcurrió sin incidencias mostrando en todo momento su ECG basal, no precisó más dosis de fentanilo en el intraoperatorio, administrándose, únicamente, 50 mg de desketoprofeno intravenoso como analgésico, tras educción y retirada de mascarilla laríngea se trasladó a la unidad de recuperación posanestésica donde permaneció 8 h, mostrándose en todo momento estable desde punto de vista hemodinámico, se pauto perfusión continua de 3 ampollas de desketoprofeno y se midió el EVA cada hora siendo este inferior o igual a 3 en cada medida, solo precisando en una ocasión un rescate analgésico con 1 gramo de paracetamol iv. Posteriormente, pasó a planta donde permaneció monitorizado hasta el día siguiente sin incidencias y pudo ser dado de alta a domicilio.
Discusión
El pasarle anestesia a un paciente con síndrome de Brugada es un reto para cualquier anestesiólogo ya que es una cardiopatía compleja en su diagnóstico y tratamiento y no existe una bibliografía clara en cuanto a los fármacos contraindicados. Aunque en nuestro caso la intervención podía ser realizada con anestesia raquídea, ya que varios autores hablan de su seguridad en pacientes con síndrome de Brugada, se optó por la realización de una anestesia general combinada con un bloqueo TAP ya que el bloqueo simpático inducido por la anestesia raquídea puede desencadenar episodios de hipotensión y bradicardia por lo que algunos autores recomiendan bloqueos nerviosos antes que anestesias del neuroaxial.8,9,10,11 Otro de los motivos por lo que nos inclinamos por la realización de un bloqueo TAP fue para disminuir el uso de opioides tanto en el intra como en el posoperatorio, evitando así el efecto bradicardizante de los opioides.12,13,14
En la actualidad el bloqueo ecográfico del plano transverso abdominal se emplea en un alto número de procedimientos anestésicos tanto en cirugía mayor ambulatoria (CMA) como en cirugía con ingreso. Su amplia difusión y estandarización en estos últimos años ha venido de la mano de la implantación del uso de ultrasonidos que ha permitido disminuir el volumen de anestésico administrado.
En cuanto a la utilización de los anestésicos locales en el síndrome de Brugada, deben de usarse con precaución ya que actúan a nivel de los canales de sodio, pueden desencadenar cambios electrocardiográficos y generar arritmias. Aunque algunos autores desaconsejan el uso de lidocaína (tabla 1), se han descrito estudios que avalan su seguridad en anestesia neuroaxial al ser un fármaco de acción corta (de entrada y salida rápida);12,13,15,16 sin embargo, se recomienda evitar el uso de Bupivacaína ya que su isómero R bloquea, ávidamente, los canales de sodio y se disocia lento, lo que la convierte en el fármaco con mayor potencial proarrítmico y cardiotóxico.
El bloqueo TAP ecoguiado con lidocaína se muestra como una alternativa segura y eficaz para el control del dolor en pacientes intervenidos de herniorrafía inguinal, aunque es cierto que se necesitan más estudios que confirme esta afirmación.
Responsabilidades éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.