Introducción
La difteria es una enfermedad trasmisible, caracterizada por manifestaciones locales en las vías respiratorias y sistémicas, causada por la toxina diftérica, producida por el agente patógeno Corynebacterium diphteriae.1) La difteria aún persiste en numerosos países y varios brotes epidémicos han tenido lugar en los últimos 10 años, afecta principalmente a los adultos que han perdido la inmunidad inducida por vacunas, y a los niños no inmunizados.1) La brecha de la inmunidad en los adultos y la presencia de un gran número de niños y adolescentes susceptibles, ha creado las bases para estas epidemias.2) En 2014, fueron reportados a nivel mundial 7 321 casos de difteria a la Organización Mundial de la Salud (OMS), pero muchos casos más probablemente no se reportan.3
En América, aunque se ha aplicado el programa ampliado de inmunización de la OMS y se ha logrado una sostenida disminución de la incidencia, todavía hay países como Bolivia, Brasil, Colombia, Ecuador, Haití, Paraguay y República Dominicana que presentan la enfermedad de forma endémica, presentan brotes en algunos de ellos en los últimos años.3
En los países industrializados, los altos niveles de inmunización en niños han provocado la disminución de la circulación del Corynebacterium diphtheriae, por lo que hay menos posibilidades de reforzar la inmunidad por exposición natural; aparecen grupos de individuos adultos no inmunes con condiciones ideales para brotes epidémicos.1
En Cuba, la cobertura de vacunación contra la difteria se elevó a 90% a inicios de la década de los años 70, y como consecuencia esta desapareció en 1979. Sin embargo, los resultados obtenidos en estudios realizados a diferentes grupos etarios que demuestran niveles no protectores de antitoxina diftérica en la población cubana, unido a la reemergencia de la difteria en varios países son causa de preocupación ante la posibilidad de ocurrencia de brotes.1,4,5,6,7
Adicionalmente la disponibilidad de métodos que permitan cuantificar anticuerpos contra antígenos vacunales como el toxoide tetánico o diftérico se emplea en la práctica clínica para evaluar la competencia del sistema inmune, y contribuye al diagnóstico de inmunodeficiencias.
La determinación de anticuerpos antitoxina diftérica tradicionalmente, se ha realizado por métodos en vivo como los ensayos de neutralización de toxinas en conejillos de indias o conejos. Los métodos en vivo y los procedimientos in vitro tales como la hemoaglutinación pasiva y las pruebas de neutralización en cultivo de tejidos tienen la desventaja de ser complejos de manipular y estandarizar, además de ser lentos y costosos. Sin embargo, el empleo de ensayos inmunoenzimáticos como el análisis de inmunoadsorción ligado a enzima o ELISA (del inglés Enzyme-Linked Immunosorbent Assay) en la práctica de laboratorio de rutina ofrece ventajas por su elevada sensibilidad, detectabilidad y especificidad, además de ser un procedimiento técnico rápido, sencillo, económico y que permite evaluar un elevado número de muestras al unísono.1,5
Objetivo
Validar un ensayo inmunoenzimático tipo ELISA para cuantificar niveles de antitoxina diftérica en suero humano.
Material y método
Se realizó un estudio experimental de desarrollo tecnológico, dirigido a la validación de un ensayo inmunoenzimático heterogéneo indirecto para la cuantificación de antitoxina diftérica, desarrollado en el laboratorio de Inmunología del Centro Nacional de Genética Médica (CNGM), La Habana, Cuba.
Se determinaron los valores óptimos de un grupo de variables que influyen en el resultado del ensayo inmunoenzimático y para su validación se siguieron los procedimientos que se establecen por el Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED) del Ministerio de Salud Pública (MINSAP) de Cuba en las regulaciones 41 de 2007 y 40 de 2014.8
La ejecución de este proyecto fue aprobada por el Comité de Ética y el Consejo Científico del Centro Nacional de Genética Médica y para el desarrollo del estudio se tuvieron en cuenta los principios enunciados en la última actualización de la declaración de Helsinki.9) A los pacientes que participaron en el estudio se les explicó los aspectos de interés de la investigación y una vez que dieron su consentimiento verbal, se les entregó el modelo del consentimiento informado para su firma.
Antígeno
Como antígeno de captura para la estandarización se utilizó la anatoxina diftérica producida y purificada por el Instituto Finlay (La Habana, Cuba).10
Estándar y controles del laboratorio
Para la preparación del estándar del laboratorio y los controles, se utilizaron bolsas de plasma procedentes del Banco de Sangre Provincial de La Habana, las que fueron sometidas a un proceso de recalcificación para obtener el suero. Se estabilizaron y conservaron con timerosal a 0,01%, a temperatura de -20ºC.11,12
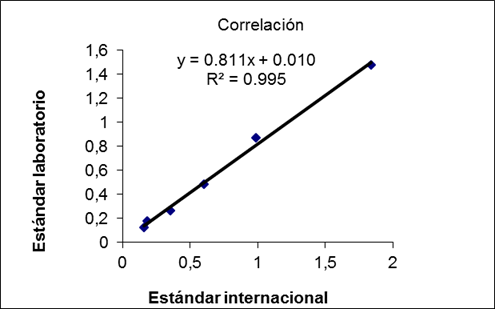
El suero seleccionado para la curva de calibración fue evaluado contra el estándar de la OMS (Diphtheria Antitoxin Human Serum 00/496). El rango de trabajo de la curva se determinó analizando un total de 10 curvas, en las cuales se prepararon series de diluciones dobles seriadas y se seleccionó el trayecto correspondiente a un coeficiente de determinación (R2) mayor de 0,98.11,13
Para evaluar la curva de calibración se realizó un análisis de regresión lineal entre el estándar de referencia y el preparado en el laboratorio, se hicieron diluciones dobles seriadas desde 1/100 hasta 1/3200 para ambos estándares.
Para el control positivo se utilizaron sueros de alta, media y baja concentraciones de antitoxina tetánica, determinadas por cuantificación mediante el método comercial VaccZymeTM Diphtheria Toxoid IgG Enzyme Inmuno Assay de Binding Site que cubrieron el rango de trabajo de la curva de calibración.11,13) Se comprobó la distribución normal según la prueba de Kolmogorov Smirnov.
Procedimiento
Se sensibilizaron placas de 96 pocillos (DELTALAB) durante una hora a 37°C en cámara húmeda con toxoide diftérico a 8LF/mL (LF: unidades de floculación) diluido en amortiguador carbonato bicarbonato de sodio 0,05 M, pH 9,6. La dilución utilizada para las muestras fue 1/20 y el conjugado anti-IgG humana peroxidasa (DAKO) desde 1/6000 hasta 1/14000, ambos se diluyeron en buffer fosfato salino más Tween 20 al 0,05% más leche desnatada al 4% (PBS-T+LD 4%). El material no adsorbido después de cada paso se eliminó al lavar la placa tres veces con 250 µl por pocillo de PBS-T pH 7,2. La lectura de las densidades ópticas se realizó a 942 nm y se trasformaron a unidades de concentración mediante el programa computacional ELISA for Windows, del Centro para Enfermedades Infecciosas (CDC) de Atlanta, USA, que utiliza una función logistic-log de cuatro parámetros y el método robusto de mínimos cuadrados para el ajuste de la curva de calibración.4,11 El análisis estadístico se realizó con el paquete de herramientas Microsoft Office Excel 2007 y los programas Statgraphics Plus 5.0 y Statistical.
Parámetros de Validación
Precisión intraensayo
La variabilidad intrínseca del ELISA se determinó mediante la precisión intraensayo. Se seleccionaron seis muestras de sueros con concentraciones conocidas de anticuerpos contra toxina diftérica dentro del rango analítico, incluyendo muestras con concentraciones inferiores y superiores a 0,1 UI/mL, valor considerado como protección adecuada cuando es determinada mediante ELISA y se evaluaron por triplicado en tres ensayos; se realizaron nueve replicados de cada muestra. Se determinaron el promedio, la desviación estándar y el coeficiente de variación (CV). Este último parámetro estadístico no debía superar 10% para considerarse la precisión intraensayo como adecuada.13,14,15
Precisión interensayo
Para su determinación se seleccionaron seis sueros de diferentes concentraciones y se evaluaron por triplicado bajo tres condiciones diferentes: tres analistas un mismo día, un mismo analista mediante ensayos en paralelo y en días diferentes. Para la precisión tanto intraensayo como la precisión interensayo se calculó el CV mediante la fórmula: CV= (Desviación estándar (DE)/Concentración Promedio) x 100. El CV no debe superar 20% en la interensayo, para considerarse que la precisión es adecuada.13,14,15
Exactitud
La exactitud se determinó mediante ensayo de recuperación. Se prepararon cuatro muestras a partir del suero estándar de la OMS de concentración conocida y se evaluaron por triplicado. El porcentaje de recuperación se determinó por la siguiente fórmula: R=valor obtenido/valor esperado*100. Se tomó como criterio de aceptación que R estuviera dentro del intervalo de 90 a 110%.13,14,15,16) Se utilizó la Prueba t para muestras pareadas para determinar la diferencia entre el valor esperado y el obtenido, con un nivel de significación de 0,05.
Especificidad
Para la determinación de la especificidad del ELISA se utilizó el método de adición al patrón, añadiendo al suero patrón sustancias como triglicéridos, colesterol, inmunoglobulinas y suero hemolítico que pueden estar presentes en el suero del paciente; se evaluaron por triplicado y se analizaron mediante el método de recuperación (R). Para una especificidad aceptable se consideró que R estuviera dentro del intervalo de 90 a 110%.13,15,16
Linealidad
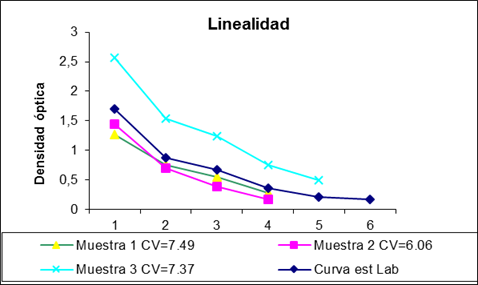
Se evaluó mediante el ensayo de paralelismo, para el cual se evaluaron en una misma determinación por triplicado tres muestras y el suero patrón. Se realizaron diluciones dobles seriadas. Para determinar el paralelismo se usó el CV de las concentraciones de las muestras corregidas por el factor de dilución. Se consideraron óptimos los valores de CV inferiores a 10%.
Límite de detección
Se procesaron 55 muestras del control negativo. Se comprobó la normalidad de la distribución y se le sumó al promedio (X) de las densidades ópticas (DO) dos DE (XDO+2DE).
Límite de cuantificación
Se tomó el valor de concentración inferior del rango de cuantificación mínimo de la curva patrón.
Ensayo de comparación de métodos
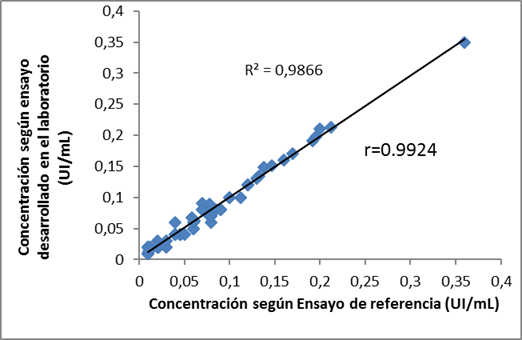
Se realizó la cuantificación del nivel de antitoxina diftérica a 62 muestras mediante el ELISA en validación y un método de referencia con características similares al desarrollado. El ensayo comercial empleado fue VaccZyme TM Diphtheria Toxoid IgG Enzyme Inmunoassay fabricado por Binding Site, ELISA indirecto para cuantificar anticuerpos IgG contra el toxoide diftérico. Para comprobar si los resultados obtenidos por ambos métodos eran similares se compararon las medias de cada determinación al utilizar la Prueba t para muestras pareadas ((=0,05) y se realizó la recta de regresión entre los valores de concentración determinados por ambos ELISA.
Se evaluó la correlación entre los métodos tanto en muestras con niveles no adecuados de protección o de corta duración (<0,1 UI/mL), como con niveles de protección adecuada o de larga duración (≥ 0,1 UI/mL).1,4,5,14
Resultados
Los sueros controles preparados para la verificación de la calidad de la curva de calibración abarcaron la zona central de la curva en un rango de 0,28 UI/ml hasta 0,53 UI/ml, teniendo en cuenta una dilución inicial para las muestras de 1/20. Todos presentaron una distribución normal según la prueba de Kolmogorov Smirnov.13,15,16
El procedimiento de clarificación, preservación y estabilización con albúmina sérica humana a 6% en una relación peso/volumen (p/v) permitió que el suero estándar alcanzara una alta estabilidad en condiciones de uso.8,12
Evaluación de la curva de calibración
En el análisis de regresión lineal entre el estándar de referencia y el preparado en el laboratorio (Figura 1), se alcanzó una adecuada correlación entre los resultados de concentración de antitoxina diftérica evaluados con ambos estándares.17
Indicadores de validación
Precisión
La variación intraensayo entre los replicados realizados en las muestras evaluadas en las diferentes determinaciones no superó 10% (Tabla 1). El ensayo es reproducible con CV intra e interensayo de alrededor de 10% y 20%, respectivamente.13,15,16,17
Tabla 1 Precisión del ELISA para la cuantificación de antitoxina diftérica

X: media de la concentración de antitoxina diftérica de los tres replicados realizados a cada muestra en los diferentes ensayos.
CV: coeficiente de variación.
Especificidad
Como se observa en la Tabla 2, después de la adición de sustancias de interferencia al suero patrón los valores de recuperación de antitoxina diftérica que se alcanzaron estuvieron entre 90 y 110%, valores establecidos como aceptables para una buena especificidad en ensayos inmunoenzimáticos, lo que demuestra que ninguna de las sustancias que normalmente pueden estar presentes en la muestra interfieren en la capacidad del ensayo para detectar el analito.13,15,16,17
Tabla 2 Especificidad del ELISA para la cuantificación de antitoxina diftérica
| Muestras | Densidad óptica | Concentración de antitoxina diftérica (UI/mL) | R (%) | ||
|---|---|---|---|---|---|
| X | DS | CV | |||
| Suero Patrón | 2,58 | 0,115 | 4,475 | 0,099 | 100 |
| SP + Triglicéridos | 2,895 | 0,091 | 3,166 | 0,098 | 98,99 |
| SP + Colesterol | 2,708 | 0,243 | 8,977 | 0,109 | 110,1 |
| SP + Inmunoglobulina IgG | 2,895 | 0,182 | 6,303 | 0,093 | 93,939 |
| SP + Muestra hemolítica | 2,083 | 0,199 | 9,569 | 0,101 | 102,02 |
X: promedio de las densidades ópticas de los replicados de las muestras
DS: desviación estándar
CV: coeficiente de variación
UI/mL: Unidades internacionales de concentración de antitoxina diftérica por mililitro
R: por ciento de recuperación de la concentración de antitoxina diftérica
SP: suero patrón
Exactitud
Los valores de recuperación que se alcanzaron estuvieron entre 90 y 110%, con un promedio de 103,9% (Tabla 3); se demostró la capacidad del método para dar resultados lo más próximo posible al verdadero valor. El análisis de los datos por la Prueba t para muestras pareadas permitió considerar con un nivel de confianza de 95% que no existieron diferencias significativas (p=0,3425) entre los valores obtenidos y esperados.
Tabla 3 Exactitud del ELISA para la cuantificación de antitoxina diftérica
| Muestras | Valor esperado UI/mL | Valor obtenido UI/mL | Recuperación % |
|---|---|---|---|
| 1 | 0,1252 | 0,1283 | 102,5 |
| 2 | 0,2493 | 0,2522 | 98,85 |
| 3 | 0,136 | 0,1433 | 105,4 |
| 4 | 0,5173 | 0,5638 | 109 |
Valor esperado: concentración conocida de antitoxina diftérica.
Valor obtenido: concentración de antitoxina diftérica mediante el ELISA desarrollado
Promedio de recuperación: 103,9%
Prueba t para muestras pareadas, p=0,3425
Linealidad
Los resultados del ensayo de paralelismo mostraron que el suero patrón y las muestras presentaron un comportamiento similar (Figura 2). Una vez que se corrigieron las concentraciones de las muestras al multiplicar sus valores experimentales por el factor de dilución, el CV fue inferior a 10%, y se demostró que la dilución de las muestras no afectó el resultado final.
Límite de detección
La concentración mínima detectable que generó una respuesta consistentemente mayor que el valor de fondo del ensayo fue 0,0039 UI/mL, determinada después de ensayar el reactivo blanco con 55 réplicas.
Límite de cuantificación
El valor de concentración inferior al valor mínimo de concentración de la curva patrón que fue detectado con una adecuada exactitud y precisión fue 0,015 UI/mL.
Ensayo de comparación de métodos
Al realizar la Prueba t para muestras pareadas no se encontraron diferencias significativas entre las medias de concentración de antitoxina diftérica obtenidas con el ELISA desarrollado (1,335 UI/mL) y las obtenidas por el método de referencia (1,287 UI/mL) en las 62 muestras estudiadas, lo que permitió considerar con un nivel de confianza de 95% que no existieron diferencias significativas (p=0,8785) entre los valores logrados por ambos métodos.
El análisis de correlación (Figura 3) mostró buena medida de ajuste de los resultados alcanzados por ambos métodos. Sin embargo, los resultados obtenidos en el grupo con niveles no adecuados de protección (<0,1 UI/mL) presentaron menor correlación (r=0,91) con el ensayo de referencia, que los del grupo con protección adecuada (>0,1 UI/mL) que presentó r =0,99 y R2 =0,9866.
Discusión
La determinación exacta de la antitoxina diftérica es de gran valor para determinar las tasas de inmunidad dentro de la población o el estado inmunológico de individuos que pueden estar en riesgo de infección, por lo que los métodos a utilizar para ello deben cumplir de forma adecuada con los parámetros de calidad establecidos por las normas regulatorias.
En la curva de calibración es imprescindible que la señal analítica utilizada mantenga una relación proporcional con la concentración.15,16) La curva estándar preparada durante la normalización de la técnica mostró una correcta correlación (R2=0,99) al ser evaluada contra el estándar de referencia (Figura 1). Permitió cuantificar muestras cuyas concentraciones oscilan entre 0,015 y 0,33 UI/mL en una dilución de la muestra de 1/20. La prueba de paralelismo de las muestras ensayadas (Figura 2) mostró el CV por debajo de 10%, por lo que se puede afirmar que la curva es confiable en todos los puntos evaluados, lo cual demuestra la linealidad de la relación dosis respuesta en el rango de trabajo seleccionado.13,15,16,17
En el análisis de la precisión, los coeficientes de variación intraensayo no sobrepasaron 10%, y los interensayos se mantuvieron por debajo de 20% (Tabla 1), lo cual garantizó una adecuada precisión en la determinación de concentraciones de muestras en diferentes zonas de la curva estándar.13,15,16,17
La concentración relativa de los anticuerpos con respecto a otras sustancias incorporadas en el medio no influyó en los resultados. Como se observa en el ensayo de recuperación, el ELISA desarrollado fue capaz de discriminar entre las muestras positivas de antitoxina diftérica y otras sustancias interferentes que se adicionaron al suero (Tabla 2).13,15,16,17
La exactitud indica la capacidad del método analítico para obtener resultados lo más próximo posible al valor verdadero. El recobrado obtenido durante la validación del método normalizado para cuatro muestras diferentes se ubicó desde 98 a 109% (Tabla 3), lo que demuestra la alta exactitud obtenida al encontrarse todos los valores en el intervalo comprendido por ±10% del valor esperado.13,15,16,17
Cuando se compara un método que está siendo validado con uno de referencia usando una recta de regresión, si los dos métodos llevan a resultados idénticos, es obvio que la pendiente debe ser igual a la unidad. La discriminación de muestras con valores de antitoxina diftérica considerados protectores (>0,1 UI/mL) y no protectores (<0,1 UI/mL) fue adecuada con ambos métodos. Aunque en las muestras con concentraciones por debajo del nivel considerado protector determinado mediante ELISA (<0,1 UI/mL) la correlación fue menor (r=0,91), la correlación en general fue buena (r =0,9924) (Figura 3), con un coeficiente de determinación de la pendiente de la recta mayor de 0,984,5) (R2=0,986), lo que garantiza que mediante el método desarrollado es posible cuantificar con adecuada exactitud y precisión muestras con concentraciones desde 0,015 UI/mL. En las muestras con niveles protectores, la correlación entre ambos métodos fue muy buena.
Aunque el principio de ambos métodos es similar, los materiales y reactivos empleados difieren, por lo que la menor correlación entre los resultados de las muestras con concentración de antitoxina diftérica por debajo de 0,1 UI/mL puede deberse a estas diferencias. Uno de los posibles factores que influye en estos resultados podría ser que el soporte sólido del método de referencia son placas de polietileno de alta captación (NUNC) mientras que las placas utilizadas en la validación del método propuesto son de polietileno estándar irradiadas.4,5
La cuantificación de la antitoxina diftérica mediante el ELISA desarrollado, es una valiosa herramienta para determinar el nivel de inmunidad contra la difteria, tanto individual como en estudios de población, así como para evaluar inmunocompetencia, y ofrece ventajas significativas en términos de costo, rapidez en la emisión de los resultados, facilidad de uso y adaptabilidad a la automatización.
Los autores consideran como una limitación de este estudio no haber podido referenciar los sueros utilizados como controles, patrón secundario y los utilizados para evaluar el funcionamiento del ELISA con métodos en vivo como los ensayos de neutralización de toxinas en conejillos de indias o conejos considerados la “regla de oro” para las evaluaciones de estos anticuerpos.
Conclusiones
La adecuada precisión, exactitud, especificidad y linealidad del ensayo inmunoenzimático tipo ELISA desarrollado en el laboratorio de Inmunología del Centro Nacional de Genética Médica, avalan su utilización en la práctica clínica y la investigación para cuantificar los valores de antitoxina diftérica en suero humano.