Introducción
La Enfermedad Injerto Contra el Hospedero (EICH) es el conjunto de reacciones inmunológicas y de manifestaciones histopatológicas y clínicas que se presentan en el receptor de un trasplante de células madre alogénico, el que se encuentra inmunosuprimido, secundariamente a los regímenes condicionantes previos a la realización del trasplante o, en general, siempre que se transplanten células inmunocompetentes a un receptor incapaz de rechazarlas como es en el caso del modelo animal usado para el presente trabajo en el cual el receptor es incapaz genéticamente de rechazar el transplante.
El transplante de células madre alogénico, conocido en la literatura especializada como Trasplante Alogénico de Células Hematopoyéticas (TACH) representa una terapia importante para muchos tumores malignos hematológicos y algunos epiteliales y para un espectro de enfermedades no malignas.1
El desarrollo de estrategias novedosas, como las Infusiones de Leucocitos de los Donantes (ILD), el Transplante de Células Hematopoyéticas No Mieloablativo, (TCHNM) y el Trasplante de Sangre del Cordón Umbilical (TSCU) han ayudado a expandir las indicaciones de la TACH alogénica en los últimos años, especialmente entre los pacientes de mayor edad.2 Sin embargo, la principal reaccion adversa de la HCT alogénica, la Enfermedad de Injerto contra Hospedero (EICH), sigue siendo una complicación letal que limita su aplicación más amplia.3
En dependencia de cuándo ocurra después de la TACH, la EICH puede ser aguda o crónica, por lo que se han desarrollado numerosas alternativas de tratamiento, pero los resultados son muy parciales.4,5,6,7,8,9,10,11 Los modelos de ratón han proporcionado la mayoría de los conocimientos sobre la biología de este complejo proceso de la enfermedad.12
En 6 años, este tipo de trasplantes aumentó un 46 % del total con un gran nivel de subregistro pues proviene de estadísticas de solo 77 países y 1566 equipos de trasplantes; lo cual aunque sea una buena muestra no es ni cercano al total de trasplantes.13)
Si se mantiene en el mundo el mismo nivel de crecimiento de trasplantes, se prevé un aumento sobre los 100 000, más de la mitad alogénicos, de estos, entre 70 y 100 % de los pacientes desarrollarán la entidad, si no reciben manejo profiláctico. La EICH se convierte, entonces, en la más frecuente causa de morbimortalidad para los pacientes alotrasplantados, incluso, supera a las infecciones, la enfermedad venoclusiva hepática y las reacciones medicamentosas y afecta a casi al 100 % de los casos.
Del total de pacientes que desarrollan la EICH, 40 % son refractarios al manejo con esteroides sistémicos, y de ellos, 26 % fallecen.14,15,16 Actualmente, no hay una opción terapéutica adecuada para una enfermedad aguda cutánea refractaria a los esteroides y los efectos de los biológicos anti-Factor de Necrosis Tumoral, no son claros.14,15,16
En otro campo biomédico muy distinto, los adyuvantes inmunológicos, también denominados inmunopotenciadores o inmunomoduladores, son sustancias que se añaden a la formulación farmacéutica de las vacunas para aumentar, acelerar o prolongar su inmunogenicidad.
Más recientemente se ha comprobado que más importante que el aumento de la intensidad de la respuesta, es su direccionamiento hacia uno o varios de los componentes de la respuesta inmune, es decir si aumenta fundamentalmente una respuesta mediada por anticuerpos y cuáles de sus clases y subclases son las que más aumentan, o si aumenta más la respuesta mediada por células, cuáles serían dichas células. Si es predominio de clones de linfocitos T citotóxicos, CTL CD8+ o si son subpoblaciones de linfocitos T Helper o ayudadores y cuál de sus variantes Th1, Th2, Th3, Th17, etc.; o, por el contrario, predomina en la respuesta el tipo linfocito T regulatorio (Treg). En el desarrollo moderno de vacunas en estas sustancias inmunomoduladoras y direccionadoras de la respuesta inmune, recae la mayor parte de la responsabilidad del éxito o fracaso.17
El objetivo del presente trabajo es evaluar dos formulaciones de productos inmunofarmacéuticos novedosos de origen biotecnológico, una de ellas inmunopotenciadora y otra inmunosupresora, desarrolladas como cocleatos.
Material y Métodos
Bioética
Estos estudios de laboratorio de tipo experimental se llevaron a cabo y aún continúan de forma colaborativa entre la Universidad de Ciencias Médicas de la Habana, el Instituto Finlay, el Centro para la Producción de Animales de Laboratorio (CENPALAB), la Escuela Latinoamericana de Medicina (ELAM), y el Instituto de Productos Biológicos de Jianxi, República Popular China (RPCH), desde 2017. En el diseño, implementación y evaluación de trabajos que implicaban el uso de animales de experimentación, se respetaron los principios generales de bioética de refinamiento, reemplazo o sustitución y reducción (RRR), así como la aplicación de Buenas Prácticas en el Manejo de Animales de Laboratorio y Buenas Prácticas de Laboratorio, nacional e internacionalmente recomendadas. Los estudios cuentan con la autorización y aprobación del Comité de Ética de Animales de Laboratorio de CENPALAB y del Instituto Finlay.
Formulaciones evaluadas
Se prepararon partículas liposomales a partir de un complejo de proteínas de Neisseria meningitidis B, de las OMV (Vesículas de Membrana Externa o Proteoliposomas) que constituyen el núcleo activo principal de la vacuna cubana antimeningococcica contra los grupos B y C, VA-MENGOC-BC®18, y que fueron extraídos y purificados sin formar estructuras vesiculares (DP), las cuales fueron ensambladas en una mezcla de los fosfolípidos dioleoil fosfatidil serina (DOPS) y colesterol (Sigma Aldrich Co.UK), utilizando el procedimiento de deshidratación-rehidratación descrito anteriormente,19 para generar nuevas nanopartículas proteoliposómicas designadas como NPL.
Los Cocleatos se obtuvieron mediante la adición lenta de cloruro de calcio (0,1 M) a la suspensión de liposomas preformados.19 Las preparaciones se almacenaron a 4°C y se protegieron de la luz, el vehículo de suspensión emplea el tampón Tris 2 mM, NaCL 150 mM, n-octil-β-D-tiroglucopiranosido (nOG) SIGMA® y se ajusta a pH 7,4).
De todas las formulaciones inmunomoduladoras previamente estudiadas,20 seleccionamos dos como objeto del presente trabajo: una de tipo inmunosupresora y otra inmunopotenciadora de la Respuesta inmune. Ambas en forma de cocleatos:
1) AIF1nCh-15μg de proteína PD (VME) en 25 μL tampón Tris 2 mM, NaCL 150 mM, n-octil-β-D-tiroglucopiranosido (nOG) SIGMA® como detergente, pH 7,4 + LPS integral 1 %. (Formulación pro-inflamatoria o inmunopotenciadora).
2) AIF2nCh-15μg protein PD (VME) in 25 μL buffer Tris 2 mM, NaCL 150 mM, n-Octyl-β-D-Thyoglucopiranoside (nOG) SIGMA® as detergent, pH 7.4, without integral LPS. (Formulación anti-inflamatoria o inmunosupresora)
3) La Formulación control, solo contenía el vehículo.
Evaluación de las formulaciones
Estudios de Microscopía Electrónica
Microscopia Electrónica de Transmisión (MET)
Las imágenes para comprobar el tamaño de las nanopartículas se obtuvieron mediante MET, con un microscopio Phillips CM12. Las muestras se procesaron mediante tinción negativa utilizando el método de gota tradicional. Después de la adsorción de 5 μL de las formulaciones nPL y nCh en una parrilla cubierta con carbón, las muestras se tiñeron con ácido fosfotungstico al 2 % (v / v) y se observaron a un aumento de 100,000X.21,22
Microscopía Electrónica de Barrido
Se aplicó una gota de cada formulación diferente en un portaobjetos de microscopio y se dejó secar a temperatura ambiente durante un período de 12 horas. Más tarde, se cubrieron con una fina capa de oro-paladio y se cargaron en un Microscopio Electrónico de Barrido LEICA 440. Las imágenes se observaron con un aumento de 15X a 290,000X y una resolución de 4.5 nm.21,22
Cuantificación del ARNm de linfoquinas
El análisis de la expresión de los ARNm de INFγ, TNFα, TGFβ e IL-10 se llevó a cabo mediante PCR a tiempo real (RT-PCR, siglas del inglés). 5 camadas de ratones híbridos (CBAxC57BL) fueron inoculados con cada uno de los tres diferentes tratamientos descritos más adelante, que van a ser ensayados en el modelo de GVH, el tratamiento se inició el día 1ro. intranasal a los 10 días de nacidos, el tratamiento fue repetido a los 5to. y 10mo. días. A los 15 días, de cada uno de los grupos de tratamiento se tomaron los bazos, de los cuales se purificaron los esplenocitos según protocolo descrito por Fernández-Botran R y Vêtvicka V (2001).23 Se cultivaron 1x106 células y se estimularon con 12 μg del antígeno PD, en medio RPMI (Roswell Parck Memorial Institute) durante 72 horas.
Posteriormente, las células se colectaron y se les extrajo el ARN total utilizando 1 ml del reactivo TRIzol® (Invitrogen), según protocolo descrito por el fabricante basado en el método reportado por Chomczynski y Sacchi.24 Para la detección de los genes y el análisis de la expresión de los ARNm, se usaron sondas TaqMan (Applied Biosystems, Ca., USA). Los niveles de ARNm para cada muestra se normalizaron con los niveles de expresión del gen del enzima Gliceraldehído-3-fosfato deshidrogenasa (GAPDH). Estos experimentos fueron realizados por triplicado, partiendo de sub-muestras del pool homogéneo de linfocitos de los bazos de cada grupo de tratamiento.
Modelo animal de la GVH-R
El modelo de GVH-R seleccionado fue el del ratón hibrido F1 de líneas isogénicas (CBA♀xC57Bl♂). Los híbridos son inoculados con células de bazo de uno de los dos parentales, en este caso se usan células de la línea materna CBA con el haplotipo H2-k, es decir, de su Sistema Mayor de Histocompatibilidad (H2), los F1 poseen la combinación de aplotipos [H2-k x H2-b] y por lo tanto, están incapacitados genéticamente para responder y rechazar las células parentales, y como estas poseen una alta concentración de células inmunocompetentes provocan la GVH-R en el híbrido. Este modelo genera una reaccion de tipo agudo. Se usan animales SPF, es decir, Libres de Gérmenes Patógenos por sus siglas en inglés, criados en barreras GLP-GMP, es decir, bajo Buenas Prácticas de Laboratorio y de Manufactura.
Cada camada tiene entre 8 y 12 crías y se divide en dos semi-camadas. A una de ellas, de 4-6 crías, fueron inoculados en la cavidad peritoneal con 9x106 células de bazo suspendidas en 100 μl de medio de cultivo, obtenido de la línea parenteral CBA machos de 6 semanas, después del sacrificio por dislocación cervical seguida por homogenización de los bazos. La otra semi-camada, las restantes 4-6 crías, recibió 100 μl de medio de cultivo que contenía 9x106 células de bazo, pero de su misma genética, es decir, F1 de 6 semanas de edad, esa semi-camada funciona como control a los efectos de la GVH-R. 15 días después los animales de las dos semi-camadas son pesados en balanzas analíticas con precisión, sus bazos son extraídos e igualmente pesados e introducidos en la base de datos del experimento. Se calculan el Peso Relativo del Bazo (PRB) y el Índice de Bazo (IB) según las fórmulas siguientes:
PRB=Peso del Bazo (mg)/Peso del Cuerpo (mg)
Media del PRB de la semi-camada inoculada con células CBA= ∑ de todos los PRB de cada animal de ese subgrupo/Número de animales.
Media del PRB de la semi-camada inoculada con células F1, control=∑ de todos los PRB de cada animal de ese subgrupo/número de animales.
Índice de bazo IB= Media del PRB de la semi-camada inoculada con CBA/media de la semi-camada control.
Índices de Bazo superiores a 1,3 son indicadores inequívocos de EICH aguda.
Tratamiento aplicado
Los días: 1ro., día de la inducción de la GVH-R, al menos 4 horas antes de inducir la GVH-R; 5to. día y 10mo. día, a todos los animales de ambas sub-camadas se les inoculó por vía intranasal con una micropipeta las respectivas tres dosis del tratamiento a razón de 25µL de volumen máximo por fosa nasal y por aplicación, las concentraciones fueron ajustadas para que en esos volúmenes máximos fueran contenidas las dosis en estudio. Cada variante de tratamiento fue ensayada en 10 camadas de híbridos F1, para cada dosis del tratamiento inmunosupresor, (4 dosis, 40 camadas). [50μg/dosis, 5 μg/dosis, 500ng/dosis, 50ng/dosis, las dosis son referidas al contenido de proteína PD]. 10 camadas para el inmunoestimulante, una sola dosis y 10 para el control, la asignación fue a ciegas, los rótulos de las formulaciones fueron codificados de manera independiente de los aplicadores, el código fue depositado y no se abrió hasta tener los resultados finales del estudio igualmente depositados.
Sesenta camadas de ratones F1 de 10 días de nacidos fueron divididos en 6 grupos; cuatro grupos para el tratamiento inmunosupresivo con las 4 dosificaciones diferentes (40 camadas) y el grupo con tratamiento inmunoestimulador con una sola dosis (10 camadas) respectivamente y el grupo de los controles con una dosis (10 camadas). Todos los tratamientos se realizan sobre ratones a los cuales se les indujo la GVH-R. (Tabla 1)
Chequeo sistemático de la salud de los animales
Se realizó la atención técnica y clínica veterinaria a los animales de experimentación de manera general y para corroborar la seguridad y evaluar la reactogenicidad de tratamientos y manipulaciones, se observó y documentó su comportamiento, incluyendo consumo de agua y alimentos, los cuales fueron colocados ad libitum, y monitoreo del peso corporal y todos los parámetros del protocolo.
Análisis estadístico de los datos experimentales
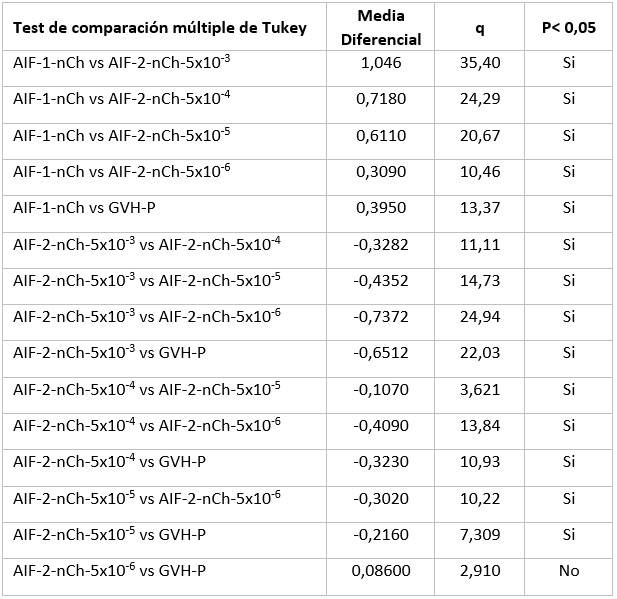
Se utilizaron el programa estadístico de IBM, SPSS V.22 y el editor de gráficos del paquete Microsoft Excel versión 2010. En todas las variables, la normalidad se evaluó mediante la prueba de Kolmogorov-Smirnov (alfa = 0,05 %) y la homogeneidad de la varianza mediante la prueba de Levene. Se aplicó ANOVA y se realizaron comparaciones múltiples con la prueba de Tukey. Las diferencias fueron consideradas significativas cuando p ≤0.05.
Resultados
Evaluación de las formulaciones
Microscopia electrónica
En la figura 1 A, se muestran los proteoliposomas originales, o VME-NMB, material de partida para obtener las formulaciones nanoparticuladas usadas en el presente trabajo, en B los proteoliposomas obtenidos y que son estructuralmente la base de estas dos formulaciones en estudio, y en C se muestran los cocleatos obtenidos a partir de dichos proteoliposomas.

Fig. 1 Imágenes fotográficas obtenidas por microscopía electrónica A y B: transmisión (TEM), microscopio PHILIPS CM-12, ampliación: 150,000x y 500,000X y voltaje: 100 y 60kV, respectivamente. Micrografía C: Escaneo Microscopio electrónico (SEM) LEO-440 VP, aumento: 100,000X. Micrografía A: Se observan estructuras nanométricas con la forma de los proteoliposomas, con diámetro 50-80nm.Corresponde a las VME-NMB. Micrografía B: Se observan proteoliposomas con diámetro promedio de 45nm. Micrografía C: Se observan estructuras alargadas con forma de cóclea de torcido final puntiagudo. B y C evidencian los controles del tamaño nanométrico y morfología de las nuevas formulaciones en estudio.
Las imágenes de los proteoliposomas fueron obtenidas por MET y la imagen de los cocleatos mediante MEB. Es posible apreciar la forma esférica de los proteoliposomas y su homogeneidad. Mientras que los proteoliposomas originales de la vacuna, VME-NMB, tienen un diámetro promedio de 50-80 nm, los nuevos proteoliposomas poseen un diámetro promedio de 45nm. Los cocleatos fueron formados por la transformación de liposomas obtenidos previamente mediante la adición de sales de calcio; puede observarse que se obtiene un tipo de estructura alargada y continua, similar a un cigarrillo puntiagudo, con múltiples capas formado al enrollarse los proteoliposomas cuando los iones de calcio unen las cargas negativas de sus membranas.
Regulación de la expresión de ARN m de las citoquinas: IL-10, TGF β, INFγ y TNFα, ejercida por las formulaciones AIF-N.m-1 y 2, en cultivos de células de bazo de ratones (CBAxC57BL) F1 tratados.
En la figura 2, se representa el incremento o disminución de cada una de estas citoquinas con respecto al valor de expresión de la misma molécula en las células del bazo de los animales del grupo control negativo (CN) y comparándose con un control positivo (CP). La expresión de cada uno de los ARNm se normalizó en relación con el gen de la enzima gliceraldehído 3 fosfato deshidrogenasa (GAPDH).

Fig. 2 Niveles de expresión de los genes de IL-10, TGFβ, INFγ y TNFα en células de bazo de ratones F1 (CBAxC57BL) tratados con las formulaciones inmunomoduladoras AIF-1-nCh (Proinflamatoria) y AIF-2-nCh (Supresora-reguladora) por vía IN, el control positivo fueron las VME-NMB, y el control negativo CN: grupo de ratones no tratados. Las células de los bazos de los animales de cada grupo se extrajeron a los 15 días después de iniciado el tratamiento, se cultivaron en medio RPMI y se estimularon con 12 µg de PD, durante 72 horas. La expresión de los ARNm se analizó por RT-PCR, usando sondas TaqMan, los niveles de expresión se normalizaron con el gen de la enzima GAPDH. Los números en las barras indican los niveles de expresión relativa de cada citoquina con respecto al control negativo y se muestran en escala logarítmica.
Las citoquinas pro-inflamatorias INFγ y TNFβ incrementaron su expresión en los grupos de animales tratados por vía nasal con AIF1nCh, y con Vesículas de Membrana Externa de Neisseria meningitidis B, usadas como control positivo por esta vía mucosal de inoculación. (VME-NMB). El incremento del ARNm de INFγ en el grupo tratado con AIF1nCh fue considerablemente mayor con respecto al inducido por las VME-NMB; la inducción de ARNm de TNFβ fue inducido al mismo nivel por estos dos tratamientos mientras que los niveles de ARNm de TGFβ e IL-10 son nulos en la VME y marginales en AIF1nCh. Cuando se administra AIF2nCh por la ruta IN, aumentan los niveles de ARNm de a IL-10 y el TGFβ, ambas son citoquinas que favorecen la activación de células T reguladoras (Tr). Esta formulación también ejerce una regulación negativa o disminución de la expresión del ARNm del TNFα.
Tratamiento de la EICH con las formulaciones supresora y potenciadora respectivamente.
La figura 3 muestra gráficamente un resumen de los resultados; aparece en orden de izquierda a derecha el resultado del grupo tratado con la formulación proinflamatoria o inmunoestimulante, AIF1nCh. Las siguientes cuatro barras de la figura 3 indican los resultados de los tratamientos con la formulación supresora-reguladora, AIF2nCh, a cuatro dosis decrecientes con un factor de dilución de base 10 en escala logarítmica.

Fig. 3 Resultados de los tratamientos potenciador y supresor sobre la EICH. Cada una de las 6 barras de la figura representa los valores medios de los índices de bazo (IB) indicadores del nivel de EICH de cada grupo de animales, en cada caso 10 camadas (100-120ratones). El análisis estadístico se realizó utilizando un análisis de varianza de una vía (ANOVA) seguido de la prueba de comparaciones múltiples de Tukey. Letras diferentes denotan diferencias significativas entre los resultados del grupo (p <0.001 **) entre los grupos III y IV, y p</=0,0002*** para el resto de los grupos diferentes. El grupo V no resultó diferente del VI; ese tratamiento a esa dosis no tuvo efecto.
La barra en la extrema derecha de la figura 3, representa el resultado obtenido con el grupo de animales que recibió el Placebo como tratamiento es decir la EICH sin ser modificada, valor contra el cual se comparan cada uno de los tratamientos.
La formulación proinflamatoria o inmunoestimulante, AIF1nCh, fue ensayada en este trabajo a la dosis de 50 microgramos y con su aplicación fue alcanzado el aumento significativo del IB=2.05 el cual en comparación con el grupo placebo es significativamente diferente, p=0.0002.
La formulación supresora, AIF2nCh, la probamos usando cuatro dosis distintas con un factor exponencial de dilución de una a otra. Con la dosis de 50 microgramos se alcanzó el mayor efecto de supresión de la EICH con un IB=1.1, y una diferencia significativa con el control no tratado o placebo, p=0.0002. Las siguientes dos dosis ensayadas (5 microgramos y 500 nanogramos) también suprimieron la EICH de manera dosis dependiente con IB=1,41 y 1,49, y con significación estadística, respectivamente; p=0,0002 y p=0.0003. La dosis más baja, 50ng, provocó un fenómeno contrario al esperado al provocar un aumento del IB=1,82, aumento visible y consistente, con respecto al grupo control placebo, pero no fue estadísticamente significativo, p>= 0,05.
La dosis de 50ng arrojó un resultado sin diferencia significativa con el grupo control no tratado, p>0,05, límite del diseño experimental.
El grupo control que recibió el Placebo como tratamiento, es decir la EICH no tratada, tuvo un IB de 1,72.
Análisis de varianza de una sola vía, funcionó a la mayor significación estadística, p=/<0,0002 para diferenciar todos los grupos excepto los de las dosis de 5 microgramos y la de 500 nanogramos, también significativamente diferentes pero con un nivel menor de significación. p=/<0,0003. Prueba de Bartlett para varianzas iguales. Estadística de Bartlett (corregida) 31,19. Valor de p <0,0001. (Tabla 2)
Chequeo sistemático de la salud de los animales
Fue auditada y evaluada la documentación con el seguimiento sistemático de la salud de los animales de experimentación.
Discusión
Evaluación de las formulaciones
Microscopia electrónica.
Los nuevos proteoliposomas (NPL), a partir de los cuales se obtuvieron las formulaciones en forma de cocleatos para su uso por vía nasal, fueron obtenidos tomando materia prima a las Vesículas de Membrana Externa (VME) o proteoliposomas originales de la vacuna cubana antimeningocóccica BC, VA-Mengoc-BC. Dos nuevos tipos de proteoliposomas con diferente composición fueron obtenidos y estos fueron transformados en cocleatos. Tanto la formulación AIF1nCh, como AIF2nCh, poseen igual estructura en cuanto a su imagen en microscopia electrónica de este tipo y las imágenes resultantes son indistinguibles entre sí, tanto los NPL del primer paso como los cocleatos obtenidos en el segundo paso. Las diferencias entre una y otra radican en el nivel molecular más fino que explica mecanismos diferentes; uno de activación y potenciación proinflamatoria y otro supresor-regulador. En trabajos sub-siguientes abordaremos los mecanismos de acción y estructuras más finas.
En la Fig.1C se muestran las estructuras cocleares obtenidas con diámetro inferior a 100 nm y longitud media de 7 micras; pero lo definitorio para cumplir su papel inmunomodulador se ha comprobado que es el diámetro, ya que los cilindros pueden ser fraccionados en fragmentos de longitud mucho más pequeños y su actividad es estable, en la mayoría de los casos estudiados, y este tipo de formulaciones ya fue ensayado antes en otros sistemas de prueba. Estudios anteriores de nuestro grupo y una revisión de otras experiencias así lo demuestran.20,21,22
Lo más relevante de este paso evaluativo de las formulaciones obtenidas fue comprobar su consistencia, homogeneidad, y carácter nanométrico en comparación con las experiencias de nuestro grupo, lo mejor de las experiencias de otros grupos y asegurar que los pasos que damos sean susceptibles de ser llevados a niveles superiores de desarrollo farmacéutico y médico.
Regulación de la expresión de ARN m de las citoquinas: IL-10, TGF β, INFγ y TNFα, ejercida por las formulaciones AIF-N.m-1 y 2, en cultivos de células de bazo de ratones (CBAxC57BL) F1 tratados.
La unión de las Células Presentadoras de Antígenos (CPA) a través de los Receptores de Reconocimiento de Patrones, por sus siglas en inglés, (PRRs) con los Patrones Moleculares de Patogenicidad y otras señales internas y externas de peligro (PAMPs /DAMPs) de los microorganismos o vacunas o de células o moléculas resultantes del daño tisular, debido a la reacción de rechazo o daño de un órgano o tejido, dispara una cascada de señales que implica la activación de factores de transcripción en las células de la inmunidad adaptativa, fundamentalmente en los linfocitos T, las cuales a su vez, inducen la producción de citoquinas y quimoquinas pro-inflamatorias, anti-inflamatorias y/o reguladoras de la respuesta inmune.17
Entre las citoquinas que pudieran inducirse, debido a dicha activación-supresión, se investigaron en este trabajo, por su importante papel en la definición del perfil o tipo de patrón de linfoquinas que inducen las formulaciones estudiadas: el INFγ y TNFα , como pro-inflamatorias, y como antiinflamatorias y/o reguladoras: la IL-10 y el TGFβ; se determinó con este fin, mediante RT-PCR la expresión de los ARN mensajeros en las células del bazo de los animales tratados, después de ser cultivadas y estimuladas con el antígeno PD, durante 72 horas.
El tipo de citoquina que se produce de manera dominante, como resultado de la activación del linfocito TCD4+ virgen (Th0), determina el ambiente de diferenciación hacia una sub-población u otra de linfocitos Th y el tipo de respuesta inmune adaptativa que predominará. Varios patrones coexisten en la RI: celular, humoral o regulador, definidos por el predominio de los linfocitos Th1, Th2 o Tr, respectivamente; sin embargo uno prevalece sobre los otros, dependiendo de la estimulación antigénica provocada por los patógenos o por las señales de peligro responsables de las enfermedades, o rechazo de órganos y especialmente en el caso de las vacunas por la formulación utilizada.17
La administración por vía IN de las VME-NMB, conlleva a que se sobre expresen las citoquinas TNFα e INFγ; sin embargo, disminuyen las antiinflamatorias IL-10, TGFβ. La formulación pro-inflamatoria o estimulante AIF1nCh indujo un patrón tipo Th-1 dominante. Nuestros resultados coinciden con los obtenidos anteriormente por nuestro grupo, y con los obtenidos por otros investigadores, acerca de la inducción con predominio del patrón Th1cuando se aplican las VME y otros derivados de estas como vacuna y/o como adyuvantes;17,20,21,22 por vía sistémica o mucosal y apuntan además, a que las proteínas, fundamentalmente las porinas, reconocidas por los TLR2 y proteínas de alto peso molecular como 70 y 80K, mayoritarias en la preparación PD, contribuyan también de manera decisiva a la polarización de la RI hacia Th1. También el LPS considerado el principal PAMP de las bacterias Gram - y que es reconocido por el TLR4.
En todos los casos, el uso de esta formulación propició la secreción de INFγ, a través de la inducción de la maduración de las células dendríticas, un patrón predominante Th1. Nuestros resultados no solo confirman los de estos investigadores sino también informan que estas moléculas empleadas como PAPMs también inducen en menor grado IL-10 y TGFβ, citoquinas producidas por las células Treg. De esta manera, se evidencia el balance de la RI hacia un patrón Th1/Regulatorio dominante y más potente que el reportado hasta el momento.17,20,21,22
Con la aplicación de AIF2nCh se incrementó la expresión de genes de TGFβ e IL-10, ambas citoquinas de conocidos efectos antiinflamatorios y/o reguladores de la RI y además se suprimió la producción de TNFα, anulando el ambiente pro-inflamatorio más radicalmente. En este caso, solo nuestro grupo ha mostrado resultados previos, Tamargo y colaboradores demostraron que esta última formulación induce un patrón con franco predominio regulatorio-supresor.17,20
En trabajos previos de nuestro grupo ha quedado evidenciada la potencialidad de estas formulaciones para la aplicación como adyuvantes de vacunas.12,15,16,17 En el presente trabajo se realiza la caracterización de una formulación tipo supresora-reguladora y otra formulación tipo pro-inflamatoria o inmunoestimulante en el modelo de ratón F1 de EICH.
Tratamiento de la EICH con las formulaciones supresora y potenciadora respectivamente.
El modelo de EICH basado en el ratón hibrido F1, de las líneas isogénicas (CBA♀xC57Bl♂) ha sido bien caracterizado y es muy consistente, por lo que sus resultados son de gran confiabilidad por su gran reproducibilidad. El grupo control que recibió el Placebo como tratamiento, es decir la EICH no tratada, tuvo un IB de 1.72, el cual corresponde con nuestras series históricas con la potencia de la inducción realizada con 9x106 células de bazo del parental, y se confirma como un indicador confiable de una franca y aguda EICH.
La formulación supresora, AIF2nCh, la probamos usando cuatro dosis distintas con un factor exponencial de dilución de una a otra. [50μg/dosis, 5 μg/dosis, 500ng/dosis, 50ng/dosis], las cuales fueron aplicadas cada una dividiéndolas en cada ventana nasal en solo 50 microlitros de volumen por aplicación, y el tratamiento se aplicó el mismo día, 4 horas antes de la inducción de la EICH y después el 5to. y el 10mo. días post-inducción, y los índices de bazo se determinaron el día 15vo. El tratamiento es no reactogénico y seguro. Con la dosis de 50 microgramos se alcanzó el mayor efecto de supresión de la EICH con un IB=1,1 y una diferencia significativa con el control no tratado o placebo, p=0.0002.
Las siguientes dos dosis ensayadas (5 microgramos y 500 nanogramos) también suprimieron la EICH de manera dosis dependiente con IB=1.41 y 1.49, y con significación estadística, respectivamente; p=0.0002 y p=0.0003, a pesar de ser hasta dos órdenes exponenciales de dilución progresiva, esto confirma la potencia del preparado y la sensibilidad del modelo escogido, ya en la dosis de 500ng la significación estadística aunque elevada comenzó a decaer y en la siguiente dilución un orden logarítmico en base 10 más diluida resultó no efectiva. Es decir, que en este modelo el efecto más pequeño que podemos medir para esta sustancia está entre esas dos dosis límites.
La dosis más baja provocó un fenómeno contrario al esperado al producir un aumento del IB=1.82, aumento visible y consistente, con respecto al grupo control placebo, pero p>= 0.05. Es decir, esa dosis ya no es capaz de causar una supresión. Se requieren estudios más detallados para establecer las dosis requeridas en el modelo y después para sus extrapolaciones a otros modelos, pero el presente estudio brinda una fuerte sugerencia sobre el carácter inmuno supresor de esta formulación.
Con la dosis de 50μg no solo se logró la mayor supresión del IB sino que la EICH fue completamente suprimida, las otras dosis solo bajaron significativamente el IB de manera dosis dependiente y con significación estadística alta pero no pasaron el umbral de eliminación total de la EICH.
José L. Cohen y colaboradores demostraron la utilidad terapéutica de las células CD4+ CD25+ Treg, trasplantadas en modelos de GVHD.25 Nuevos conocimientos refuerzan la importancia de estos resultados.26 Existe polémica y también resultados contradictorios con la aplicación terapéutica de estas células Treg y el alcance de los mecanismos implicados;27 sin embargo toda la lógica del sistema inmune y la inmensa mayoría de los resultados apoyan el papel del eje regulador en el control de la EICH.28,29,30,31,32,33,34
Los aloantígenos del hospedador son reconocidos por primera vez por las células T del donante y éstas se activan y desencadenan en el proceso de la EICH. Un desequilibrio entre Tregs y Th17 también interviene en el proceso patológico. Tregs pueden suprimir una amplia gama de tipos de células, incluidas las células B, células T, células presentadoras de antígenos, APC y células NK de manera no restringida por el sistema mayor de histocompatibilidad, MHC.
El empleo como terapia experimental de las células Treg para suprimir la EICH, que ocurre como consecuencia del TCMH, ha sido bien demostrado en estudios preclínicos y también están en marcha los primeros Ensayos Clínicos Fase I.24,26 Las células Treg, como reguladores negativos de las respuestas inmunes al aloantígeno, aloantígeno específicas, son críticas para mantener la tolerancia específica y frenar la reaccion base de la EICH. Las Treg inhiben fuertemente la división, expansión y diferenciación de las células T del donante y podrían proteger tanto la EICH aguda como crónica. La función principal de estas células se realiza a través del perfil de citoquinas que secretan y mantienen sobre todo basado en IL-10 y TGFβ, precisamente el perfil de citoquinas que ha logrado mantener la formulación supresora-reguladora usada en este experimento, AIF2nCh.
Otros investigadores;35,36 que estudian los efectos de la IL-33 sobre la EICH han encontrado que posee propiedades antiinflamatorias cuando se aplica antes de que el daño tisular debido a la EICH se haya consumado.
En ese caso la IL-33 inducen expansión de células CD4 + CD25 + FoxP3 + regulador-supresoras TCélulas (Tregs), que expresan el receptor de interleucina-33 (supresión de la tumorigenicidad 2 [ST2]), por el contrario, la administración de interleucina-33, durante la evolución de GVHD promueve la expansión de células T productoras de interferón-γ que conducen a una GVHD aguda; mientras que el bloqueo del eje interleucina-33-ST2 puede reducir los niveles de las citoquinas pro-inflamatorias y la intensidad de GVHD aguda.
La formulación de carácter regulador usada en nuestro trabajo en la terapia de la EICH, induce en su mecanismo de acción un perfil de citoquinas igual que las que se inducen con el uso terapéutico de las células Treg CD4+ CD25+FoxP3+, es decir un patrón regulador-supresor. En dicho tratamiento está incluida una dosis temprana 4 horas antes de la inducción de la EICH y después el tratamiento incluye dos dosis más al 5to. y 10mo. días, lo que mantiene el perfil regulador y pudiera actuar de igual modo, ya que se hace antes de que el daño tisular esté consumado y disparada la tormenta de citoquinas hiperaguda. Mediante el empleo de la formulación potenciadora o pro-inflamatoria se amplió la demostración de su perfil y se corroboraron los resultados anteriores del grupo,12,15,16,17,27) lo cual refuerza su potencial aplicación como adyuvante vacunal cuando ese perfil se necesita y además su potencial como terapia, en casos que requieren la inducción de un patrón Th-1 en una fase del tratamiento.
Chequeo sistemático de la salud de los animales
Fue corroborada la seguridad y la ausencia de reactogenicidad de las formulaciones ensayadas, y en especial la ausencia de trastornos o complicaciones derivados del tratamiento nasal-mucosal. En los animales solo fueron observados y después comprobados en las necropsias, los procesos derivados del propio modelo de EICH el cual tenemos muy bien caracterizado. Fueron ratificados los resultados anteriores del grupo que establecen esta seguridad toxicológica y ausencia de reacciones inaceptables.17,20,21,22,37,38
Conclusiones
El modelo de GVH-R muestra aplicabilidad en la cuantificación y análisis de la capacidad adyuvante inmunopotenciadora e inmunomoduladora supresora-reguladora in vivo así como las potencialidades inmunoterapéuticas en la GVH-D y en Vacunología de las formulaciones cocleares experimentales en fase de desarrollo. El estudio realizado puede ser complementado con el uso de otras técnicas moleculares como el RT-PCR y la Microscopia Electrónica, que incrementarían su capacidad analítica e integradora.
AIF1nCh y AIF2nCh tienen potencial aplicación en los campos de la terapia de EICH, en otras patologías y en Vaccinología. Los resultados obtenidos en el presente trabajo fundamentan la conveniencia de continuar el desarrollo farmacéutico y completar la preclínica de ambas formulaciones.