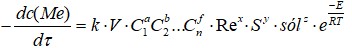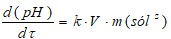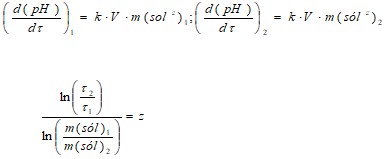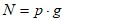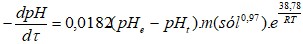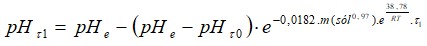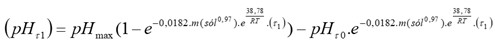INTRODUCCIÓN
En los últimos años se ha hecho cada vez más creciente la preocupación por la protección y conservación del medio y sus recursos naturales (Bustillo & López, 1996). Unas de las causas fundamentales del deterioro y agotamiento de estos recursos en el municipio de Moa están ocasionados por el uso del cieno coralino procedente de los arrecifes de la bahía de Moa como materia prima en las empresas productoras de níquel y cobalto (Granda, 1986; Leal & Martin, 1988; Sosa-Martínez & Bassas, 2001; Cueto, 2005; Mulet-Hing et al., 2023).
Durante el proceso de lixiviación ácida a presión la cantidad de ácido empleada para la extracción del mineral niquelífero se encuentra sustancialmente en exceso con respecto al estequiométricamente necesario, lo que trae consigo la obtención de licores lixiviados con alto grado de acidez (pH inferior a 1,6) el cual se debe ajustar a valores entre 2,4 y 2,6 para la precipitación eficiente de los sulfuros de níquel y cobalto.
Cueto (2005) propone neutralizar el licor reducido de la planta de neutralización del proceso ácido con sólidos residuales o colas provenientes del proceso carbonato amoniacal, aplicado también en Moa. Su estudio se realizó a escala de laboratorio, en un reactor de dos litros, bajo un régimen de agitación, caracterizado por valores de Reynolds (Re) iguales a 16 500, 20 500 y 24 500; para ello se utilizó el residual como agente neutralizante, con una relación ácido-magnesio de 0,67 g/g; 0,87 g/g y 1 g/g, con temperaturas de 500C, 60C, y 70 0C, para valores de tiempo de 15, 30 y 45 min, obteniéndose unidades de pH iguales a 2,11; 2,35 y 2,45 ya optimizados y procesados estadísticamente.
Sosa-Martínez (2006) trata el licor residual con métodos químicos de precipitación selectiva, sentando las bases para la presente investigación. Se utiliza el sulfuro de sodio como agente precipitante, en concentraciones desde 0,1 mol/L hasta 1 mol/L y a temperatura ambiente (273 K). Obtiene porcentajes de recuperación cercanos a 45 para el zinc, 50 para el cobre, 67 para el níquel y 65 para el cobalto. Al agregar, en estas mismas condiciones, otros agentes precipitantes como el hidróxido de amonio y el hidrogenosulfuro de amonio alcanza recuperaciones de 65 %, 60 %, 69 % y 70 % en ese orden para el zinc, cobre, níquel y cobalto.
Para comprobar el precipitante hidrogenosulfuro de sodio, Sosa-Martínez & Bassas (2006) utilizan concentraciones de 0,1 mol/L; 0,5 mol/L y 1 mol/L, temperaturas de 298 K y 313 K, así como una frecuencia de agitación entre 135 rpm y 255 rpm. Los valores de recuperación de fueron en ese caso de 65 %, 60 %, 69 % y 70 % para el zinc, cobre, níquel y cobalto, respectivamente, todas superiores a las obtenidas con el sulfuro de sodio. Esos resultados permiten establecer los rangos óptimos de pH y las concentraciones adecuadas para la precipitación selectiva de los sulfuros metálicos de las especies ya nombradas a partir del licor ácido de desecho.
Entre las investigaciones que ahondan en la neutralización de residuos ácidos destacan las publicadas por Guerra-Pérez (2015); Pérez-Rosales (2015); Parejo-Gutiérrez (2021); Alegre-Jara & Tresierra-Aguilar (2023); Arteaga-Gómez & Gutti-Jara (2023); Arbona-Cabrera et al. (2023); Cortez-Velasquez & Paz-Calvo (2023); Chávez-Aguilar (2023) y Alegre-Jara & Tresierra-Aguilar (2023) y Madeira et al. (2024).
La presente investigación se realizó con el objetivo de sustituir, en el proceso de neutralización del licor ácido de la industria cubana del níquel, el cieno carbonatado por los polvos residuales de la industria del mármol como agente neutralizante para disminuir el impacto medioambiental negativo y lograr mayor eficiencia económica del proceso de lixiviación ácida que conlleve un mejor aprovechamiento de los recursos naturales.
MATERIALES Y MÉTODOS
Materiales, reactivos y equipos
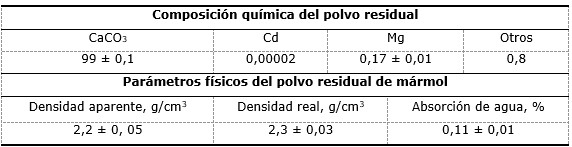
Se empleó el carbonato de calcio residual con un 99 % de pureza, licor ácido con una concentración de 15 g/L de ácido sulfúrico libre, tamices de 200 mesh y 100 mesh, balanza digital, beaker de 1L de capacidad, erlenmeyer, embudos, papel de filtro, bomba de vacío, pH-metro digital HI 90 23 C, picnómetro, termómetro, plancha eléctrica y agitador mecánico de cuatro paletas planas. Las condiciones del equipamiento fueron comprobadas por el Instituto de Metrología y control de la calidad de la provincia de Holguín, Cuba.
Condiciones de trabajo
La composición química media del licor ácido se muestra en la Tabla 1. El licor utilizado de la tecnología ácida a presión procede de la planta de lavaderos y tiene las características siguientes: ácido libre: 15 g/L; pH: 1,9; sólidos en suspensión: 0,6 g/L (600 ppm) (valor máximo). Las muestras de licor se tomaron cada ocho horas durante 30 días. Se escogió como agente neutralizante el carbonato de calcio residual del mármol (Tabla 2), atendiendo a sus características químicas, físicas y precio favorable.
Se empleó Espectrofotometría de Absorción Atómica, de Emisión por Plasma Inductivamente acoplado y método volumétrico de valoración con hidróxido de sodio. Los análisis se realizaron en los laboratorios del Centro de Investigaciones del Níquel (CEDINIQ), en Moanickel. S.A., Empresa productora de Ni y Co Ernesto Che Guevara y en la Universidad de Moa.
Metodología para el cálculo del pH teórico de neutralización del licor ácido
A partir de la expresión 1, se calcularon los valores teóricos de pH para el proceso de neutralización del licor ácido (Levenspiel 1986)
Donde: c(H3O+): concentración de iones hidronio.
Metodología para el cálculo de la cinética del proceso de neutralización
La cinética del proceso metalúrgico ofrece la posibilidad de conocer su velocidad, así como la incidencia en este de múltiples factores. El proceso de neutralización de licores ácidos es un proceso heterogéneo, el cual transcurre en dos etapas fundamentales:
Difusión del ácido libre desde el volumen de la solución hasta la superficie del sólido.
Reacción química.
Las etapas difusivas 1 y 2 pueden ocurrir en dependencia de las características del agente neutralizante y la formación o no durante la operación de una nueva fase sólida (Zelikman et al., 1975; Perry´s & Chilton, 1999; Levenspiel, 1986). La cantidad de ácido libre neutralizado en la unidad de tiempo depende de la temperatura y la masa de sólido presentes en el proceso. Este puede estar limitado por la difusión, por la reacción química o por ambas a la vez.
En el primer caso tendría lugar en un régimen difusivo, caracterizado por un pequeño valor de energía de activación; la velocidad del proceso podría incrementarse con el aumento de la temperatura y la adición de agente neutralizante. En el segundo caso la reacción tendría lugar en la zona cinética donde la energía de activación alcanza mayor valor y afectada fundamentalmente por la variación de la temperatura. Puede ocurrir un tercer estadio, siendo este una situación intermedia entre los casos anteriores, también llamada etapa transitoria (Zelikman et al., 1975).
Metodología del método cinético de investigación
El método de estudio cinético del proceso de neutralización a escala de laboratorio tiene como fin determinar la velocidad de las transformaciones físico-químicas, así como la influencia de los parámetros de estudio, expresado a través de una ecuación que describe el modelo cinético. Teniendo en cuenta que es un proceso heterogéneo y complejo, se partió de la expresión cinética general (Zelikman et al., 1975; Dobrojotov, 1988; Sosa-Martínez, 2006; Sosa-Martínez & Bassas, 2006).
Donde:
dc(Me): Contenido del metal en el sólido (%)
k: Constante de velocidad
C1, C2, Cn: Concentración de los reactivos 1, 2 - n (g/L)
E: Energía de activación (kJ/mol)
R: Constante universal de los gases (kJ/mol·K)
T: Temperatura (K)
V: Volumen utilizado (L)
S: Superficie (mm2)
Sól: Contenido de sólido (%)
Re: Número de Reynolds
a, b, f, x, y, z: Coeficientes empíricos
A partir de los resultados experimentales, según el diseño empleado, se realiza el análisis individual de cada factor. Para obtener la influencia de la masa de sólido se utiliza la expresión 3. Y para la influencia de la temperatura, la 4.
a) Para determinar el coeficiente ´z´ se parte de la expresión 3, para los tiempos 1 y 2. Se plantea la expresión, se simplifica, se aplica logaritmo neperiano y se obtiene la expresión 5:
b) Para determinar el coeficiente E se parte de la expresión 4, para los tiempos 1 y 2. Se plantea la expresión, se simplifica, se aplica logaritmo neperiano y se obtiene la expresión 6:
Diseño de experimentos
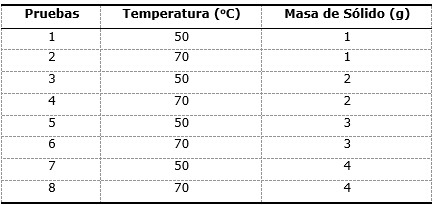
Para el diseño de la matriz se utilizó el método factorial multinivel, basado en las posibles combinaciones entre las variables de estudio y los niveles escogidos. Se estudiaron dos factores (temperatura y masa de sólido) con dos y cuatro niveles, respectivamente, quedando de la siguiente manera (7) la cantidad de pruebas (N) a realizar (Ángel-Gutiérrez, 2007)
Donde:
N: número de experimentos
p: niveles del factor temperatura
g: niveles del factor masa de sólido.
Los cálculos indicaron realizar ocho pruebas. En la Tabla 3 se muestran los factores y niveles utilizados en los experimentos. A partir del diseño de experimentos se realiza la matriz experimental descodificada (Tabla 4).
Procedimiento experimental
Se tomó un volumen de 1000 mL de licor ácido con un pH inicial de 1,9 unidades, se añadió carbonato de calcio residual de la industria del mármol en un rango de masas comprendidas entre 1 g y 4 g; en el reactor, se fijó la frecuencia de agitación a 68 rpm y se alternaron los valores de temperatura 50 ºC y 70 ºC para cada prueba experimental. Con la instalación de vacío adjunta al reactor se extrajeron muestras y se filtraron. Al líquido clarificado separado se le determinó el valor de pH, para conocer la concentración de ácido sulfúrico neutralizado por unidad de tiempo.
Metodología de análisis estadístico-matemático
Para demostrar la veracidad de los resultados experimentales y comprobar el comportamiento de los diferentes factores, se realizó un análisis estadístico-matemático, utilizando el software STATGRAPHICS 5.1 plus y Microsoft Excel. Se aplicó la metodología explicada por Ángel-Gutiérrez (2007).
RESULTADOS Y DISCUSIÓN
Influencia de la masa de sólido sobre la variación del pH en el proceso de neutralización del licor
La influencia de la masa de sólido sobre el pH durante la neutralización del licor ácido se evaluó en las condiciones experimentales determinadas.
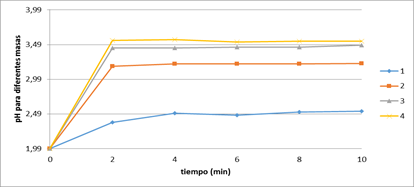
En la Figura 1, se muestran las curvas determinadas para 1, 2, 3 y 4 g de masa de sólido a una temperatura de 50 oC, donde se aprecia que en los dos primeros minutos existe un incremento considerable de los valores de pH, en todos los casos, a partir de ese tiempo los valores de pH permanecen prácticamente constantes. Con los resultados anteriores se determinó el coeficiente empírico en función del contenido de sólido, según la ecuación 5.
Influencia de la temperatura sobre la variación del pH en el proceso de neutralización del licor
La Figura 2 refleja la influencia de la temperatura sobre la variación de pH. Las variaciones del pH a temperaturas de 70 ºC son inferiores a las que se alcanzan a 50 ºC.
Como regularidad, en las curvas de pH a diferente temperatura se aprecia un incremento brusco de esta durante los primeros dos minutos, posteriormente una estabilización a partir de los cuatro minutos; siendo más pronunciado para el menor valor de temperatura. En la Figura 2 se observan ligeras diferencias, por lo que se puede afirmar que el factor temperatura no ejerce gran influencia en el proceso de neutralización del licor ácido con polvo residual de mármol.
Se obtuvo la energía aparente de activación del proceso, según la ecuación (6). El valor obtenido demuestra que el proceso ocurre en un régimen difusivo; ello indica que las temperaturas experimentadas son suficientes y su incremento no determina la velocidad del proceso.
Resultados del modelo cinético del proceso de neutralización
Una vez calculado el coeficiente empírico “z” y la energía de activación “E” se determinó la ecuación cinética del proceso de neutralización con el polvo residual de la industria del mármol. En la expresión 2, se sustituyen los valores del coeficiente empírico “z” y la energía de activación “E” y se obtiene la expresión 8, la cual se integra para obtener la 9, cuya solución genera la expresión 10:
Considerando que (0 = 0 y pHT0 = 1,9 se obtiene la expresión final (11) para la determinación del pH en función del tiempo. A partir de (11) se obtiene la expresión general (12):
La expresión 12 permitió determinar la influencia de los principales factores cinéticos sobre el proceso de neutralización de licores ácidos y comparar los valores másicos teóricos y experimentales del agente neutralizante en la investigación. Los resultados del estudio cinético y estadístico experimental del proceso de neutralización del licor ácido con polvo residual señalan una baja influencia de la temperatura en la variación del pH.
Validación del modelo cinético
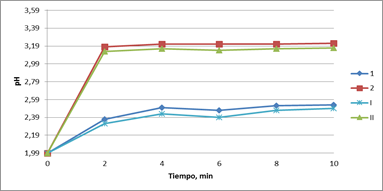
La validación del modelo se realiza mediante la contraposición de los resultados experimentales y los obtenidos con del modelo resultante según la ecuación 12. Se obtienen los valores teóricos y prácticos con las siguientes condiciones: (1-teórico para 1,5 g y 60 0C); (2- teórico para 2,5 g y 65 0C) y I; II son los resultados prácticos para las mismas condiciones de 1 y 2 (Figura 3).
En la Figura 3 se observa que los valores prácticos se asemejan a los valores obtenidos por el modelo cinético, los márgenes de error que se pueden apreciar son poco considerables, de manera que el modelo queda validado.
Análisis de los resultados estadísticos-matemáticos
Los resultados de laboratorio fueron sometidos en primer orden a un control de homogeneidad para el caso de la influencia de los principales parámetros en el proceso de neutralización. Las expresiones 13, 14, 15, 16 y 17, exponen los modelos que representan la influencia de las variables independientes: temperatura y masa agente precipitante, así como la interrelación entre ellas. En todos los casos los índices de correlación obtenidos fueron de 0,95.
pH 2 min = 2,01 + 0,0035∙T + 0,48∙ Masa de sól. - 0,002∙ T∙ Masa de sól. (13)
pH 4 min = 2,5125 - 0,00375∙T + 0,3285∙Masa de sól. + 0,00025∙T∙Masa de sól. (14)
pH 6 min = 2,5775 - 0,00475∙ T+ 0,306∙ Masa de sól. + 0,0006∙ T∙ Masa de sól. (15)
pH 8 min = 2,5575 - 0,00425∙ T+ 0,321∙ Masa de sól. + 0,0003∙ T∙ Masa de sól. (16)
pH 10 min = 2,53 - 0,0035∙ T + 0,3355∙ Masa de sól. + 0,00005∙ T∙ Masa de sól. (17)
La variable de mayor significación en la neutralización del licor ácido resultó ser la masa de agente neutralizante, lo que indica que el incremento de los valores de este parámetro favorece el proceso en gran medida. Para los mayores valores de esta variable independiente (prueba 1), se obtuvieron valores máximos de pH, lográndose desde 2,37 hasta 2,53 en el tiempo desde uno hasta diez minutos.
Los resultados de laboratorio fueron sometidos en primer orden a un control de homogeneidad para el caso de la influencia de los principales parámetros en el proceso de neutralización.
CONCLUSIONES
Se determina el mecanismo del proceso de neutralización del licor ácido con polvo residual de la industria del mármol y su modelo cinético, el cual quedó validado por datos experimentales.
Se demuestra que el polvo residual del mármol cumple con los requisitos necesarios como agente neutralizante en el proceso de neutralización del licor ácido. Los mejores resultados de pH se obtienen en la prueba 1 (para 50 ºC y 1 g), lográndose valores desde 2,37 hasta 2,53 en un tiempo desde un minuto hasta 10 minutos.