INTRODUCCIÓN
El avance acelerado de la biología celular y molecular en los últimos años ha beneficiado en gran medida el desarrollo de estrategias terapéuticas y ha logrado introducir cambios en el estilo de vida de los pacientes como vía para conseguir una mejor prevención, diagnóstico y tratamiento de las enfermedades. Resulta oportuno destacar que todas las enfermedades cursan con alteraciones en la estructura, propiedades y funciones de las principales biomoléculas que componen la vida, por lo que se han incrementado las investigaciones básicas biomédicas en este sentido. (1,2
El cáncer es una enfermedad multifactorial que afecta el crecimiento y la proliferación normal de las células, además de producir alteraciones en el proceso de diferenciación celular, lo que condiciona la formación de un tumor en un tejido específico. Por ello, el término cáncer implica una transformación maligna, es decir, una pérdida de las características y funciones normales de las células en un tejido. 1,2,3
Los procesos que condicionan el cáncer están influenciados por alteraciones genéticas o epigenéticas de numerosos genes que codifican proteínas que regulan este proceso, contribuyendo a un fenotipo maligno. Asimismo, existen factores ambientales implicados en la génesis del tumor con una influencia determinante en algunos tipos de cáncer. (1 (Fig. 1).
Diferentes reportes indican que esta enfermedad constituye la segunda causa más común de muerte, después de la enfermedad cardiovascular, en los Estados Unidos y en muchos otros países. De esta forma, cada año, mueren por cáncer cerca de 8 millones de personas en todo el mundo y se calcula que esta cifra va en aumento. (1,2,3 De igual manera, en Cuba la mortalidad por cáncer se encuentra entre las primeras cinco causas de muerte. (4 A nivel mundial, los principales tipos de cáncer que provocan mortalidad son los que afectan pulmones, estómago, colon, recto, hígado y mamas. Otros tipos de cáncer que llevan a la muerte son los cánceres cervicales, esofágicos, prostáticos y cutáneos. 1,2,3,4
El envejecimiento poblacional y la consecuente transición epidemiológica, constituyen dos elementos que condicionan este incremento observado en la morbilidad y mortalidad por tumores, debido a que la incidencia de muchos cánceres aumenta con la edad, por ende, a medida que las personas vivan más tiempo, muchas más presentarán la enfermedad. 5
En la presente revisión se expone una actualización sobre diferentes aspectos relacionados con las bases moleculares del cáncer, la cual puede brindar herramientas teóricas útiles para la acción en diferentes escenarios de las ciencias biológicas, médicas y de la salud que mejoren la esperanza de vida de los pacientes con enfermedades oncológicas.
DESARROLLO
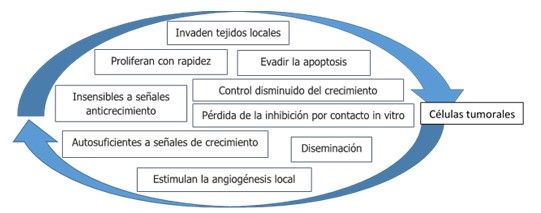
El término neoplasia se refiere a cualquier crecimiento nuevo y anormal de tejido; puede ser de naturaleza benigna o maligna. El término cáncer, por lo general, se relaciona con tumores malignos. Los tumores pueden surgir en cualquier órgano del cuerpo y dar lugar a diferentes manifestaciones clínicas, dependiendo de la ubicación del tumor. Las células cancerosas se caracterizan por ciertas propiedades que se exponen a continuación. (Fig. 2).
Estas propiedades son características propias de las células de tumores malignos. La causa de la muerte de forma más común es la diseminación o metástasis del tumor. Las células de tumores benignos muestran control disminuido del crecimiento, pero no invaden tejido local ni se diseminan hacia otras partes del cuerpo. Según se ha citado, el cáncer es una enfermedad genética donde se acepta, que si bien las mutaciones en genes claves contribuyen de manera significativa a la aparición de enfermedades malignas (particularmente en la fase de inicio de la oncogénesis), otros factores también están implicados en el desarrollo de fenotipos malignos como el estado inmunológico del organismo y el microambiente tisular. 1,2)
El cáncer es de origen clonal y las alteraciones genéticas son específicas para cada tumor, existiendo características comunes para los genes que causan cáncer. La formación del tumor consta de múltiples pasos, que finalmente transforma células normales en malignas por lo que tardan de algunos años a décadas para desarrollarse macroscópicamente. 1,2,3
Otros aspectos importantes del cáncer son los defectos en las vías de señalización celular, la estimulación de la angiogénesis y la aneuploidía. El daño genético puede deberse a mutaciones adquiridas o hereditarias. Las primeras ocurren debido a exposición a carcinógenos de los cuales hay 3 tipos: la energía radiante, las sustancias químicas y ciertos virus oncogénicos. Las dos primeras causan mutaciones en el DNA y la tercera clase por lo general actúa al introducir genes nuevos en células normales. Existen mutaciones en los genes que controlan la multiplicación celular, la muerte celular (apoptosis) y las interacciones célula-célula. Las mutaciones que son espontáneas, algunas de las cuales pueden predisponer al cáncer, ocurren a una frecuencia de alrededor de 1027 a 1026 por cada célula por cada generación. El estrés oxidativo, generado al producir números aumentados de especies de oxígeno reactivas, puede ser un factor en el aumento de la tasa de mutación a nivel molecular. 4,6
Para una mayor comprensión de las bases moleculares del cáncer se destacará de forma individual y actualizada, el papel desempeñado por diferentes aspectos implicados en este proceso.
Ciclo celular en la génesis del cáncer
El control del ciclo celular, así como la participación múltiple y paralela de varios factores tiene gran importancia en la génesis del cáncer. Este se puede esquematizar en forma análoga como un reloj biológico, el cual opera desde el núcleo de las células, donde existen diversos estímulos que inhiben o inducen la progresión del ciclo celular. En las células eucarióticas, el ciclo celular está compuesto de las fases G1, S, G2 y M. Su regulación es prioritaria y es controlada por la participación de diferentes proteínas llamadas ciclinas y cinasas dependientes de ciclinas (CDK) (por sus siglas del inglés). Ambas actúan cooperativamente, en donde las CDK fosforilan ciertas ciclinas en un momento específico y permiten que la célula continúe el ciclo celular. Entre las fases mencionadas existen puntos de control que involucran una maquinaria compleja de proteínas que verifica si en la célula se dan las condiciones adecuadas o no para continuar con la fase siguiente del ciclo celular. Estos puntos controlan la progresión del ciclo entre las fases descritas, si las células no están pasando por ciclos, se dice que están en fase G0 y se denominan quiescentes. Las células pueden ser reclutadas hacia el ciclo desde G0 por diversas influencias como por ejemplo, ciertos factores de crecimiento. El tiempo de generación es el tiempo necesario para que una célula en G0 entre en el ciclo y dé lugar a dos células hijas. Las células de un cáncer por lo general tienen un tiempo de generación más breve que las células normales y hay menos de ellas en fase G0. 1,2
En la regulación del ciclo celular, existen además otros tipos de proteínas, que son producto de los protooncogenes y de los genes supresores de tumores que, de igual forma, participan de forma orquestada en este control. De manera normal, las células responden a señales tanto internas como externas que estimulan la proliferación celular. 1,2,3
Dado que una propiedad importante de las células cancerosas es el crecimiento descontrolado, muchos aspectos de su ciclo celular se han estudiado con profundidad. Se han reportado varias mutaciones que afectan las ciclinas y CDK. 2,3,6,7)
Papel de los oncogenes y de los genes supresores tumorales en la génesis del cáncer. Vías de señalización
Los oncogenes y los genes supresores tumorales ejercen sus efectos mediante mecanismos complejos que participan en el control de la división o la muerte celular. En 1910, Peyton Rous, del Instituto Rockefeller y ganador del Premio Nobel, experimentó con sarcoma de pollo. Al inyectar homogeinado de sarcoma libre de células en pollos sanos se inducía la misma clase de tumor, planteando la incógnita acerca de, cuál era el agente, molécula o factor responsable de la tumoración. En las décadas siguientes se descubrió el agente etiológico de este padecimiento: un retrovirus denominado virus del sarcoma de Rous. En 1970, se describe que uno de los genes del virus del sarcoma de Rous, el gen SRC, tiene la capacidad de transformar células normales en fenotipos malignos. Estudios posteriores demostraron que versiones similares de genes virales oncogénicos se encuentran en células normales y participan en el proceso de proliferación celular. Estos genes se denominaron protooncogenes, genes que codifican proteínas que regulan de manera normal y fisiológica la cascada de eventos que sirven para mantener el control de la progresión del ciclo celular y el estado normal de diferenciación de la célula. Las versiones alteradas de estos protooncogenes por mutaciones dan lugar a los oncogenes. En consecuencia, las funciones de los productos génicos de los protooncogenes y de los oncogenes son diferentes; en los oncogenes estos productos son las oncoproteínas. Estas proteínas provocan cambios moleculares y celulares, según el nivel específico donde actúan. Por lo tanto, es evidente que el oncogén puede definirse como un gen alterado cuyo producto actúa de una manera dominante para acelerar el crecimiento celular o la división celular, es decir, son genes que codifican para proteínas estimuladoras del crecimiento. 1,2,3,6,7)
Esa activación puede efectuarse por varios mecanismos. Un ejemplo de una mutación puntual ocurre en el oncogén RAS que codifica para una GTPasa pequeña. La pérdida de la actividad de GTPasa de la proteína G da por resultado estimulación crónica de la actividad de la adenilato ciclasa, lo que lleva a proliferación celular. Otra manera en que un oncogén puede ser activado es por medio de inserción de un aumentador y/o promotor potente torrente arriba de una región codificadora de proteína que da por resultado transcripción aumentada, y por ende, expresión de proteína del gen. La integración de un aumentador/promotor provirus retroviral (es decir, la copia de DNA [generada por transcriptasa inversa] del genoma de RNA de un virus tumoral, como el virus del sarcoma de Rous) activa MYC, un gen huésped vecino. La sobreproducción del factor de transcripción MYC activa la transcripción de genes reguladores del ciclo celular, y por ende, estimula la proliferación celular. 1,2,7)
Según se ha visto en las células cancerosas se encuentran con bastante frecuencia translocaciones cromosómicas, se han documentado alrededor de miles de ejemplos diferentes. El efecto general de esta translocación también es activar MYC, lo que da por resultado la proliferación celular. Otro mecanismo de activación de oncogén es por medio de amplificación de gen, proceso que ocurre de manera bastante común en diversos cánceres. En este caso, se forman múltiples copias de un oncogén, lo que da lugar a producción aumentada de una proteína promotora del crecimiento. Los productos proteínicos de oncogenes activados afectan las vías de señalización celular, donde pueden actuar como un factor de crecimiento, un receptor de factor de crecimiento, una proteína G o como una molécula señalizadora torrente abajo. Otras oncoproteínas actúan para alterar la transcripción o para desregular el ciclo celular y otras afectan las interacciones célula-célula o el proceso de la apoptosis. En conjunto, estos mecanismos ayudan a explicar muchas de las características importantes de las células cancerosas, como el potencial replicativo ilimitado, sus vías de señalización activadas constitutivamente, su capacidad para invadir y diseminarse y su evasión de la apoptosis. 1,2,3,6)
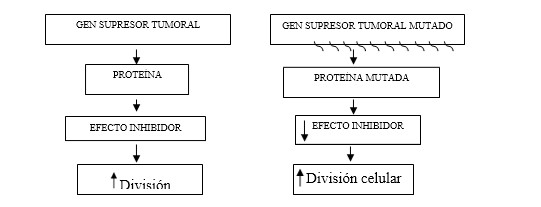
Con referencia a lo anterior se destaca de manera general cómo el gen supresor tumoral produce un producto proteínico que en circunstancias normales suprime el crecimiento o la división celular. Cuando un gen de ese tipo se altera por mutación, el efecto inhibidor de su producto se pierde o disminuye; esta pérdida lleva a incremento del crecimiento o la división celular. Como lo sugirió por vez primera AG Knudson, debe haber afección de ambas copias de un gen supresor tumoral para que pierda sus efectos inhibidores sobre el crecimiento. (Fig. 3).1,3,6)
Existen dos tipos de genes que se han distinguido como funciones de guardabarrera y cuidador de genes supresores tumorales, los cuales tienen funciones diferentes. Los primeros controlan la proliferación celular e incluyen principalmente genes que actúan para regular el ciclo celular y la apoptosis, mientras que los segundos se relacionan con la preservación de la integridad del genoma, e incluyen, genes cuyos productos están involucrados en el reconocimiento de daño en el DNA y la corrección de este, así como en el mantenimiento de la integridad cromosómica durante la división celular. 1)
Durante muchos años se han realizado considerables esfuerzos para la identificación de genes específicos, o “marcadores”, involucrados en el desarrollo del cáncer. En el año 2010 en un censo de genes del cáncer se enumeraron 291 genes humanos que representan cerca del 1 % de los genes totales. El tipo de mutaciones para estos genes del cáncer incluye los rearreglos genómicos, las mutaciones puntuales, las deleciones y las amplificaciones, entre otras. 8)
Papel de los miRNA
Un papel importante en los momentos actuales son los micro RNA (miRNA). Estos son participantes clave en la carcinogénesis y las metástasis tumorales, los cuales no son más que moléculas de ácido ribonucleico (RNA) (por sus siglas en inglés) monocatenario cortas que pueden regular la transcripción y/o traducción de genes codificadores de proteína. Ellos desempeñan múltiples funciones en cada aspecto de la formación de tumor y su progresión. Algunos miRNA son supresores tumorales y pueden actuar al degradar RNA que codifican para proteínas oncogénicas, lo que disminuye así su expresión. La investigación en años recientes se ha enfocado en desarrollar fármacos que se dirigen a la molécula de miRNA. 2,8)
Factores de crecimiento y vías de señalización
Los factores de crecimiento se unen a dominios extracelulares de receptores enclavados en la membrana plasmática, donde disparan una señal de transducción proporcionando un estímulo externo a la célula. Ellos pueden actuar de una manera endocrina, paracrina o autocrina y afectar una amplia variedad de células para producir una respuesta mitogénica. Una de las características que define a la célula tumoral es el control autocrino en su crecimiento. En este caso, la célula tumoral produce factores de crecimiento que actúan sobre receptores en la misma célula, esto conlleva a que el crecimiento tumoral sea independiente de la administración exógena de factores de crecimiento. Además, se puede observar un control paracrino, en el cual el factor de crecimiento liberado por la célula tumoral actúa sobre las células vecinas las cuales poseen los receptores de membrana adecuados para ser estimulados por los factores liberados. 1,2,6,9
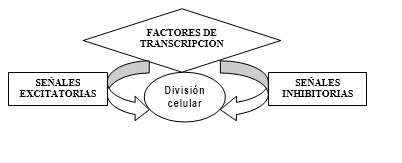
Dichos factores de crecimiento, al unirse a su receptor en la membrana celular, interiorizan la señal auto activándose como una enzima con capacidad de tirosina cinasa o a través de segundos mensajeros como puede ser proteínas G, con lo que se inicia una cascada de fosforilaciones en proteínas citoplasmáticas que finalmente modifican factores transcripcionales que se encuentran en el citoplasma y migran hacia el núcleo, uniéndose al ADN y activando la expresión de proteínas que inducen la división celular. Asimismo, existen señales inhibitorias que pueden frenar la división celular a través de mecanismos similares. Precisamente, el balance entre estas dos cascadas de señales es lo que permite la homeostasis de la división celular en una célula normal, entre otros mecanismos. Esta cascada de señales es coordinada por proteínas desde el espacio extracelular hasta el mismo núcleo, con diferentes niveles celulares en el control de la división celular. (Fig. 4). 1,6)
Los factores de crecimiento participan en la diferenciación de células hematopoyéticas. Se tiene como ejemplo, el factor de crecimiento transformante-b (TGF-b), el cual ejerce efectos inhibidores sobre el crecimiento de ciertas células. Se conoce que la exposición crónica a cantidades aumentadas de un factor de crecimiento o las cantidades disminuidas de un factor inhibidor de crecimiento, puede alterar el equilibrio del crecimiento celular. Han sido identificados y caracterizados genes que codifican receptores para factores de crecimiento, que por lo general tienen segmentos cortos que abarcan la membrana y dominios externos y citoplasmáticos. Otro ejemplo lo constituye el factor de crecimiento epidérmico, insulina y factor de crecimiento derivado de plaquetas que tienen actividades de tirosina cinasa. La actividad de cinasa, ubicada en los dominios citoplasmáticos, causa autofosforilación de la proteína receptora y fosforila también algunas otras proteínas. 1,2)
Como ejemplo se tomará el factor de crecimiento derivado de plaquetas (PDGF) que ilustra cómo un factor de crecimiento particular desencadena sus efectos. La interacción del PDGF con su receptor estimula la actividad de la fosfolipasa C (PLC); la PLC divide el fosfatidilinositol bifosfato (PIP2) hacia inositol trifosfato (IP3) y diacilglicerol (DAG). El IP3 aumentado estimula la liberación de Ca intracelular, y el DAG incrementa la actividad de la proteína cinasa C (PKC). La hidrólisis de DAG puede liberar ácido araquidónico, que puede estimular la producción de prostaglandinas y leucotrienos, cada uno de los cuales tiene diversos efectos biológicos. La exposición de células blanco al PDGF puede dar lugar a activación rápida (en minutos a dos horas) de ciertos protooncogenes celulares, por ejemplo: MYC y FOS, que participan en la estimulación de la mitosis por medio de efectos sobre el ciclo celular. 1,2,5)
El primer oncogén descrito como factor de crecimiento fue v-sis, oncogén procedente del virus del sarcoma de los simios, similar a la cadena β del factor PDGF. El receptor del factor de crecimiento epidérmico es una proteína transmembranal con actividad de tirosina cinasa que se activa cuando se une el factor de crecimiento en el dominio extracelular; en consecuencia, la tirosina cinasa de la proteína v-erb-B (proteína codificada por el virus de la eritroblastosis aviar) se activa inespecíficamente sin necesidad de estímulo, de esta manera pierde su función normal y conduce a la oncogénesis. Otros grupos de investigación identificaron genes relacionados con el gen v-erb-B que llamaron HER-2. El receptor del factor de crecimiento epidérmico se encuentra sobre expresado o mutado en carcinoma pulmonar, y de hecho, es el blanco terapéutico de un grupo de fármacos llamados inhibidores de tirosina cinasa. Un ejemplo típico de estos protooncogenes implicados en la transducción de señales es la familia de los genes ras, que incluye tres protooncogenes estrechamente relacionados, Harvey (ha)-ras, Kirsten (Ki)-ras y N-ras. Estos codifican para proteínas de ~21 kDa que están en la superficie interna de la membrana plasmática, y su función es unir GTP/GDP a través de su actividad de GTPasa, participando en vías de transducción de señales que regulan el crecimiento celular. 1,2)
Genes supresores de tumores mejor caracterizados en el ser humano. Vías de señalización
Entre los mejores caracterizados se incluyen el gen de retinoblastoma (Rb), localizado en el cromosoma 13 brazo q14.1-q14.2, y el gen p53, situado en 17 p13.1. Existen otros genes supresores de tumores con una importancia similar, pero se limitan a tipos específicos de cáncer, como los genes APC y DCC, situados en 5q21-22 y 18q23.3, respectivamente, cuya significación clínica se ha limitado al cáncer de colon. Los genes NF-1 y NF-2, cuyas posiciones en el genoma son 17q11.2 y 22q12.2, se han asociado a neurofibromatosis. 1,3)
El retinoblastoma es una enfermedad que se manifiesta por una tumoración maligna en la retina desde la infancia. Se observó claramente al estudiar esta enfermedad, que el cariotipo de los pacientes con retinoblastoma mostraba una deleción del cromosoma 13, donde se localiza el gen Rb. El fenotipo maligno solo se desarrolla cuando ambos alelos de Rb están mutados. En la forma hereditaria de la enfermedad, uno de los alelos de origen parental porta la deleción y cuando se altera el otro alelo (no mutado) se desarrolla el tumor. Se ha reportado hasta 70 % de los casos de retinoblastoma con pérdida de heterocigosidad en células somáticas de la retina. La inactivación del gen Rb se ha reportado en el retinoblastoma, el osteosarcoma y el cáncer pulmonar de células pequeñas. En el caso de las alteraciones en la expresión génica, se encuentra la metilación del promotor del gen de Rb en tumores de cerebro. El gen Rb codifica para una fosfoproteína nuclear implicada en la regulación del ciclo celular, a través de su unión cíclica a los complejos ciclina-CDK, específicamente. las ciclinas D, E, y al factor transcripcional E2F. Durante el final de la fase G1 se fosforila y libera al E2F, lo que permite la transcripción. Durante la mitosis este gen sufre una desfosforilación y esta forma hipofosforilada inhibe la proliferación celular. 1,3)
El gen p53 codifica para un factor transcripcional que activa la transcripción de ciertos genes, y en respuesta al daño en el DNA, detiene el ciclo celular. Lo anterior se logra por la inhibición de los complejos de CDK/ciclinas, así como por la fosforilación de Rb. En caso de que el DNA no pueda repararse, las células aumentan sus niveles de p53 y se detienen en la fase G1 antes de entrar a la fase de síntesis, para activar los mecanismos de reparación. Si la lesión no es reparable, la célula es inducida a apoptosis, las células con una lesión reparable retornan a la fase S y a la división celular. El principal objetivo es evitar que la información genética alterada se transmita. Las células premalignas con una mutante de p53 pueden transmitir esta alteración. Como sucede con Rb, si se heredan mutaciones de los alelos de origen parental existe la tendencia a desarrollar cáncer. Esta patología heredada se conoce como síndrome de Li-Fraumeni y presenta un patrón de herencia autosómico dominante. 1,3,10)
En 1987, Donna George y cols. reportaron que el oncogén MDM2 suprime la capacidad de p53 para inhibir la tumorogénesis. Al respecto, se han reportado amplificaciones de MDM2 y mutaciones en p53 en osteosarcomas. Debido a que p53 está implicado en numerosos tipos de cáncer, se ha propuesto que su detección podría ser útil como un marcador en la evolución de la enfermedad. Las mutaciones reportadas con más frecuencia en p53 son puntuales de sentido equivocado, que se pueden producir en todo el marco de lectura, en particular de los exones 5 a 8 que constituyen la región central de la proteína, no obstante, cada tipo de cáncer tiene mutaciones particulares más frecuentes en sitios específicos. Las mutaciones puntuales sin sentido suelen asociarse a una prolongación en la vida media de la proteína, y por lo tanto, a un incremento en el nivel basal de la proteína. Finalmente, la pérdida de la actividad de algún gen supresor de tumor siempre se compensa por la actividad de otro gen que surge como mecanismo de seguridad ante situaciones emergentes de las células. No obstante, estos mecanismos se pierden en la tumorigénesis. 1,3)
Los virus y el cáncer
Muchos estudios se han enfocado en el papel de los virus en el proceso de carcinogénesis, un ejemplo conocido es el caso del cáncer cervicouterino (CCU), el cual es un tipo de cáncer que tiene como factor de riesgo la infección con el virus del papiloma humano (VPH). Algunos estudios reportan la infección positiva a VPH en pacientes con CCU en más de 90 % de los casos. Cabe mencionar que existen tipos virales de alto riesgo (VPH 16 y 18, entre otros) y de bajo riesgo (VPH 6 y 11, entre otros) al desarrollo de CCU. Debido a que la infección con VPH se produce en las células epiteliales basales, esta se mantiene durante el proceso de diferenciación epitelial, para asegurar la síntesis de proteínas virales que darán origen a nuevos virus. En respuesta a la infección, las células activan mecanismos de defensa celular que implican a p53 y Rb y dirigen a la célula infectada a apoptosis. Los tipos virales de VPH de alto riesgo sobreexpresan las oncoproteínas virales E6 y E7, que inactivan los genes supresores de tumor mencionados. E6 inactiva la función de p53, mientras que E7 inactiva a Rb. En ambos casos se produce una pérdida de su actividad, lo que contribuye a la tumorogénesis del CCU porque se producen cambios en el crecimiento normal y diferenciación del epitelio cervical y se acumulan alteraciones genéticas en estas células. 2,3)
Papel predictivo de los telómeros en la génesis del cáncer
Estudios recientes apoyan el papel de los telómeros en la progresión del proceso de formación del tumor. Se conoce que en el cáncer, cuando las células tumorales se dividen con rapidez, sus telómeros a menudo se acortan. Esos telómeros (que por lo general se detectan en leucocitos debido a la facilidad con la cual se obtienen) han quedado implicados como un factor de riesgo para muchos tumores sólidos, si no es que para todos, como ocurre por ejemplo en el cáncer mamario. Los telómeros cortos parecen tener valor predictivo respecto a la progresión de enfermedades inflamatorias crónicas (como colitis ulcerosa y esófago de Barrett) hacia cáncer. La actividad de telomerasa, la principal enzima involucrada en la síntesis de telómeros, suele estar alta en células cancerosas, lo que proporciona un mecanismo para superar el acortamiento de telómero. Los inhibidores selectivos de la telomerasa se han considerado posibles fármacos para tratar cáncer, pero esto aún no se ha traducido en uso clínico exitoso. 2,3)
Aspectos moleculares relacionados con el proceso de metástasis
Se ha estimado que alrededor de 85 % de la mortalidad asociada con cáncer se produce por metástasis. El cáncer por lo general se disemina por medio de vasos linfáticos o sanguíneos. Para asegurar el crecimiento, las células metastásicas necesitan suficiente riego sanguíneo. Muchos estudios han demostrado que las células cancerosas tienen un complemento anormal de proteínas en su superficie celular; estos cambios pueden permitir adhesión celular disminuida y que células individuales se desprendan del cáncer original. Las moléculas sobre superficies celulares involucradas en la adhesión celular se llaman moléculas de adhesión celular (MAC). Decrementos de las cantidades de E-cadherina, una molécula de gran importancia en la adhesión de muchas células normales, pueden ayudar a explicar la agresividad disminuida de muchas células cancerosas. 2)
El evento más temprano es el desprendimiento de células tumorales desde el tumor primario. Las células pueden tener acceso entonces a la circulación (o a linfáticos), proceso que se denomina intravasación. Una vez en la circulación, tienden a detenerse en el lecho capilar pequeño más cercano. En ese sitio, se extravasan y migran a través de la matriz extracelular (MEC) vecina, antes de encontrar un sitio para establecerse. A partir de entonces, si sobreviven a los mecanismos de defensa del huésped, crecen a tasas variables. Un factor que permite el movimiento aumentado de células cancerosas es la transición mesenquimatosa epitelial o EMT, este es un cambio de la morfología y la función celulares desde tipo epitelial hacia tipo mesenquimatoso, tal vez inducido por factores de crecimiento. La matriz extracelular (MEC) desempeña un papel importante en las metástasis. En este proceso cobra mucha importancia la catepsina D y las elastasas, las cuales son responsables de la degradación de la matriz extracelular y membranas basales y este evento favorece la invasión de la célula tumoral. La generación de metástasis no es un proceso al azar, en un tumor existe solo un pequeño grupo de células que tiene la potencialidad de originar metástasis. 2,9)
Moléculas involucradas en la inducción de un proceso inflamatorio durante el evento cancerígeno
La inflamación es un componente crucial en la formación del tumor. Los ejemplos de posibles moléculas que están involucradas en la inducción de un proceso inflamatorio comprenden el factor nuclear κB (NF-κB) y el transductor de señal y activador de la transcripción 3 (STAT3). El NF-κB es un factor de transcripción que induce la expresión de proteínas que están involucradas en procesos proinflamatorios, proliferativos y de reparación. Se ha mostrado que ocurre activación de NF-κB en tumores en respuesta a estímulos inflamatorios o mutaciones oncogénicas. La señalización por medio de STAT3 es activada por la interleucina 6 (IL-6), una citocina proinflamatoria, que activa la señalización de cinasa Janus (JAK)-STAT y sus eventos efectos torrente abajo. Se cree que esos eventos se encargan de impulsar muchos datos característicos del cáncer. Además, el “inflamasoma”, un complejo multiproteínico que actúa como un detector de daño celular, es otro candidato potencial que media la inflamación. La activación de inflamasomas favorece la secreción de citocinas proinflamatorias, como IL-1b, e IL-18, ambas de las cuales han quedado implicadas en la tumorigénesis. 2
La obesidad se asocia con inflamación de grado bajo. El tejido adiposo visceral es considerado una fuente importante de citocinas proinflamatorias y otros factores implicados en el proceso. Se ha mostrado que la obesidad media produce cambios disfuncionales en el microambiente del tumor y los exacerba, se ha mostrado que esto ocurre tanto en tejido normal como en tumores. Esos cambios incluyen alteraciones en factores que pueden ser de naturaleza endocrina, metabólica o inflamatoria. En contraste, se ha mostrado que la restricción calórica inhibe la tumorogénesis en modelos de experimentación. Tal restricción calórica afecta muchas vías celulares, como las que comprenden señalización del factor de crecimiento, inflamación, homeostasis celular y el microambiente tumoral. Estas observaciones sugieren que esos blancos pueden considerarse para la prevención de cáncer en humanos. 2,3)
Influencia de la apoptosis en la transformación maligna
Las células cancerosas adquieren mutaciones que les permiten evadir la apoptosis, lo que prolonga así su replicación y permite que esta sea continua, esto se considera como consecuencia de la inactivación de p53 o la activación de genes antiapoptósicos. La alteración de estímulos pro y antiapoptóticos tanto internos como externos y la aparición de mutaciones en los genes que regulan este proceso llevan a la progresión tumoral. Entre los factores externos capaces de inducir apoptosis está la disponibilidad limitada de nutrientes, la carencia de factores de crecimiento, la disminución de oxígeno y la pérdida de las interacciones de matriz extracelular, entre otros. Los estímulos internos resultan aún más importantes en el desarrollo de algunos tumores al limitar su crecimiento en etapas tempranas o tardías cuando comienza la metástasis. 11)
La célula tumoral durante el proceso de progresión tumoral adquiere un fenotipo caracterizado no solo por la falta de respuesta ante señales de inhibición por contacto y de proliferación de manera incontrolada, sino que posee la capacidad adaptativa de sobrevivir y expandirse en forma clonal al tener alterado el programa de muerte celular programada, lo que hace que se produzca un desequilibrio entre proliferación y muerte celular, característica del cáncer. Las células en un organismo forman una comunidad organizada, donde el número de células está regulado; si una célula ya no se requiere, entra en un proceso de apoptosis, que es ordenado y con programación genética donde no hay liberación de componentes celulares al espacio extravascular ni daño a células vecinas. La maquinaria molecular apoptótica está compuesta por componentes efectores y reguladores que actúan en una cascada de señalización, cuyo fin es controlar la muerte celular programada, ya sea actuando como reguladores negativos o positivos y efectores de la apoptosis. Los reguladores a su vez se dividen en dos circuitos de señalización: las proteínas involucradas que reciben y procesan señales externas que inducen la muerte celular (programa apoptótico extrínseco) y aquellas que reciben e integran una gran variedad de señales de origen intracelular (programa intrínseco). Cada una de estas vías termina en la activación de proteínas efectoras denominadas caspasas, las cuales inician una cascada de proteólisis para activar la fase ejecutora de la apoptosis. En esta etapa la célula en forma progresiva se desensambla y fragmenta y los cuerpos apoptóticos resultantes son fagocitados por las células vecinas. 11,12,13)
En las diferentes fuentes revisadas se acentúa cómo en las bases moleculares del cáncer se plantean alteraciones genéticas o epigenéticas, así como de naturaleza ambiental. Tiene gran preponderancia desde el punto de vista genético la presencia de mutaciones somáticas y de mutaciones de la línea germinal, existiendo para cada tumor sus propias manifestaciones, apareciendo además similitudes en cuanto a las características de los genes involucrados. Diversos autores señalan los rasgos del cáncer que lo caracterizan desde el punto de vista molecular y definen además las capacidades que va adquiriendo la célula cancerosa durante la aparición de las manifestaciones clínicas del tumor maligno. (Fig. 5).1,2,6,11,13)
El papel desempeñado por las principales clases de genes, los cuales al presentar mutaciones que pueden provocar ganancia o pérdida de función, así como una desregulación manifiesta, dan como resultado el desarrollo de un tumor. Las alteraciones bioquímicas detalladas a estos niveles provocan alteraciones de la regulación en la cascada de eventos que llevan a la producción del fenotipo cancerígeno favoreciendo la proliferación celular descontrolada. 1,2,5,6)
En los últimos años se ha avanzado de forma relevante en los estudios a nivel molecular de la transformación cancerosa donde se ha favorecido el desarrollo de la quimioterapia con la aparición de nuevos fármacos, la identificación de dianas moleculares como los anticuerpos monoclonales o inhibidores de la tirosín quinasa, y algo novedoso es la nueva inmunoterapia con la introducción de los inhibidores de los puntos de control inmunológicos, lo que se sabe está cambiando el paradigma terapéutico del cáncer. 14,15)
Gorines en su investigación plantea una metodología necesaria para la producción, purificación y caracterización estructural y funcional de inmunotoxinas recombinantes compuestas por múltiples dominios marcadores (scfv, vhh, proder p 1, il-33) fusionados a la ribotoxina α-sarcina, dirigidas frente a diferentes enfermedades, como el cáncer o la alergia, así como García Goimi y cols. plantean diferentes técnicas diagnósticas como blancos terapéuticos de esta entidad. 16,17 También el uso de las nuevas tecnologías que complementan la información que da el cariotipo en citogenética ha demostrado ser de gran utilidad, como por ejemplo la citogenética molecular (fish) y el estudio de la presencia de mutaciones por la pcr-rt (de transcripción inversa), pues permite cuantificar la expresión del DNA de interés y no solo de comprobar si está presente o no en la muestra biológica de estudio. 18)
Se hace evidente, cómo las posibilidades del paciente oncológico se han favorecido al estudiarse los rasgos del cáncer los cuales son blancos de múltiples investigaciones con la finalidad de profundizar en su estudio a nivel molecular. Esto garantiza el diagnóstico y prevención de esta entidad prolongando su nivel de vida.
CONCLUSIONES
El aporte de la biología molecular y celular al estudio del proceso de la carcinogénesis ha sido de crucial importancia para detectar de forma precoz la aparición de tumores y disminuir la mortalidad por esta causa. En estos estudios moleculares se destacan el origen clonal y la presencia de múltiples factores en su génesis. Dentro de estos se señalan, entre otros, la respuesta inflamatoria y los defectos en las vías de señalización donde está implicado el ciclo celular. Un papel preponderante lo tienen los oncogenes y los genes supresores tumorales, estos últimos son los mejores caracterizados en el ser humano que incluyen el gen del retinoblastoma (Rb) y la p53, de los cuales se conoce que ambos participan en el control de la división celular mediante complejos mecanismos. Se ha profundizado ampliamente en el papel desempeñado por la presencia de múltiples factores de crecimiento, el de pequeñas moléculas de RNA monocatenario (miRNA), y la participación de los virus en estos procesos. De todo lo anterior se evidencia que la dilucidación de los mecanismos moleculares involucrados en los fenotipos cancerígenos ha servido para profundizar en el desarrollo de herramientas y terapias novedosas dirigidas a esta patología.
Futuros estudios en este campo contribuirán a continuar profundizando en los conocimientos en esta temática, lo cual repercutirá de forma positiva en la prolongación de la vida de los individuos aquejados por esta enfermedad, que constituye un problema de salud con gran impacto humano y social.