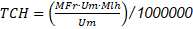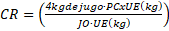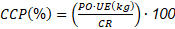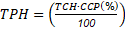INTRODUCCIÓN
El azúcar no centrifugado (NCS, por sus siglas en inglés), término técnico utilizado por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO, 1994), es un azúcar sin refinar típico que se produce deshidratando el jugo de la caña de azúcar (Saccharum officinarum L.) (Ge y col., 2021). Su presentación comercial es en forma sólida (bloques) o en forma granulada. El NCS está disponible en muchos países con diferentes nombres locales, incluidos panela (Bolivia, Colombia, Ecuador, Guatemala, Panamá), raspadura (Brasil, Cuba, Bolivia, Panamá), piloncillo (México), papelón (Venezuela), chancaca (Chile, Perú), jaggery (India), Kokuto (Japón) y Gula Melaka (Malasia) (Jaffé, 2012); (Asikin y col., 2014). Colombia es el segundo productor de panela (NCS) en el mundo después de la India, con un área anual de caña para la producción reportado para el 2020 de 192863 ha con un rendimiento de 6,5 tha-1 (MADR, 2021). La panela es un producto con alto contenido de sacarosa (65-85 %), seguido de azúcares reductores (10-15 %), agua (3-10 %) y materia insoluble como grasas, proteínas, minerales, hierro y fósforo (<1 %) (Rupe, 2007). El Ministerio de Salud y Protección Social estableció la norma colombiana que indica como parámetros de calidad en panela, la sacarosa, pureza, azúcares reductores, fosfatos, pH, humedad y sólidos totales solubles (Minsalud, 2006). En el sector productivo falta consolidar una producción rentable, competitiva y sostenible que logre mejorar el rendimiento y la calidad de la panela, es aquí donde el uso de microorganismos benéficos como los Hongos Formadores de Micorrizas Arbusculares (HFMA) pueden inferir, debido a la asociación que generan con algunas plantas mejorando el intercambio y movilidad de nutrientes. Diferentes estudios en caña de azúcar han identificado beneficios de la asociación de los HFMA en el manejo nutricional, el estrés hídrico (Datta y Kulkarni, 2012), la fisiología y el rendimiento de la planta (Sulistiono y col., 2017; Wilches-Ortiz y col., 2019). Por todo lo anterior, el objetivo de este trabajo fue evaluar el efecto de la inoculación con HFMA en el cultivo de la caña de azúcar sobre el rendimiento y la calidad en panela.
MATERIALES Y MÉTODOS
2.1 Localización
El estudio se realizó en una finca de productor en el municipio de Suaita, departamento de Santander, Colombia a 1233 msnm en condiciones de campo en un área de 3292 m2.
2.2 Material vegetal
Se utilizó la variedad CC93-7711 (Pierna Bella), la cual fue previamente evaluada y caracterizada agroindustrialmente por el convenio Agrosavia-Cenicaña (Centro de investigación de la caña de azúcar de Colombia) y entregada a agricultores de la zona en el 2013. Se realizó la extracción manual de semillas de caña, las cuales fueron germinadas en canastillas con sustrato inerte en el Centro de Investigación Cimpa de la Corporación Colombiana de Investigación Agropecuaria (Agrosavia), ubicado en Barbosa, Santander.
2.3 Trasplante en vivero e inoculación de microorganismos
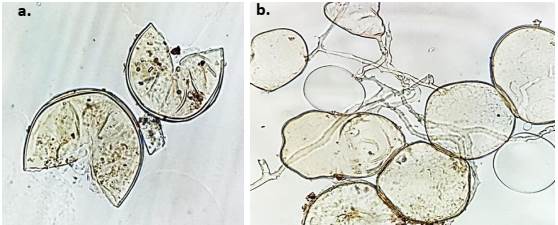
Se utilizaron los HFMA R. irregularis y A. mellea (Figura 1) pertenecientes a la colección de trabajo del Banco de Germoplasma de la Colección de Microorganismos con Interés en Biofertilizantes (CMIB) de Agrosavia, por presentar un efecto benéfico en diferentes variedades de caña evaluadas anteriormente (Wilches-Ortiz y col., 2019). La multiplicación de los HFMA se realizó utilizando como hospedero plantas de uchuva (Physalis peruviana L.) sembradas en macetas de 500 g de capacidad, usando como sustrato suelo:arena (2:1 v/v). El control de calidad del inóculo se realizó cinco meses después mediante la técnica de tamizado húmedo y decantación propuesta por Gerdemann y Nicolson, (1963), con un recuento de 42 esporas.g-1. La inoculación de los HFMA se realizó con 70 esporas por planta al momento del trasplante de la variedad de caña CC 93-7711 en vivero.
2.4 Diseño experimental
En un Diseño de Bloques Completos al Azar (DBCA) con tres repeticiones, se evaluaron cuatro tratamientos en donde se incluyeron dos microorganismos de HFMA (Tabla 1). Como tratamientos control se utilizaron dos dosis de fertilización, uno con el 50% (igual que los tratamientos de inoculación) y el otro con el 100% de la fertilización química, que se realizó teniendo en cuenta el análisis químico del suelo y los requerimientos nutricionales en caña panelera reportados por González y col., (2018). El esquema de fertilización se fraccionó a los dos y cuatro meses después de trasplante, teniendo en cuenta los requerimientos por hectárea de elementos mayores y menores así: N (170 kg), P2O5 (50 kg), K2O (240 kg), Ca (90 kg), MgO (60 kg), S (45 kg), Si (320 kg), Fe (12 kg), Mn (1,5 kg), Cu (0,128 kg), Zn (1,8 kg), B (0,522 kg). El ensayo se mantuvo bajo condiciones de manejo agronómico hasta el momento de la primera cosecha a los 15 meses después de trasplante (mdt).
2.5 Rendimiento en caña de azúcar
Se determinó el índice de madurez en cañas con un refractómetro digital, relacionando los grados brix en el cuarto entrenudo hacia arriba desde la base del tallo y en el cuarto entrenudo hacia abajo desde la parte apical del tallo (Ramírez y col., 2014). Cuando los materiales alcanzaron su índice de madurez adecuado (0,95 a 1,00) para cosecha, se realizó conteo y pesaje de los tallos presentes en 2 metros lineales, en tres puntos de unidad de muestreo para determinar la masa fresca. Con la información obtenida de la cosecha se determinó el rendimiento de toneladas de caña por hectárea (TCH) de acuerdo con la Ecuación 1. Se destaca una distancia de siembra entre surcos de 1,3 metros.
Conversiones:
TCH. Toneladas de caña por hectárea (t.ha-1)
MFr: Masa Fresca de tallos (kg)
Um: Unidad de muestreo (2 m lineales).
Mlh: Metros lineales de tallos de caña en una hectárea (7692,3 m).
2.6 Obtención de panela y sus rendimientos
A partir de la caña cosechada se determinó el rendimiento de panela (%) y toneladas de panela por hectárea (TPH). Se colectaron 15 kg de caña por cada unidad experimental (UE) y se realizó la prueba de molienda en el trapiche de Cimpa-Agrosavia. Para la obtención de panela se siguieron los procedimientos de apronte, clarificación, evaporación y concentración, batido, enfriamiento y moldeo, descritos por Guaman y col., (2009) y Núñez (2020). La caña colectada en campo, el jugo obtenido y la panela en bloque se pesaron de manera individual por cada UE, se utilizaron las ecuaciones reportadas por Volverás y col., (2020) de caña requerida (CR) (Ecuación 2) para el cálculo del porcentaje de conversión de caña a panela (CCP) (Ecuación 3) y toneladas de panela por hectárea (TPH) (Ecuación 4).
Conversiones:
UE. Unidad experimental CR: Caña requerida para 4 kg de jugo (uds).
PC: Peso de la caña (kg). JO: Jugo Obtenido (kg).
CCP: Conversión de caña a panela. PO: Panela obtenida (uds).
TPH: Toneladas de panela por hectárea. TCH: Toneladas de caña por hectárea.
2.7 Caracterización fisicoquímica de panela
En el laboratorio del Cimpa-Agrosavia se determinaron los parámetros de sólidos solubles totales (refractómetro), potencial de hidrógeno (pH-metro), sacarosa (polarímetro), azúcares reductores por método volumétrico (Lane y Eynon, 1923), fósforo soluble (Método ácido ascórbico-espectrofotometría), pureza y porcentaje de humedad, acorde a la normatividad vigente en panela (Minsalud, 2006).
2.8 Análisis estadísticos
Todos los experimentos se realizaron por triplicado y los datos se expresaron como media ± desviación estándar. Se realizó análisis de varianza (α = 0,05), prueba de comparación múltiple de Tukey (p≤0,05) y análisis de correspondencia canónica entre los tratamientos con los parámetros fisicoquímicos de la panela. Se utilizó el software estadístico R® (R Core Team, 2020) con las librerías corrplot, CCA (González y Déjean, 2021) y ggplot2 (Wickham, 2016).
RESULTADOS Y DISCUSIÓN
3.1 Rendimiento en caña de azúcar
Con base en los resultados obtenidos no se presentaron diferencias significativas (p<0,05) entre tratamientos en la TCH a los 15 meses después de trasplante (mdt). Sin embargo, el tratamiento R. irregularis con el 50 % de fertilización (T2) registró valores de caña más altos (157,5 t.ha-1) con respecto a los demás tratamientos (Figura 2a) y al promedio nacional de 139 TCH (Ramírez y col., 2014), mostrando que la inoculación con R. irregularis, permite la sustitución hasta del 50% del fertilizante químico de síntesis, coincidiendo con diferentes autores que reportan el beneficio del uso de los HFMA, que permiten obtener una mayor cantidad de tallos de caña por unidad de área (Datta y Kulkarni, 2012; Sulistiono y col., 2017; Ehsanipour y col., 2019; Wilches-Ortiz y col., 2019). Con respecto al índice de madurez de la caña a los 15 meses después de trasplante mdt se observan diferencias estadísticas, en donde la inoculación con R. irregularis (T2) presentó el valor más alto (Figura 2b), coincidiendo con Ehsanipour y col., (2019) que consideraron que la inoculación con HFMA favorece de forma positiva la obtención del índice de madurez adecuado para la cosecha de la caña de azúcar.
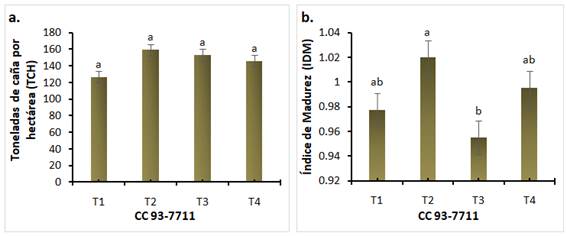
Figura 2 Gráficos de resultados en caña de azúcar. a). Rendimiento de caña por hectarea (t.ha-1). b). Índice de madurez a los 15 mdt. T1: A. mellea, T2: R. irregularis, T3: Control 50% fertilización sin inoculación, T4: Control 100% fertilización sin inoculación. Medias con letras diferentes indican diferencias significativas entre tratamientos (Tukey, p≤ 0,05)
3.2 Rendimiento en panela
Volverás y col., (2020) reportan que el porcentaje de conversión de caña a panela (rendimiento a panela) tiene una alta importancia económica y técnica. La variable de conversión de panela no presentó diferencias estadísticas, pero se observó que el tratamiento de inoculación de A. mellea con el 50 % de fertilización (T1) logró sobrepasar en un 0,05 % al T4 (Figura 3a), demostrando que la inoculación de este microorganismo puede reducir la fertilización en un 50%. Estudios realizados por Volverás y col., (2020) encontraron que el porcentaje de conversión a panela disminuyó en tratamientos con menores aportes de fertilizantes N-P-K, por tanto la inoculación de A. mellea contribuye en la fertilización con un porcentaje igual o mayor de conversion de caña a panela. En la variable de toneladas de panela por hectárea (TPH) no se encontraron diferencias estadísticas (figura 3b). Sin embargo, se observó que T2 (R. irregularis con el 50 % de fertilización) presentó un rendimiento mayor T4, demostrando los beneficios de la inoculación con este microorganismo, reflejada en un incremento de 3,33 TPH respecto al control (T4) (Figura 3b).
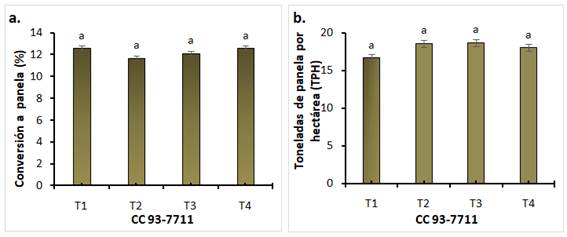
Figura 3 Gráficos de resultados en panela. a. Porcentaje de conversión de caña a panela. b. Producción toneladas de panela por hectárea. T1: A. mellea, T2: R. irregularis, T3: Control 50% fertilización sin inoculación, T4: Control 100% fertilización sin inoculación. Medias con letras diferentes indican diferencias significativas entre tratamientos (Tukey, p≤ 0,05)
3.3 Caracterización fisicoquímica de panela
En los tratamientos evaluados se presentaron diferencias estadísticas en los azúcares reductores siendo T1 (A. mellea con el 50 % de fertilización) el que presentó el mayor valor (9,3 %), en concordancia con Durán (2010), quien menciona que un contenido aceptable en panela no debe superar el 10 %, para evitar problemas de calidad (consistencia y vida útil). Según la norma colombiana, los contenidos totales de azúcares reductores y sacarosa deben estar en rangos de 5,5 a 12 % y de 75 a 83 %, respectivamente (Minsalud, 2006), lo que concuerda con los resultados obtenidos (Figura 4).
Se coincide con reportes que atribuyen a los HFMA un mayor incremento en la concentración de azúcares, como Glomus clarum en fresa (Soria, 2012), consorcios HFMA en maíz (Samano, 2014) y Rhizophagus intraradices en trigo (Gupta y col., 2021), adicionalmente, aunque no se observaron diferencias estadísticamente significativas en el fósforo soluble se destaca en el T1 un valor del 25% mayor al T4, así como un mayor porcentaje de humedad (10,2 %) con el T2 respecto a los demás tratamientos, valor que se encuentran en el rango (1,5 a 15,8%) reportado en panela (Jaffé, 2015; Lee y col., 2018).
Figura 4 Características fisicoquímicas de panela. T1: A. mellea, T2: R. irregularis, T3: Control 50% fertilización sin inoculación, T4: Control 100% fertilización sin inoculación. Medias con letras diferentes indican diferencias significativas entre tratamientos (Tukey, p≤ 0,05)
Por otra parte, en la Figura 5 se ilustra el Análisis de Correspondencia Canónica (ACC) con un 89,7% de la varianza total, destacándose en panela la correlación directa entre A. mellea con las variables de azúcares reductores y la humedad. Otros autores han informado la intervención de los HFMA con el incremento del contenido de azúcares en trigo (Triticum aestivum L.) como respuesta a la inoculación con Rhizophagus irregularis “antes” R. intraradices (Gupta y col., 2021).
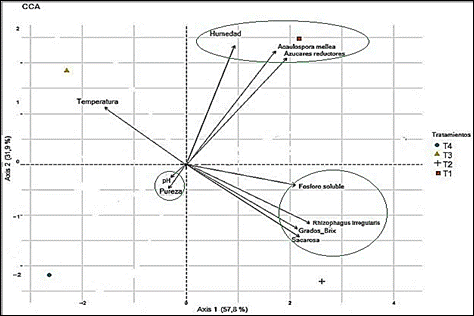
Figura 5 Análisis de correspondencia canónica (ACC) de las características fisicoquímicas de panela de caña de azúcar en relación con la inoculación de HFMA. T1: A. mellea, T2: R. irregularis, T3: Control 50% fertilización sin inoculación, T4: Control 100% fertilización sin inoculación
Se obtuvo una respuesta positiva entre R. irregularis y el contenido fósforo soluble en panela, esta relación se ha descrito en otros estudios, como el reportado por Baslam y col., (2011) en lechuga (Lactuca sativa L.) con un aumento nutricional de fosfatos, debido a los HFMA inoculados. Schubert y col., (2020) encontraron que las cepas de Rhizophagus irregularis mejoran la calidad y los grados brix en frutos de tomate (Solanum lycopersicum L.), lo cual coincide con el beneficio y la correlación de R. irregularis con los grados brix obtenidos en panela (Figura 5). En forma similar se encontró relación positiva de R. irregularis con la sacarosa en panela (figura 5), coincidiendo con otros estudios, como el de Shao y col., (2019), en donde obtuvieron un mejoramiento en la calidad de las hojas del Té (Camellia sinensis L.) con mayores contenidos de sacarosa con la inoculación de HFMA (Claroideoglomus etunicatum, Diversispora spurca y Diversispora versiformis).
CONCLUSIONES
En el presente estudio se encontró una respuesta positiva a la inoculación con HFMA 1 y 2 en la variedad de caña de azúcar CC93-7711 y su relación con la calidad y rendimiento de panela. Se presentaron diferencias estadísticas (P>0,05) en el índice de madurez con R. irregularis (T2) y un mayor contenido de azúcares reductores en panela con Acaulospora mellea (T1). En las demás variables se observó un beneficio de la inoculación con respecto a los controles, siendo T2 el tratamiento con los mayores valores en producción de tallos.ha-1, toneladas caña.ha-1; y T1 con mayores valores de conversión a panela, azúcares reductores, fósforo soluble y sólidos totales.
Las correlaciones demostraron una interacción de A. mellea con la humedad y azúcares reductores, y de R irregularis con los sólidos totales, sacarosa y fósforo soluble de panela.