Introducción
En la actualidad, el uso de las plantas medicinales como recurso terapéutico, es considerado en diversos países y por la Organización Mundial de la Salud (OMS), la medicina más natural, inocua y efectiva; que además de ser asequible y aceptada por la población, posee un costo racional 1.2 En Cuba ha adquirido gran relevancia, y constituye la base del sistema de medicina alternativa del país.3
A medida que se incrementa el uso de la medicina tradicional o alternativa, es necesario desarrollar los estudios fitoquímicos y su relación con la actividad biológica. La investigación de las plantas medicinales revela que las especies estudiadas con las herramientas de la etnomedicina tienen mayor probabilidad de presentar actividad farmacológica que otras seleccionadas al azar o por criterios quimiotaxonómicos.4 Por otro lado, la preocupación mundial de contrarrestar hábitos alimenticios inadecuados, que generan el aumento de enfermedades crónicas relacionadas con la dieta y el bajo costo de los antioxidantes naturales, ha provocado el incremento de investigaciones de plantas medicinales con actividad antioxidante.5-7 Los antioxidantes a bajas concentraciones retrasan o evitan significativamente la oxidación del sustrato oxidable, y pueden actuar neutralizando la acción nociva de especies reactivas por diferentes mecanismos, entre los que destacan la donación de átomos de hidrógeno, la transferencia de electrones individuales y la quelación de metales de transición.8-9
Entre las plantas que han recibido atención por sus propiedades antioxidantes se encuentra la Coccoloba uvifera L., especie del género Coccoloba, perteneciente a la familia Polygonaceae, común en las costas y playas de la región tropical americana y del Caribe.
En la flora de Cuba, se reportan 34 especies del género con un alto nivel de endemismo (25 especies). C. uvifera se puede reconocer con facilidad por sus hojas grandes, gruesas y casi circulares y los racimos del fruto en forma de uvas. Su tolerancia a los suelos salinos y al rocío del mar la convierten en una especie nativa excelente en las costas como barrera contra el viento y para la recuperación de dunas costeras.10
La C. uvifera es conocida comúnmente como uva de playa o uva caleta, es aprovechada con fines terapéuticos en la región de Centroamérica y el Caribe. El fruto de la planta es carnoso, jugoso, dulce, de fuerte aroma y buen sabor; es fuente de alimentación de especies de animales silvestres que habitan en ecosistemas costeros y ha sido utilizado por comunidades de las islas del Caribe para la elaboración de dulces.11
Los estudios etnobotánicos y fitoquímicos de C. uvifera que crece en la región del Caribe muestran el valor nutricional y el potencial medicinal de la especie, relacionados con su rica producción metabólica.11-13 Sin embargo, aun son pocos los estudios realizados en Cuba para fundamentar su uso en la medicina alternativa, lo que motivó la evaluación fitoquímica y de la actividad antioxidante de los extractos polares del fruto de C. uvifera que crece en las zonas costeras de la provincia Granma.
Materiales y métodos
La investigación fue realizada en el Laboratorio de Productos Naturales del Centro de Estudios de Química Aplicada (CEQA) de la Universidad de Granma, Cuba; en el período comprendido entre junio de 2019 a marzo de 2020. Los reactivos y disolventes empleados en los análisis fueron de calidad “puros” o “analíticos”, provenientes de las firmas Merck y Sigma-Aldrich.
Material vegetal
Las muestras de frutos maduros de la C. uvifera fueron recolectados en las zonas costeras de Manzanillo (latitud 20⁰23'23''N, longitud 77⁰6'31''O y 42 m de altitud), comunidad de Cabo Cruz en Niquero (latitud 19⁰50'31''N, longitud 77⁰43'40''O y 6 m de altitud) y Pilón (latitud 19⁰54'20''N, longitud 77⁰19'15''O y 14 m de altitud), todos municipios de la provincia Granma, Cuba, y fueron procesadas según la norma ramal de Salud Pública NRSP 309.14 La identificación y registro de la especie fue realizada en el Jardín Botánico Cupaynicú de la provincia Granma. Un ejemplar de la especie fue depositado con el registro 097-16-VI-04.
Preparación de los extractos
Para preparar los extractos y con la finalidad de lograr el mayor agotamiento de la droga en la muestra, se realizó la extracción sucesiva con disolventes de polaridad creciente. El material vegetal seco fue primero desengrasado con n-hexano, y posteriormente secado a temperatura ambiente durante 24 h.
A partir de una muestra de 10 g de la droga seca y desengrasada, fue preparado el extracto etanólico (EE) con 100 mL de etanol (90 %), por maceración con agitación durante 3 h en una zaranda para lograr mayor extracción de los metabolitos. El material vegetal fue separado por filtración. Posteriormente se procedió a la preparación del extracto acuoso (EA) utilizando 100 mL de agua destilada. Los extractos fueron concentrados en un rotoevaporador IKA RV10 a temperatura de 40 ºC, hasta obtener los extractos secos que fueron conservados a 4 ºC para la realización de los bioensayos.
Análisis de la composición fitoquímica
Para la determinación de los grupos de metabolitos secundarios presentes en los extractos (EE y EA) fue aplicado un conjunto de métodos específicos, rápidos y sencillos estandarizados para el tamizaje fitoquímico.15
Contenido de fenoles totales
El contenido de fenoles totales se determinó usando el método colorimétrico descrito por Makkar.16 A 1 mL de muestra de concentración 1mg/mL se añadió 0,5 mL de reactivo de Folin-Ciocalteu; después de agitada la mezcla, se dejó reposar por 5 min. Posteriormente se agregaron 2,5 mL de carbonato de sodio al 5 %, y la mezcla agitada se dejó reposar en la oscuridad por 40 min. Finalmente, se midió la absorbancia a 725 nm usando un espectrofotómetro UV/Vis (Rayleigh, modelo UV-1601, de procedencia China) y los resultados se expresaron como mg de ácido gálico equivalentes por gramo de extracto. Los ensayos fueron realizados por triplicado.
Determinación in vitro de la actividad antioxidante
Para estimar la actividad antioxidante in vitro de los extractos polares de C. uvifera, se determinó el poder reductor férrico y la capacidad antioxidante total. Fueron utilizadas tres concentraciones de los extractos 5, 10 y 50 mg/mL, y se dieron los resultados como el valor medio de tres réplicas de los análisis realizados.
Poder reductor férrico
El poder reductor férrico (FRP) se determinó por el método descrito por Oyaizu.17 Fue mezclado 1 mL de cada muestra con 2,5 mL de tampón fosfato [c(PO4 3-) = 0,5 mol/L, a pH = 7 ] y 2,5 mL de una disolución de ferricianuro de potasio al 1 %. La mezcla se incubó a 50 ºC durante 20 min; se adicionó 2,5 mL de ácido tricloroacético (TCA), 10 % m/v, y se centrifugó por 10 min a 3 000 rpm. Parte de la solución sobrenadante (2,5 mL) fue mezclada con 2,5 mL de agua destilada y 0,5 mL de cloruro de hierro (III) a 0,1 %. Finalmente, se determinó la absorbancia a 700 nm y los resultados se expresaron en μmol/mL como equivalentes de Fe (II).
Capacidad antioxidante total
Para la determinación de la capacidad antioxidante total (CAT) se usó el método descrito por Prieto et al.18 Se mezclaron 0,5 mL del extracto vegetal o del blanco (disolvente), 5 mL de disolución reactiva (0,6 mol/L de ácido sulfúrico, 28 mmol/L de fosfato sódico y 4 mmol/L de heptamolibdato de amonio) y se incubaron por 90 min a 95 °C. Se centrifugó por 3 min a 6 000 rpm, y se determinó la absorbancia del sobrenadante a 695 nm contra el blanco. Los resultados se expresaron en equivalentes de ácido ascórbico.
Análisis estadístico
A todos los datos obtenidos se le comprobó la normalidad por la prueba de Kolmogorov-Smirnov y la homogeneidad de varianza según Bartlett, se sometieron a un análisis de varianza (ANOVA) de clasificación simple y comparación múltiple de medias según la prueba paramétrica de Tukey a una probabilidad de error al 99 % (p < 0,01); empleando el paquete estadístico GraphPadPrism versión 6.01 para Windows (2012).
Resultados y discusión
Tamizaje fitoquímico de extractos polares del fruto de C. uvifera
La evaluación cualitativa de la composición fitoquímica realizada a los extractos etanólicos y acuosos del fruto de la especie que crece en las costas de tres municipios de la provincia Granma, reveló la presencia de varias familias de metabolitos secundarios de interés como se aprecia en la tabla 1. El extracto etanólico resultó ser más rico en metabolitos secundarios que el extracto acuoso.
Tabla 1 Tamizaje fitoquímico de extractos de frutos de C. uvifera L. que crecen en zonas costeras de la provincia de Granma
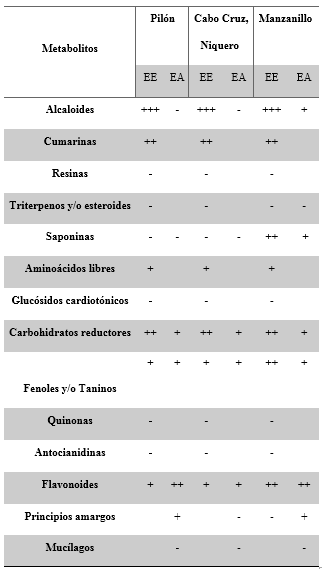
Leyenda: (EE) Extracto etanólico; (EA) Extracto acuoso; (+) Presencia; (++) Abundancia; (-) Ausencia; ( ) No explorado Fuente: Elaboración propia.
Los resultados evidencian que los extractos del fruto de C. uvifera presentan una composición cualitativa similar en las tres zonas estudiadas. Es común en los EE la abundancia de alcaloides, cumarinas y carbohidratos reductores. Los EA estudiados muestran muy poca variabilidad en cuanto a su composición metabólica, destacando solamente la presencia de carbohidratos reductores, flavonoides, fenoles y taninos, así como principios amargos; mientras que, muestran abundancia de flavonoides excepto en las muestras de Cabo Cruz en el municipio de Niquero.
La diferencia del perfil de metabolitos secundarios de los extractos de C. uvifera de las zonas costeras de la provincia de Granma estudiadas, pudiera deberse a las diferencias en las condiciones geográficas del hábitat, que influyen en la composición fitoquímica cualitativa y cuantitativa de la especie y en su actividad biológica. Diversos reportes se han realizado sobre la variación del contenido de fenoles de una planta o género y su actividad antioxidante por modificaciones de las condiciones geográficas.12,13,19
Las muestras procedentes de la zona costera de Manzanillo, en general, presentaron mayor diversidad. En los EA destaca la presencia de alcaloides y saponinas, mientras los EE resultaron abundantes en saponinas, flavonoides, fenoles y taninos. El contenido de estas familias de metabolitos en diversas especies ha sido relacionado con la acción antioxidante.5,6 Recientemente, la actividad antioxidante in vitro de Coccoloba cowelliia se correlacionó con la presencia de fenoles, flavonoides y taninos.20
A pesar del uso popular que tiene la uva caleta, existen pocos estudios que demuestren científicamente su uso empírico.11-13 Considerando los resultados del tamizaje fitoquímico, se seleccionaron los frutos de la zona costera de Manzanillo para determinar el contenido de fenoles totales y la potencial actividad antioxidante de sus extractos polares.
Contenido de fenoles totales
La estimación del contenido total de fenoles se basa en la utilización del reactivo de Folin-Ciocalteu, donde el anión molibdato es reducido a óxido de molibdeno durante la oxidación de los polifenoles. La cantidad de óxido de molibdeno producida se determina a 725 nm, con lo cual se estima la cantidad de polifenoles presentes. Los resultados se expresaron en mg de ácido gálico equivalentes/g de muestra.18 Para la determinación se construyó una recta patrón de ácido gálico y el alto nivel de ajuste al modelo lineal que presenta la recta (R2 = 0,996 9; p < 0,000 1) confirmó la calidad de la curva de calibración utilizada para estimar la concentración de compuestos fenólicos presentes en los extractos vegetales.21
El EE posee un contenido de fenoles totales de 110,17 ± 0,061 mg equivalentes de ácido gálico por g de extracto, que difiere estadísticamente de forma significativa con el EA (26,18 ± 0,072) que posee un contenido mucho menor como se observa en la figura 1 .
El contenido de fenoles determinado para el EE es similar a los valores reportados por otros estudios realizados a esta especie en diferentes regiones costeras de México.12,13 Los resultados obtenidos constituyen el primer reporte en Cuba del estudio de la composición fitoquímica de los extractos polares del fruto de la C. uvifera.
Actividad antioxidante in vitro de los extractos del fruto de C. uvifera
Considerando que son muchas las especies reactivas y los mecanismos de reacción involucrados en los procesos de estrés oxidativo, se estimó la actividad antioxidante de los extractos polares de C. uvifera determinando el poder reductor férrico y la capacidad antioxidante total.
Los resultados del Poder Reductor Férrico (FRP por sus siglas en inglés) de los extractos expresados en μmol/mL como equivalentes de Fe (II), se observan en la figura 2. El poder reductor de los extractos se puede detectar basándose en la capacidad de reducir los iones férricos en la mezcla de reacción a iones ferrosos. El reactivo de ferricianuro se incuba primero en tampón fosfato a pH 6,6 con el antioxidante, y el producto de reducción se combina con los iones de hierro (III) añadidos posteriormente para producir azul de Prusia, que se detecta a 700 nm. El ensayo demostró que los dos extractos analizados presentan capacidad para reducir los iones de hierro (III) en las concentraciones ensayadas.
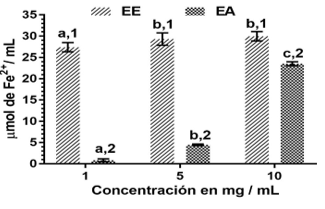 Leyenda: Letras diferentes para un mismo extracto significan diferencias estadísticamente significativas entre las concentraciones. Números diferentes para una misma concentración significan diferencias estadísticamente significativas entre los extractos
Leyenda: Letras diferentes para un mismo extracto significan diferencias estadísticamente significativas entre las concentraciones. Números diferentes para una misma concentración significan diferencias estadísticamente significativas entre los extractosFig. 2 Potencial reductor férrico (FRP) de los extractos polares de C. uvifera procedente de la zona costera de Manzanillo.
La actividad determinada por este método se incrementa con el aumento de la concentración para los dos extractos, siendo estadísticamente significativo de 5 a 10 mg/mL en el EA, mientras que no hay diferencias estadísticamente significativas entre estas concentraciones para el EE. En todas las concentraciones estudiadas se encontró diferencia significativamente mayor del EE con respecto al EA.
Los valores más altos del poder reductor se encontraron para los extractos a concentración de 10 mg/mL (29,97 ± 1,10; 23,53 ± 0,46 equivalentes de Fe (II), respectivamente). Estos valores resultaron superiores a los encontrados por Méndez y col. 20, en un estudio realizado a las hojas de Coccoloba cowelli con valores de FRP de 12,74 μmol, equivalentes de Fe2+/mL para esta misma concentración.
Los resultados de la evaluación de la Capacidad Antioxidante Total (CAT), al igual que para el poder reductor férrico, mostraron un aumento de la actividad con el incremento de la concentración, para todos los extractos (tabla 2).
Tabla 2 Capacidad antioxidante total de los extractos del fruto de C. uvifera en mg/mL equivalentes de ácido ascórbico (Media ± DE).

Leyenda: Letras diferentes para un mismo extracto significan diferencias estadísticamente significativas entre las concentraciones. Números diferentes para una misma concentración significan diferencias estadísticamente significativas entre los extractos.
La mayor tasa de cambio se produce entre las concentraciones de 5 y 10 mg/mL, y el mayor valor de equivalentes de ácido ascórbico se obtuvo para el EE a 10 mg/mL. En todos los casos los valores de CAT se corresponden con valores de equivalentes de ácido ascórbico menores a 1 mg/mL, lo que se corresponde con la alta sensibilidad de este método al mecanismo antioxidante de la vitamina C.22
De manera general, los EE resultaron ser los de mayor actividad, al mostrar los valores más altos de poder reductor férrico y de capacidad antioxidante total, respectivamente. Los valores de CAT mostrados resultan concordantes con los obtenidos para el FRP, lo que evidencia la presencia en los dos extractos de compuestos donadores de electrones, teniendo en cuenta que ambas técnicas miden la capacidad antioxidante de los compuestos donadores de electrones.12,22 Entre los metabolitos que son detectados por este método, destacan los tocoferoles, las quinonas, los terpenos en general y los polifenoles.23,24
Con el objetivo de determinar la relación entre el contenido de fenoles totales y la actividad antioxidante de los extractos del fruto de C. uvifera, se realizó un análisis de correlación lineal entre estos resultados como se observa en la figura 3.
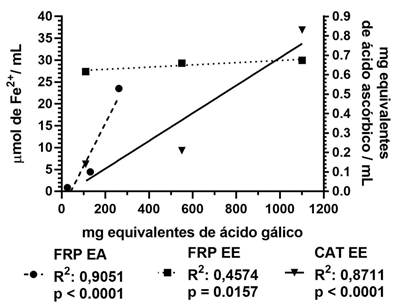
Fig. 3 Relaciones significativas entre el contenido de fenoles totales y el FRP y la CAT de los extractos del fruto de C. uvifera
La capacidad antioxidante total del EE se asoció fuertemente con la cantidad de fenoles presentes en el fruto (R2 = 0,8711 y p < 0,000 1). Por otro lado, la relación del contenido fenólico resulta altamente significativa y positiva para el FRP del EA (R2 = 0,9051 y p < 0,000 1). En el caso del FRP del EE se evidencia una débil relación con la concentración de fenoles, que sugiere la influencia sobre la actividad reductora de otras familias de metabolitos, que pudiese ser atribuida a los alcaloides que abundan en el EE. Estos resultados coinciden con otros autores sobre la implicación de los compuestos fenólicos en la actividad antioxidante medida por estos métodos.13,24
Conclusiones
Los extractos etanólicos y acuosos del fruto de C. uvifera mostraron actividad antioxidante in vitro por los métodos evaluados, siendo concordantes los resultados obtenidos con la presencia en los extractos de compuestos donadores de electrones. La mayor actividad se produjo en los extractos etanólicos, que puede estar asociada al mayor contenido de compuestos fenólicos. Los resultados obtenidos son similares a los reportados para otras especies del género, y convierten al fruto en una potencial fuente de antioxidantes. Los resultados constituyen el primer reporte de la composición fitoquímica y de la actividad antioxidante de los extractos polares del fruto de la C. uvifera en Cuba














