Introducción
El síndrome de ojos secos es una patología multifactorial de la unidad funcional lagrimal, cuya manifestación comienza con síntomas de molestias, alteraciones de la visión e inestabilidad de la película lagrimal, dando lugar a daños en la superficie ocular. Se estima que afecta entre un 5-50 % de la población mundial.1,2,3,4) Esta afectación usualmente cursa de manera bilateral y, por lo general, se vuelve crónica una vez que se manifiesta. Entre los síntomas característicos de esta patología se encuentran sequedad, prurito, ardor, sensación de cuerpo extraño, visión borrosa, disminución de la agudeza visual, fatiga ocular, ojos rojos y fotofobia. Además, también puede estar asociado a un incremento de la osmolaridad de la lágrima, junto con inflamación de la superficie ocular.4,5
El incremento en la frecuencia de aparición, en la población adulta joven, está asociada al creciente uso de pantallas y dispositivos electrónicos, el uso de tecnologías de la información, condiciones medioambientales, hábitos de vida y complicaciones post-quirúrgicas.4,6,7)
El paciente con ojo seco lo es, de manera general, de por vida, por lo que se requiere una adecuada cooperación y régimen de tratamiento para preservar una buena visión y una disminución de las molestias.5,7)
Las lágrimas artificiales, solución oftálmica, constituyen a nivel mundial el tratamiento de elección en el síndrome de ojos secos, con la finalidad de aumentar la humedad de la superficie ocular, además de lubricar el movimiento del parpadeo y así disminuir la sintomatología del paciente afectado.4,6,8,9)
Las soluciones oftálmicas son preparados líquidos estériles, isotónicos y poco irritantes, que se aplican en forma de gotas directamente en los ojos. Generalmente se dispensan en envases multidosis, aunque también se fabrican monodosis. Las lágrimas artificiales, específicamente las formuladas en solución acuosa, contienen diversos Ingredientes Farmacéuticos Activos (IFA) los que incrementan la viscosidad y brindan lubricación. Entre los más empleados están los derivados de la celulosa como la carboximetilcelulosa e hipromelosa o hidroxipropil metilcelulosa (HPMC), gelatina, dextrana 70 y polioles, como son: PVP-K30, hialuronato de sodio, polietilenglicol y propilenglicol. Además, se incluyen otros excipientes como los agentes isotonizantes, tensoactivos, reguladores de pH, antioxidantes y preservantes antimicrobianos.4,9,10,11)
Debido a la gran sensibilidad del órgano al que están destinados, la preparación de estos medicamentos está sujeta a requerimientos específicos, en lo que se refiere a pureza, esterilidad, transparencia, isotonicidad, conservación, viscosidad y ausencia de partículas extrañas.9,12,13,14,15) Requieren sistemas de control adecuados, donde todos los componentes del producto, equipos de fabricación, áreas de trabajo y personal, se encuentren bajo control y óptimas condiciones, garantizando la calidad final de esta forma de dosificación, logrando una buena actividad y tolerancia fisiológica.9,12,13,14,15,16)
El Cuadro Básico de Medicamentos nacional, solo cuenta con lágrimas artificiales en envases multidosis para tratar esta afección, aunque la red de farmacias internacionales del país se abastece, comercializa y distribuye, de forma limitada, con productos importados.
La empresa Laboratorios aica+, tiene entre sus objetivos estratégicos, desarrollar e introducir nuevos productos al Cuadro Básico de Medicamentos del Ministerio de Salud Pública. Actualmente ha encaminado la investigación y desarrollo de formulaciones en frascos monodosis, aprovechando la capacidad productiva de la máquina conformadora, dosificadora y selladora de frascos Bottelpack, en la Unidad Empresarial de Base (UEB) Julio Trigo, de dicha empresa, ampliando así el surtido para el consumo nacional y con vistas a la exportación.
Como consecuencia de lo anterior, el objetivo del trabajo fue desarrollar una formulación de lágrimas artificiales en envases monodosis, para el tratamiento del síndrome de ojos secos.
Materiales y métodos
Sustancia de referencia secundario de hipromelosa 2906, Lote 190409. Valoración de metoxilo 28,6 %, hidroxipropoxilo 6,2 % (UEB Julio Trigo, Cuba), trazable al material de referencia primario internacional (USP) de hipromelosa 2906 (EE. UU.). Cloruro de sodio, MP 5907180002, Lote: K49315900, Alemania. Cloruro de potasio, MP 551507036, Lote: K44770637, Alemania. Fosfato de sodio monobásico 2H2O, MP 6304180003, Lote: 0001314126, España. Fosfato de sodio dibásico anhidro, MP 6203180003, Lote: K49604685, Alemania.
Elaboración de la solución oftálmica
En la planta de producción, UEB Laboratorio Farmacéutico Julio Trigo, se elaboraron tres lotes pilotos de 6 L cada uno, de la formulación constituida por la hipromelosa 2906 como IFA, cloruro de sodio y de potasio (agentes isotonizantes), fosfato de sodio monobásico dihidratado y de sodio dibásico anhidro (reguladores de pH) y agua purificada obtenida por el sistema de ósmosis inversa de la planta de tratamiento de agua (UEB Julio Trigo).17)
El proceso de elaboración del producto se realizó en un ambiente clase C, teniendo en cuenta el cumplimiento de las Buenas Prácticas de Fabricación, según lo establecido, y garantizando los máximos niveles de seguridad microbiológicos en la entidad productora.16,17,18)
Se realizaron las pesadas del IFA y excipientes, teniendo en cuenta la valoración y el contenido de agua de cada una. El proceso de incorporación y disolución de las mismas se efectuó en un presurizador aforado (Sartorius Stedimde, Alemania) de 20 L de capacidad. Se añadió el 60,0 % del agua purificada inicial, a una temperatura de 85-90 ºC. Se incorporó la hipromelosa 2906 con agitación constante (≥ 60 rpm) hasta su total dispersión. Se disminuyó la temperatura hasta 18 ºC, comprobándose que el producto quedara totalmente disperso a esa temperatura. En otro un recipiente, con el 30 % del volumen total del agua a 40 ºC, se añadió el fosfato de sodio dibásico anhidro y seguidamente el fosfato de sodio monobásico dihidratado, con agitación hasta su completa disolución. Posteriormente, se incorporaron el cloruro de sodio y el cloruro de potasio. Esta disolución se adicionó al presurizador que contenía la hipromelosa ya disuelta, manteniendo una velocidad de agitación ≥ 60 rpm, durante 10 min. Se tomó una muestra para análisis del pH y finalmente se enrasó con agua purificada. El proceso de disolución de cada uno de los componentes, para cada uno de los lotes, se realizó manteniendo agitación constante, con la utilización de un agitador mecánico IKA RW 28 Basic (Alemania).
Realizados los controles del proceso y comprobado que los resultados eran adecuados se procedió a realizar la filtración esterilizante y transferencia del producto. 17,18,19)
La transferencia del producto hacia la máquina Bottelpack TIP 321 Romelag (Alemania) se realizó aplicando un flujo de nitrógeno estéril a presión constante, filtrando la solución con un filtro cartucho Sartobran P de 10 pulgadas (Sartorius, Alemania), con una porosidad de 0,2 μm y se dosificó a un volumen de 0,5 mL en la máquina (Bottelpack) conformadora, llenadora y selladora de frascos plásticos.
Los lotes fueron identificados como EP 18025, EP 18026 y EP 18027. El rendimiento teórico por cada lote fue de 12000 viales monodosis x 0,5 mL. Se realizaron las pruebas para la comprobación de la integridad de las membranas filtrantes con el Sartocheck 4 plus (Sartorius, Alemania), siguiendo los criterios establecidos.17,19)
Evaluación de la solución oftálmica
Controles de proceso
A cada lote se le evaluaron los parámetros que se describen a continuación: (17,20)
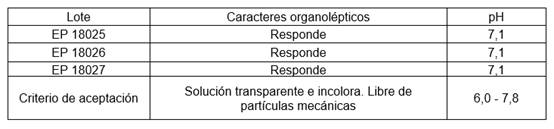
Características organolépticas: A 50 mL de la preparación se le comprobó el color. La solución fue observada contra fondo blanco y negro, para determinar si había o no presencia de partículas. Criterio de aceptación: Solución transparente e incolora, libre de partículas extrañas.
pH: Se utilizó un pHmetro Hannaa (Rumania) realizando las mediciones, por triplicado, a 25 ± 2 ºC. En un vaso de precipitado se vertieron 30 mL de muestra y se determinó el pH de la solución. Criterio de aceptación: 6,0 - 7,8.
Valoración: Se incorporaron 2 mL de la muestra, 2 mL de la solución de referencia y 2 mL del blanco en tubos con tapa roscada. Se agregaron, a cada tubo, 5 mL de una solución de difenilamina (Merck, Alemania) y se mezcló. Cada uno de los tubos tapados, se colocaron inmediatamente en el baño de aceite, a temperatura constante, entre 105-110 °C, durante 30 min. Se determinaron las absorbancias (espectrofotómetro UV-Vis Shimadzu, Japón) de las soluciones de referencia y de las muestras, a 635 nm, empleando la solución acuosa como blanco. Criterio de aceptación: (2,5-3,4) mg/mL y (85,0-115,0) %.20
Procesos y parámetros
Se realizó el monitoreo de los parámetros involucrados en la obtención del producto final. 16,17,18,19
Proceso 1: verificación del agua purificada, calidad físico-química y microbiológica. Criterios de aceptación: La conductividad debe ser ≤ 2,1 µs/cm; el pH debe estar entre 5,0 y 7,0 y no debe contener materia orgánica.
Proceso 2: Verificación de los parámetros de humedad relativa y temperatura del área de formulación. Criterios de aceptación: La humedad debe estar en un rango de 60 ± 10 % y la temperatura en 20 ± 3 ºC.
Proceso 3: Chequeo de pesada de las materias primas. Criterios de aceptación: Las cantidades de las materias primas deben corresponderse con las establecidas para el tamaño del lote.
Proceso 4: proceso de formulación. Verificación del proceso de disolución de las materias primas, velocidad y tiempo de agitación. Criterios de aceptación: La velocidad de agitación debe ser ≥ 60 rpm hasta concluir la total disolución.
Proceso 5: Prueba de integridad del filtro utilizado en el proceso de formulación. Criterios de aceptación: La prueba de integridad de la membrana del filtro por Sartocheck debe ser ≤ 40 mL/10 min.
Proceso 6: Control de los parámetros técnicos del área de conformación, dosificación y sellado de los frascos plásticos. Criterios de aceptación: Ver los descritos en el proceso 2.
Proceso 7: control de los parámetros del agua utilizada en la limpieza y esterilización de los conductos del producto de la máquina Bottelpack. Criterios de aceptación: la conductividad debe ser ≤ 2,1 µs/cm; el pH debe estar entre 5,0 y 7,0 y no debe contener materia orgánica.
Proceso 8: control de la transferencia y la filtración del producto durante el llenado. Criterios de aceptación: La filtración se realiza con un filtro cartucho Sartobran P de 0,2 µm, a una presión de nitrógeno ≥ 1,5 bar.
Proceso 9: control de calidad del proceso de conformación, dosificación y sellado de los frascos. Criterios de aceptación: los viales deben estar perfectamente conformados y sellados. La dosificación no debe ser menor de 0,5 mL.
Proceso 10: pruebas de integridad de los filtros utilizados en el proceso de llenado. Criterio de aceptación: la prueba de integridad a los filtros de aire por Sartocheck debe ser ≤ 40 mL/10 min, el filtro del producto debe ser ≥ 3200 mbar.
Control de calidad de los lotes pilotos
Además de los controles de proceso ya descritos, se evaluaron los parámetros que se describen a continuación.17,20)
Contenido individual: con ayuda de una jeringuilla de 5 mL calibrada, se extrajo el contenido de 30 viales, tomados en diferentes momentos del proceso de llenado. Se transfirió el contenido de los mismos, individualmente, a una probeta graduada de 5 mL. Criterio de aceptación: El volumen individual no debe ser menor de 0,5 mL.
Contenido total: se midió el volumen total de cinco viales monodosis. Se vertió el contenido del vial monodosis en una probeta graduada de 5 mL. Criterio de aceptación: el volumen total no debe ser menor de 2,5 mL.
Viscosidad: se empleó el método de los capilares. Se llenó el viscosímetro Ubbelohde (Alemania), a través del primer tubo, con una cantidad suficiente del fluido muestra. El viscosímetro se sumergió en un baño de agua y se controló la temperatura a ± 0,1 ºC. El viscosímetro se mantuvo en posición vertical durante 30 min, hasta que la temperatura de la muestra alcanzara el equilibrio. Criterio de aceptación: el tiempo de flujo mínimo debe ser 200 seg.17,21)
Prueba de esterilidad: se tomó el contenido total de 20 viales monodosis de lágrimas artificiales, solución oftálmica, y se realizó el procedimiento por el método de filtración por membrana. Criterio de aceptación: ausencia de microorganismos viables.20)
Conteo de partículas: la verificación se ejecutó por el método de obstrucción de la luz, que permite la determinación automática del tamaño de las partículas y el número de partículas, según el tamaño. Criterio de aceptación: ≥ 10 µm 50 partículas/mL; ≥ 50 µm 2 partículas/mL.20
Resultados y discusión
El desarrollo de la formulación de lágrimas artificiales sin preservo favorecerá la sensación de bienestar que anhela el paciente con síndrome de ojos secos, garantizando la efectividad del tratamiento, sin causar las molestias que provoca la presencia del cloruro de benzalconio, conservante utilizado en las lágrimas convencionales, generando ardor en el sitio de aplicación, además de lisis en el tejido ocular, por la aplicación del medicamento de manera prolongada.4,10,11,14)
La nueva formulación brindará bienestar, menores molestias y reacciones adversas a los pacientes, y ayudará a mantener la humedad en la superficie exterior de los ojos, ya que su composición es similar a las lágrimas humanas. La misma tiene una composición similar a las lágrimas humanas, isotónica y con una concentración de hipromelosa al 0,3 %.
La UEB Julio Trigo, cuenta con la experiencia técnica y profesional en la elaboración de soluciones oftálmicas. La formulación de lágrimas artificiales sin preservo presenta el mismo IFA y rango de pH, que la formulación de lágrimas con conservantes, que se dosifica en frascos multidosis.
Los resultados de los controles de proceso realizados a los lotes pilotos se muestran en la tabla 1.
Se comprobó que la solución era transparente, incolora y libre de partículas extrañas. Cumplió con el rango de valoración y de pH, manteniéndose dentro de los límites fisiológicos.17) Una vez aprobados los controles de los lotes pilotos, se procedió a la conformación, dosificación y sellado en la máquina Bottelpack TYP 321, en viales transparentes de 0,5 mL de capacidad, y a la revisión visual del 100 % de las unidades obtenidas.
Cada uno de los procesos tecnológicos involucrados en el escalado piloto de la solución oftálmica, como velocidad y tiempo de agitación, disolución, pH y filtración se encontraron dentro de los intervalos permisibles (tabla 2).
Tabla 2 Procesos y parámetros evaluados en el escalado piloto
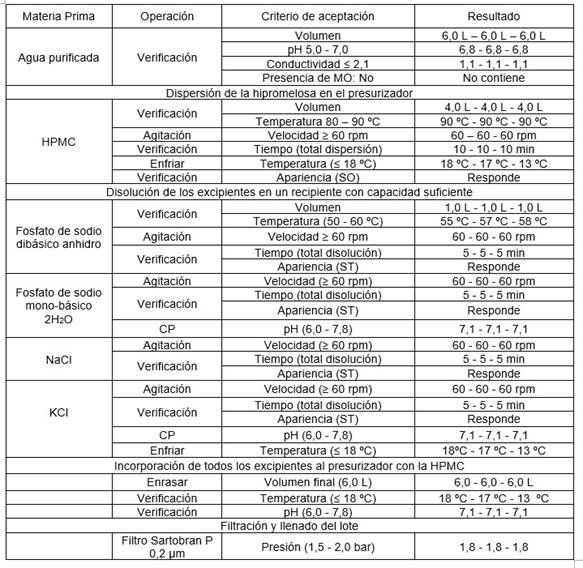
HPMC: Hipromelosa; CP: Control de proceso; MO: Materia orgánica; ST: Solución transparente; SO: Solución opalescente
En los colirios, a diferencia de otros medicamentos, la esterilidad del producto se garantiza por medio de la filtración esterilizante realizada durante el proceso de llenado de la solución oftálmica. Por lo tanto, se analizó la integridad de los filtros, por medio del Sartocheck 4 plus (tabla 3).
Tabla 3 Prueba de integridad realizada a los filtros utilizados en el escalado piloto

MN: Filtro de nitrógeno del tanque de mezclado, C: Conforme
Como se aprecia, se demostró la integridad de cada una de las membranas empleadas en cada tipo de filtro utilizado en el proceso productivo, según las pruebas empleadas, lo que garantizaría el cumplimiento de la esterilidad de las soluciones elaboradas.16-19
Se cumplieron las especificaciones de calidad establecidas para el producto en esta etapa del proceso. Las propiedades y características de los filtros empleados en el escalado piloto no tuvieron un impacto negativo en la calidad de la solución oftálmica, lo que demuestra que pueden ser utilizados, con toda seguridad, en el proceso de filtración del producto.16,17,18,19
Los resultados del control de calidad realizado a los lotes pilotes, recién elaborados, se muestran en la tabla 4.
Tabla 4 Control de calidad de los lotes pilotos recién elaborados
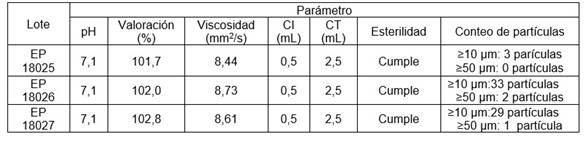
CI: contenido individual; CT: contenido total
Tanto los valores de pH como los de valoración del producto, cumplieron con los rangos establecidos en cada caso, 17,20) demostrando que, durante el proceso de elaboración, se logró una adecuada homogeneidad de los componentes. También se comprobó que en los tres lotes se obtuvieron soluciones transparentes, incoloras y libres de partículas mecánicas, cumpliendo satisfactoriamente la prueba de caracteres organolépticos.
El contenido individual para cada vial monodosis, se encontró en el rango especificado y se mantuvo durante todo el proceso de conformación y dosificación, indicando que el llenado y sellado de los frascos y la funcionabilidad de la máquina fueron correctos, de acuerdo a lo establecido en la Buenas Prácticas de Fabricación para productos estériles.16,17)
El análisis microbiológico cumplió con las especificaciones descritas en la monografía. 20) Diariamente se realizó el chequeo visual donde se observó la ausencia de crecimiento microbiano en las muestras. A los 14 días de incubación, al mantener el mismo comportamiento, se confirmó la ausencia de microorganismos viables, definiendo que la preparación cumplió con las especificaciones de calidad microbiológicas establecidas.
Por su parte el ensayo de esterilidad demostró que no hubo crecimiento microbiano en ninguno de los lotes, por lo que se evidenció que el producto estaba estéril, confirmando que se trabajó en condiciones controladas de contaminación.
El conjunto de estos resultados demuestra el cumplimiento de las Buenas Prácticas de Fabricación y reproducibilidad del proceso tecnológico, en las condiciones actuales de la UEB, que cuenta con todo el equipamiento y los recursos necesarios para asumir esta nueva producción, lográndose excelentes índices de calidad de la formulación de lágrimas artificiales sin preservo.
Conclusiones
Se demuestra que la formulación de lágrimas artificiales sin preservo, solución oftálmica, cumple con las especificaciones de calidad establecidas, demostrando la reproducibilidad del procedimiento de fabricación en la entidad productiva. Los lotes pilotos envasados en viales monodosis de polietileno de baja densidad, con capacidad de 0,5 mL, tienen adecuada calidad farmacéutica.