INTRODUCCIÓN
El glioblastoma (GB) es el segundo tumor más frecuente de todos los tumores del sistema nervioso central (SNC) y representa el 14,5 % de ellos. 1 Su incidencia anual internacional oscila entre 4,2 y 12,8 casos por cada 100 000 habitantes, 1 siendo en Cuba discretamente más baja. 2 Las cifras de mortalidad se mantienen cercanas a la de incidencia.
Los GB pueden subdividirse teniendo en cuenta la mutación de la enzima isocitrato deshidrogenesa (IDH, por sus siglas en inglés), en GB mutantes y GB salvajes. El 90 % de GB son salvajes, y afectan a adultos con un promedio de edad de 62 años y con una relación hombre-mujer de 1,3:1. Tienen preferencia por la localización supratentorial, aunque pueden tener otras presentaciones atípicas e infiltrar estructuras cerebrales adyacentes y distantes. También se conoce como GB primario o novo, pues no se le reconoce una lesión precursora de bajo grado. 3,4
En 1973 se logró demostrar la presencia de células granulares en un tumor del parénquima cerebral, distinguiéndose de las lesiones benignas granulares de la neurohipófisis. 5 Gracias a la exhaustiva revisión de Schittenhelm/Psaras reportada en el año 2010, 6 la Organización Mundial de la Salud (OMS) incluyó en la clasificación de los tumores del SNC a los astrocitomas/glioblastomas de células granulares como un subtipo de patrón histológico y de composición celular de los tumores astrocitarios. 3 Esta clasificación de tumores se reconoce como astrocitomas de células granulares (ACG), independientemente del grado de clasificación de la OMS (II, III o IV).
Son muy pocos los casos reportados en el mundo con esta variedad histológica de GB. El caso presentado, resultó ser el primero en Cuba.
El objetivo de la presentación del caso clínico es describir las características clínicas, imagenológicas, anatomopatológicas, evolución clínica y manejo terapéutico de un paciente operado de un GB de células granulares, el primero reportado en Cuba.
PRESENTACIÓN DEL CASO
Anamnesis y examen clínico
Se presenta un paciente masculino, de 52 años de edad, con antecedentes de hipertensión arterial y diabetes mellitus tipo II. El paciente era médico de profesión y con antecedentes de haber trabajado fuera de Cuba, en un país latinoamericano meses anteriores a la presentación del cuadro clínico. En junio del 2018 tuvo una crisis epiléptica de inicio generalizado tónico-clónica, por lo que fue ingresado. Progresivamente se instauró una hemiparesia izquierda a predominio braquial y proximal con paresia facial central mínima del mismo lado.
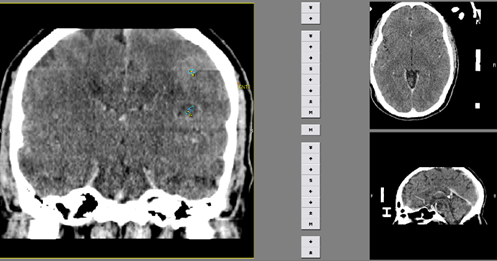
Se le realizó tomografía computarizada de cráneo simple y contrastada que mostró lesiones múltiples cerebrales. Se le indicaron estudios complementarios para detección de lesión tumoral en el resto del organismo (pulmón, próstata, riñón, intestino) y estudios específicos, diagnósticos para parasitosis del SNC, siendo todas negativas. Se realizó resonancia magnética (RM) cerebral de 1,5 T (Fig. 1) para evaluar la realización de biopsia cerebral por estereotaxia (Fig. 2), siendo remitido a nuestro centro.
Estudios imagenológicos
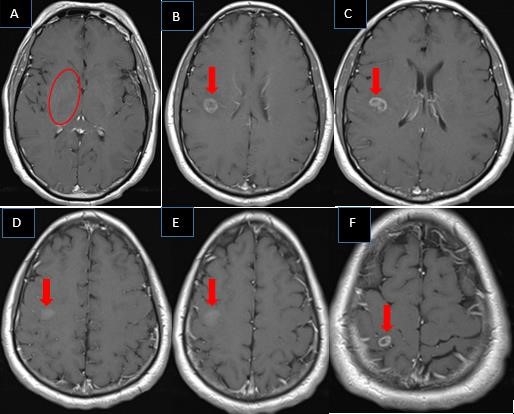
Se realizó RM cerebral contrastada con gadolinio de 1,5 Tesla (T) preoperatoria. En los cortes axiales, en secuencia de T1 se observó lesión difusa del tálamo derecho que no realzó con el contraste (A) y lesiones cavitadas múltiples adyacentes de aproximadamente 8 a 10 mm de diámetro, de bordes bien definidos, hipointenso en su interior (centro necrótico) y bordes que con el contraste realzaron en anillo (B y C) y con realce nodular (D y E) en región frontal posterior. En región parietal alta derecha se observó otra lesión con centro necrótico que se realzó con contraste en anillo de aproximadamente 5 mm de diámetro (F). No se observó desplazamiento de las estructuras de la línea media. Ventrículos de tamaño y morfología normales. Hallazgos compatibles con un GB multicéntrico (Fig. 1)
 Fuente: Archivo de imágenes del Dpto. de Imagenología del CIREN.
Fuente: Archivo de imágenes del Dpto. de Imagenología del CIREN.Fig. 1 Imagen de RM cerebral contrastada con gadolinio de 1,5 Tesla (T) preoperatoria. En los cortes axiales, en secuencia de T1 se observa lesión difusa del tálamo derecho que no realzó con el contraste (A) y lesiones cavitadas múltiples adyacentes, de aproximadamente 8 a 10 mm de diámetro, de bordes bien definidos, hipointenso en su interior (centro necrótico) y bordes que con el contraste realzan en anillo (B y C) y con realce nodular (D y E) en región frontal posterior. En región parietal alta derecha se observa otra lesión con centro necrótico que se realza con contraste en anillo de aproximadamente 5 mm de diámetro (F). No existe desplazamiento de las estructuras de la línea media. Ventrículos de tamaño y morfología normales.
Estudios histológicos e inmunohistoquímicos
Aspecto macroscópico: Se recibieron 2 frascos procedentes de una biopsia estereotáctica (Fig. 3):
Rotulado como lesión cerebral (grande) frontal posterior que incluyó varios fragmentos, el mayor de 0,8 cm, color pardo.
Rotulado como lesión cerebral frontal alta compuesto por 4 fragmentos, el mayor de 0,4 cm, color blanco grisáceo.
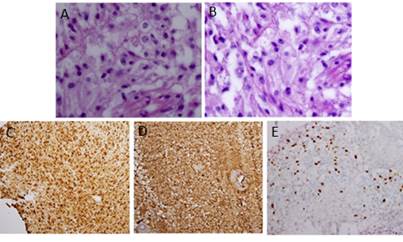
Diagnóstico histológico: Población compacta de células granulares rodeadas por reticulina pericelular, positivas a la proteína ácida gliofibrilar, proteína S100 y CD68 (focalmente). El Ki7 positivo entre un 15-20 %. Los hallazgos se correspondieron con un astrocitoma de células granulares.
Tratamientos adyuvantes recibidos
Radioterapia hiperfraccionada (RT) (Cobalto 60) en acelerador lineal a completar 58 Gy durante 6 semanas.
Nimotuzumab (CIMAHER) (concomitante con la RT): 200 mg semanales durante 6 semanas y de mantenimiento cada 21 días (200 mg), recibiendo un total de 23 dosis.
Temozolamida como adyuvante según Protocolo de Stupp, 7 se cumplieron solo 4 ciclos de 5 días cada 4 semanas (150-200 mg/m2), abandonado por efectos adversos no tolerados (moderados).
Racotumomab (VAXIRA), recibió 5 dosis de inducción de 0,4 mg cada 14 días a partir de recaída (progresión imagenológica y clínica) y continuó con dosis de mantenimiento cada 28 días, logrando recibir un total de 9 dosis.
Resultado y evolución
Luego del acto quirúrgico, el paciente se mantuvo sin cefalea. Hizo crisis epilépticas de inicio focal motoras del brazo izquierdo que conllevaron a ajustes del tratamiento para su control. El déficit motor izquierdo de tipo piramidal se mantuvo estable el primer año. Mantuvo un estado funcional, evaluado por la escala de Karnofsky de 80 puntos en las evaluaciones del primer mes, 3, 6 y 9 meses tras la cirugía. En la evaluación del año, bajó su estado neurofuncional a 50 puntos por el incremento del déficit motor de tipo piramidal, quedando estable por unos 6 meses más (evaluación de los 18 meses) hasta que falleció en julio del 2020, tras 21 meses del diagnóstico.
Discusión
Novedad del caso clínico
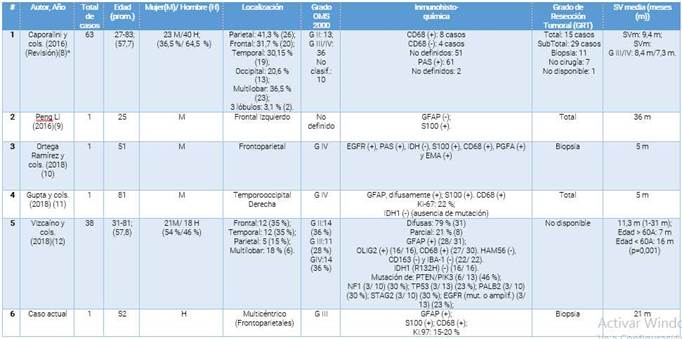
En la Clasificación de los Tumores del SNC propuesta por la OMS en el 2016, solo estaban reportados en la literatura internacional 59 casos de ACG, demostrando la baja frecuencia de esta variedad histológica. La mayoría de las presentaciones eran reporte de casos, siendo la primera serie publicada por Geddes y cols. (1996) con 5 casos y Bratt y cols. (2002) con 11 casos. 6 En el 2016, Caporalini y cols. 8 hizo otra investigación sobre este tema, confirmando la existencia de 63 casos publicados con ACG supratentoriales hemisféricos, incluyendo el caso reportado por ellos.
De esa fecha a la actualidad, Peng Li y cols. (2016), 9 Ortega-Ramírez y cols. (2018) 10 y Gupta y cols. (2018), 11 reportaron 1 caso cada uno con estas características histológicas. La única serie reportada fue por Vizcaíno y cols. en la Universidad Johns Hopkins, EE. UU. donde realizaron una revisión retrospectiva de 18 años (2018), reportando 39 casos, siendo 38 de ellos supratentoriales hemisféricos. 12
Todos estos reportes sumaron 104 ACG supratentoriales hemisféricos publicados hasta la fecha en el mundo. Se muestra un resumen de los datos más significativos en la (tabla 1).
Tabla 1 Resumen de los datos clínico patológicos más relevantes de todos los casos reportados de ACG.
Diagnóstico histológico
Fue en la clasificación de la OMS del 2016 donde se incluyeron por vez primera los astrocitomas/glioblastomas de células granulares como un subtipo de patrón histológico y de composición celular de este tipo de tumores del SNC. Estas lesiones, situadas en los hemisferios cerebrales pueden presentarse de 2 formas: como células grandes con citoplasma granular eosinofílico, dispersas dentro de un GB; o más raramente, como el presente caso, que las células granulares dominen y sean más compactas, y los astrocitos neoplásicos sean difíciles de identificar. En estos casos, se pueden presentar como grado III o IV según los criterios de la OMS del 2000, incluso como grado II al no ser definida necrosis ni mitosis ni proliferación endotelial. 6,13 Este es el caso del paciente que se presenta, donde los autores han considerado que los hallazgos imagenológicos sugirieron la presencia de necrosis, pero el diagnóstico fue realizado por la toma de muestras de biopsia y no por resección total de la lesión.
Desde el punto de vista de su diagnóstico histológico diferencial, el tumor debe ser diferenciado de procesos en los que predominan los macrófagos y lesiones neoplásicas. Entre las lesiones con abundantes macrófagos están: 6,14
Enfermedades desmielinizantes, compuesta por células redondas pequeñas y espumosas más que granulares, macrófagos perivasculares y astrocitos de Creutzfeldt.
Infarto cerebral con macrófagos pequeños y localizados alrededor de los vasos sanguíneos, citoplasma espumoso más que granular, neuronas isquémicas, células endoteliales hiperplásticas e hipertróficas así como marcado compromiso cortical.
Leucoencefalopatía multifocal progresiva, se caracteriza por ser una lesión menos celular, focos múltiples de desmielinización, inclusiones intranucleares en células que rodean el foco desmielinizado.
En el grupo de las lesiones neoplásicas destacó el tumor de células granulares, limitado a la región selar-neurohipófisis, núcleo blando y bajo índice mitótico.
Los ACG exhibieron inmunorreactividad para la proteína ácida gliofibrilar (GFAP), lo cual confirmó el diagnóstico. 6 También a la proteína S100 11,13 y por su alto contenido lisosomal, también pudieron ser inmunorreactivas para marcadores de macrófagos como CD68. 3
Diagnóstico imagenológico
La segunda novedad que presenta este caso se refiere a la presentación imagenológica infrecuente. Teniendo en cuenta los resultados de grandes bases de datos publicadas, se consideró que solo de un 17,2 a un 20 % de los GB se han clasificado como multifocal o multicéntrico. 15,16 Cuando se presentó esta imagen múltiple cerebral, fue mandatorio realizar el diagnóstico diferencial con las lesiones secundarias o metastásicas y con lesiones infecciosas como la toxoplasmosis cerebral y la neurocisticercosis, entre otras. En cualquiera de estos casos la presentación clínica pudiera ser un síndrome convulsivo, como en el paciente que se presenta. Esta similitud clínica e imagenológica produjo un retardo en el diagnóstico definitivo: la búsqueda infructuosa de una lesión primaria, e incluso el inicio de un tratamiento empírico ante la alta sospecha de un parásito cerebral, demoraron el diagnóstico certero. Se decidió como última opción, la biopsia cerebral, por el riesgo que la misma entraña. Por lo tanto, se retardó el tratamiento específico de un insospechado glioma de alto grado de malignidad.
El GB múltiple puede ser multifocal o multicéntrico. La distinción entre estas 2 formas de presentación se realiza en función de la distancia de separación entre las diferentes lesiones: GB multifocal, si las lesiones tienen una separación de menos de 2 cm, y multicéntrico, si la separación es mayor de 2 cm y/o se presenta en ambos hemisferios y/o no existe conexión entre las lesiones en secuencias FLAIR o T2 de IRM. 17,18
Existen teorías que pueden explicar esta variante imagenológica:
La primera expresa que las lesiones múltiples sean metastásicas del foco primario, viajando a través del líquido cefalorraquídeo (LCR) o los tractos de sustancia blanca.
La segunda explicaría las localizaciones infratentoriales y supratentoriales simultáneas, (es decir, fuera de las vías de conexión a través del LCR o de los tractos de sustancia blanca ya mencionados) es que los gliomas sean de origen policlonal, y su existencia solo pueda demostrarse mediante la aplicación de marcadores moleculares. Hay autores que afirman incluso, que un 3 % de las imágenes múltiples, pueden diferir en apariencia histológica. 3,19,20
Tratamiento multimodal
El tratamiento de un ACG, sobre todo cuando se informa algún grado de anaplasia para clasificarlo en grado III o IV de la OMS 2000, está basado en los protocolos habituales de radioterapia (RT), quimioterapia e inmunoterapia que se aplican al resto de los gliomas de alto grado de malignidad (III o IV GB) convencionales. 7,8,9,11
En este caso se cumplió con el protocolo de cobaltoterapia e inmunoterapia con el anticuerpo monoclonal (AcM) nimotuzumab (CIMAHER), de manera concomitante con la RT y luego en dosis de mantenimiento sin efectos adversos. El tratamiento con Temozolamida (TMZ), se utilizó para la recaída, como adyuvante, en solo 4 ciclos por abandono debido a la presencia de efectos adversos moderados. La combinación de VAXIRA (racotumomab) con TMZ y nimotuzumab de mantenimiento en gliomas cerebrales no ha sido reportada hasta ahora, pero tiene ensayos en tumores cerebrales malignos en recaída, que sustentan un alto perfil de seguridad y una aceptable respuesta inmunitaria de este AcM anti-GD2 que incrementa los niveles de IgG. 21,22
Pronóstico de vida
En la revisión realizada en 2008 por Yan Shi, se refirió que la mayoría de los pacientes con ACG fallecían en el primer año del diagnóstico y que, al compararlo con los gliomas de alto grado convencionales, eran de peor pronóstico. 23 Brat y cols. reportaron en el 2002 que los gliomas de alto grado convencionales tuvieron una supervivencia (SV) de 3 años para el grado III y de 11 meses para el grado IV, en cambio para los ACG fue de 8,4 meses si eran grado III y 7,3 meses para grado IV. 13 Estos autores no encontraron explicación de su agresividad pues los tumores tenían bajo índice mitótico y un índice MIB-1. (13 Castellano-Sánchez y cols. 1 año más tarde, encontró que los ACG mostraron alta frecuencia de pérdida del alelo del 9p y el 10q, que la que se encontraba en los gliomas de alto grado convencionales con similar grado, lo cual pudiera contribuir a su comportamiento clínico tan agresivo. (24
El artículo de Schittenhelm/ Psaras (2010) también llamó la atención sobre el mal pronóstico de los ACG, a pesar de tener una actividad proliferativa baja y ausencia de actividad mitótica. Algunos casos han tenido ausente la sobreexpresión del receptor del factor de crecimiento epidérmico (RFCE), signo de mal pronóstico en los gliomas. Otra posibilidad de su mal pronóstico es el gran efecto de masa con el que se diagnostican estos tumores, llegando a estar, hasta en un 35 %, infiltrando más de 1 lóbulo. 6 El grado de resección tumoral y la diseminación leptomeníngea son elementos también relacionados con corta SV. 6
En cuanto al cumplimiento del tratamiento adyuvante, Stupp reportó mayor beneficio de la terapia con RT+TMZ para los tumores con el promotor metilado de la enzima O6-metilguanina-DNA metiltransferasa (MGMT) (22 meses vs. 15 meses con RT solamente), independientemente del grado de resección. 5 En otro estudio sobre factores pronósticos de los GB, de más de 45 mil casos, comparando unifocales con multifocales, los primeros fueron hallados como de mejor pronóstico, así como la metilación de la MGMT y el adecuado cumplimiento de la RT y la quimioterapia. 15
Un estudio realizado a una población cubana mostró que los GB tratados con RT y nimotuzumab tuvieron una SV (media y mediana) de 17,2 y 8,4 respectivamente, significativamente mayor que los tratados únicamente con RT. 25 En otro estudio donde se utilizó esta combinación y se añadió TMZ, liderado por Alemania y citado por Saurez et al.26 se mostró una SV mayor que la del grupo control, que fue estadísticamente significativa para los casos con alta expresión del RFCE y presencia de la enzima (MGMT) no metilada, es decir, los que se consideraban que no reaccionaban al tratamiento con TMZ (19 meses).
Este caso que se presenta tuvo una SV por encima de la media reportada para este tipo de tumores. Considerando el resultado de la biopsia y el informe de las imágenes de RM, se le aplicó el protocolo clásico en Cuba de RT y CIMAHER concomitante, y en recaída la TMZ con otro AcM (VAXIRA), es decir recibió tratamiento multimodal. A pesar que solo se le realizó biopsia como tratamiento quirúrgico, la RT fue dirigida a cada una de las mismas, con acelerador lineal y luego un boost final. Los autores han considerado que fue un factor importante el tamaño y localización de las lesiones al diagnóstico, pues todas eran menores de 1 cm y de localización cortico subcortical, sin efecto de masa. La edad menor de 60 años y un estado general y nutricional adecuado fueron también importantes en su evolución y respuesta a tratamientos. Decisivo también debió haber sido el componente molecular del tumor.
Conclusiones
El ACG es un tumor extremadamente raro y a pesar de la ausencia histológica de rasgos de malignidad tiene un comportamiento clínico agresivo, similar e incluso peor que la de los GB convencionales. El tratamiento multimodal y personalizado a las características del tumor, facilitaron una supervivencia mayor a la esperada de un GB convencional.
El tratamiento combinado de RT y nimotuzumab como primera línea y la combinación de nimotuzumab y VAXIRA en la segunda línea, resultaron seguros por la ausencia de eventos adversos; la combinación de nimotuzumab y TMZ como tratamiento de segunda línea presentó eventos adversos moderados.