INTRODUCCIÓN
La peste porcina clásica (PPC) es una enfermedad viral altamente contagiosa y con un severo impacto socioeconómico en la industria porcina mundial.1-3 El agente etiológico de la PPC es el virus de la peste porcina clásica (VPPC), miembro del género pestivirus de la familia flaviviridae.4
Las vacunas de virus vivos atenuados (VVA) contra la PPC se han empleado desde hace décadas en diferentes contextos. Estas vacunas han inducido una rápida respuesta inmunitaria, capaz de controlar la replicación viral, prevenir la trasmisión vertical y conferir protección.5-8
La mayoría de los países libres de PPC han mantenido una estrategia que ha excluido el uso de la vacunación profiláctica con VVA.9 Sin embargo, la reintroducción de la PPC ha constituido un riesgo para estos países, como se demostró tras un reciente brote de PPC en Japón después de 26 años sin esta enfermedad.10,11
Por el contrario, en regiones donde la enfermedad ha mantenido un carácter endémico, la vacunación con VVA ha tenido uso para limitar los efectos de la enfermedad o como un primer paso dentro de un programa general para el control y erradicación del virus. 12 Empero, se ha descrito que la presión selectiva del uso prolongado de la VVA ha seleccionado cepas virales de media o baja patogenicidad.13-16
Otras de las limitaciones de las VVA han sido la dependencia de una cadena de frío y la imposibilidad de discriminar entre animales vacunados e infectados. Por último, los anticuerpos neutralizantes calostrales (AcNC), transferidos de la madre vacunada a las crías han interferido y reducido de forma drástica su inmunogenicidad.17
El conocimiento de las bases de la inmunidad protectora contra el VPPC ha conducido al desarrollo de otros candidatos vacunales. En particular, los basados en subunidades proteicas han constituido una alternativa atractiva a las VVA para el control y erradicación de la PPC.18,19 La glicoproteína E2 de la envoltura viral ha sido la elección más frecuente para la inducción de una respuesta protectora.20-23 Estas vacunas han demostrado su seguridad y han inducido una potente respuesta de anticuerpos neutralizantes (AcN).24 Adicionalmente, han permitido la discriminación entre los animales infectados, de los vacunados (DIVA).12,18 No obstante, hasta la fecha solo han logrado una protección tardía contra la infección y la enfermedad18,25-28 y no han sido exitosas en prevenir la trasmisión vertical del virus.
La molécula CD154 (ligando de CD40) es una glicoproteína de la superfamilia del factor de necrosis tumoral. Su unión con CD40 ha sido esencial para promover y potenciar la respuesta inmunitaria humoral y celular.29-31
Con la finalidad de superar los inconvenientes de ambos tipos de vacunas existentes, se desarrolló la proteína quimérica E2CD154, mediante la fusión de la glicoproteína E2 del VPPC y el antígeno CD154 porcino. Este candidato vacunal confirió protección temprana contra el reto viral con una cepa de alta patogenicidad del VPPC32 y fue capaz de prevenir la transmisión vertical.33 Estos resultados iniciales constituyeron la prueba del concepto de que E2CD154 mostraba una eficacia potencial similar a las VVA.
La investigación integra algunos estudios clínicos que tienen como objetivo evaluar la seguridad de Porvac® en las categorías más sensibles (crías y cerdas gestantes). Se propuso comparar la respuesta inmunitaria inducida por diferentes esquemas de vacunación.
Con el objetivo de estudiar la potencialidad de Porvac® para proteger durante el ciclo completo de vida del animal, se analizó la presencia y duración de los AcNC en las crías de madres vacunadas con Porvac® o con VVA y Porvac®. Igualmente, se evaluó si estos AcNC eran suficientes para proteger a las crías de una infección viral letal. Se comprobó si los AcNC presentes en las crías interferían con la vacunación con Porvac® a partir de los 15 días de nacidos. Por último, se estudió la duración de los AcN desarrollados por la vacuna durante toda la vida productiva de los animales, así como la capacidad protectora de estos AcN hasta los 9 meses postvacunación.
MÉTODOS
Porvac(
Todos los lotes de vacuna empleados se produjeron en condiciones de buenas prácticas de manufactura. La obtención de la proteína E2CD154 y su formulación con el adyuvante MontanideTM ISA 50 V2 (SEPPIC, Francia) fue descrita anteriormente.32,33
Animales de experimentación
Para los ensayos clínicos se emplearon cerdos Dubroc x Yorkshire. Los animales se trabajaron de acuerdo con las regulaciones del Centro Nacional de Sanidad Animal de Cuba. Los experimentos de vacunación y reto viral se realizaron en condiciones de alta contención y bienestar animal según las directivas de la EU 2010/63/EU y buenas prácticas clínicas.34 Los protocolos fueron supervisados y aprobados por el Comité de Ética y Bienestar Animal del CENPALAB y del CIGB.
Cuantificación de anticuerpos neutralizantes
Los títulos de AcN en el suero se determinaron mediante el ensayo de neutralización ligado a peroxidasa (NPLA), según se describió anteriormente.32,35 Los resultados se han expresado como la media geométrica (G) de los títulos neutralizantes y los intervalos de confianza.
Seguridad en crías
Se vacunaron 9 cerdos de 6-7 semanas de edad con 4 ml de la formulación vacunal (el doble del volumen recomendado en estudios previos(32,33,36 que contenía una dosis de 50 µg de E2CD154 en MontanideTM ISA 50 V (grupo A). Otros 9 cerdos se vacunaron con 4 ml de la misma formulación sin la proteína (grupo B). Los animales se mantuvieron bajo observación clínica diaria. Los cerdos se sacrificaron a los 21 días de vacunados y se les practicó una necrosis completa.
Seguridad en cerdas gestantes
Los ensayos de seguridad reproductora se realizaron en unidades de producción del Instituto de Investigaciones Porcinas (IIP). Se emplearon 27 cerdas gestantes divididas en 3 grupos. El primer grupo de 9 cerdas recibió la primera dosis de la vacuna en el 1/3 de la gestación, un segundo grupo de 8 animales la recibió en el 2/3 de la gestación. Ambos recibieron la dosis de refuerzo 21 días después. Un tercer grupo compuesto por cerdas que no se vacunaron durante la gestación, pero que habían sido inmunizadas antes con la VVA (LABIOFAM) se usó como control. Todas las cerdas se inspeccionaron diariamente desde 4 días antes hasta 14 días después de cada vacunación. El examen clínico de los animales incluyó la medición de la temperatura rectal, la observación del sitio de inoculación y el estado clínico general. Se estudiaron los efectos de la vacunación en parámetros de la gestación y las camadas.
Comparación de esquemas de inmunización en crías sin anticuerpos calostrales contra VPPC
En el experimento (desarrollado en condiciones controladas( se compararon 2 edades para el inicio de la vacunación (2 y 3 semanas de nacidos) y 2 esquemas (con intervalos de 2 o 3 semanas entre dosis). Se emplearon entre 9 y 12 cerdos por cada grupo. Todas las crías eran negativas para AcN contra PPC en el momento de la vacunación.
Niveles de anticuerpos neutralizantes calostrales en crías de madres vacunadas con Porvac(
Se estudiaron 6 crías de una cerda inmunizada únicamente con Porvac( durante el primer tercio de la gestación. Igualmente, se evaluaron 2 camadas de crías de cerdas inmunizadas con VVA y revacunadas con Porvac( durante la gestación. Se midió el título de los AcN de las madres al parto y de las crías en diferentes días.
Protección frente a reto viral por AcNC
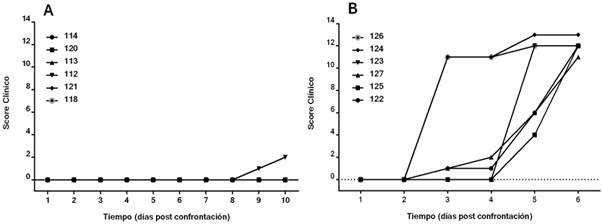
Las crías se desafiaron con 103 DL50 de la cepa Margarita por la vía intranasal a los 63 días de nacidas. Se monitorearon diariamente los síntomas clínicos y se midió la temperatura rectal antes y después del reto. Se calculó una puntuación clínica según el método descrito por Mittelhozer et. al.37 Se realizó un examen patológico de los animales después del sacrificio y se tomaron muestras de sangre y tejidos para aislamiento viral.
Interferencia de AcNC con la vacunación con Porvac(
Se seleccionaron 6 camadas con 59 crías de madres vacunadas primero con VVA y posteriormente con Porvac( durante la gestación. Las crías de 3 camadas se vacunaron en la semana 2 de vida (grupo A) y otras 3 camadas se vacunaron en la tercera semana (grupo B). Ambos grupos recibieron dos inmunizaciones con un intervalo de 21 días entre dosis.
Duración de los AcN y su eficacia frente al reto viral
En el estudio, 26 cerdos se distribuyeron en 4 grupos, entre ellos: los grupos A y B (con 10 animales que se vacunaron con 2 dosis de 50 µg de Porvac( con un intervalo de 21 días entre las dosis) y los grupos C y D (con 3 animales cada uno que recibieron la formulación sin antígeno). Los animales de los grupos A y C se retaron a los 6 meses postvacunación, mientras los cerdos de los grupos B y D se retaron a los 9 meses. Se tomaron muestras de sangre mensualmente antes del reto y a los 5, 8, 14 y 21 días postconfrontación (dpc) para monitorear los niveles de AcN. La presencia del virus en la sangre se evaluó mediante aislamiento viral. Se tomaron muestras de bazo, hígado, pulmones y riñones para histopatología. Se determinó el conteo total de leucocitos antes del reto y a los 5, 8, 14 y 21 dpc.
RESULTADOS
Seguridad de Porvac® en crías
La vacuna fue bien tolerada, sin reacciones adversas sistémicas ni locales. La temperatura rectal se mantuvo dentro del rango fisiológico en los animales vacunados (39 ± 0,19oC), o el placebo (38,9oC ± 0,13oC). Todos los cerdos ganaron peso durante el estudio (13,19 ± 6,18 Kg para el grupo A y 14,95 ± 6,51 Kg para el grupo B). No se detectaron diferencias significativas entre los 2 grupos en el momento del sacrificio (prueba t de Student, p= 0,59). No se evidenciaron diferencias en los valores hematológicos estudiados (hemoglobina y conteo total de leucocitos), antes y después de la vacunación. No se encontraron hallazgos macroscópicos relevantes ni alteraciones patológicas microscópicas en los animales vacunados ni en los controles.
Seguridad de Porvac® en cerdas gestantes
No se documentaron reacciones adversas sistémicas ni locales en las cerdas vacunadas. Las temperaturas promedio fueron 37,57 ± 0,6 °C (grupo A), 37,59 ± 0,5 °C (grupo B), y 37,51 ± 0,55 °C (grupo C).
No se encontraron diferencias significativas para el período de gestación entre los 3 grupos (ANOVA, p> 0,05) (material complementario).
La ganancia de peso promedio diario entre las 2 inmunizaciones fue de 539 ± 520 g, 185 ± 634 g y 690 ± 352 g, para los grupos A, B y C respectivamente, sin diferencias significativas entre ellos (ANOVA, p= 0,3050).
No se presentaron abortos, crías momificadas ni otros desórdenes genéticos o físicos. No se encontraron diferencias significativas entre grupos para el tamaño de la camada, el número de crías nacidas vivas, el peso al nacer, el número de crías destetadas y el peso al destete (ANOVA, p> 0,05) (material complementario).
Eficacia a largo plazo de Porvac(
La aplicación de Porvac( indujo altos títulos de AcN en crías de 2 y 3 semanas de edad y aplicada con 2 intervalos diferentes entre dosis.
Un mes después de vacunados todos los animales desarrollaron títulos de AcN ≥ 1/3200 (figura 1). En la evaluación realizada a los 3 meses de la segunda dosis todos los grupos mostraron una media geométrica (G) de AcN ≥ 1/9000, sin diferencias estadísticas entre ellos (Kruskal-Wallis, p> 0.05). Pasados 6 meses después de la vacunación, los títulos de AcN decayeron, aunque permanecieron ≥ 1:400 en todos los animales. Durante el estudio, 6 animales de cada grupo seleccionados al azar, mantuvieron títulos de AcN por encima de 1:400 hasta los 360 días postvacunación (dpv) (datos no mostrados).
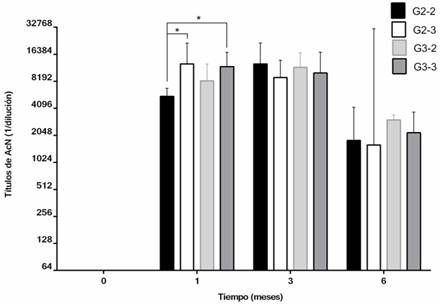
Fig. 1 Títulos de AcN contra PPC en todos los grupos durante 6 meses. Los grupos se conformaron con 9 o 12 animales: G2-2 los vacunados en la semana 2 y con intervalo de 2 semanas, G2-3 los vacunados en semana 2 e intervalo de 3 semanas, G3-2 los vacunados en la semana 3 con intervalo de 2 semanas y G3-3 los vacunados en semana 3 con intervalo de 3 semanas. T0 representa sueros preimmunes tomado en el día de la primera inmunización, T1 representa 1 mes después de la segunda inmunización, T3 representa 3 meses después de la segunda inmunización, T6 representa 6 meses después de la segunda inmunización. Se muestran las G y los intervalos de confianza de los títulos de AcN. Prueba de comparación múltiple de Tukey's (*p< 0,05).
Presencia de anticuerpos neutralizantes calostrales en las crías de madres vacunadas con Porvac(
Las crías de madres vacunadas con Porvac( mostraron títulos de anticuerpos neutralizantes calostrales (AcNC) que perduraron por más de 2 meses. El título de AcN en el momento del parto de la madre vacunada con Porvac® fue ≥ 1: 25600. En las crías se detectaron títulos de AcNC con una G ≥ 1: 19000 a los 12 días. Los títulos de AcNC disminuyeron hasta los 73 días, fecha en la que aún se encontraban valores de AcN con una G de 1: 1166 (figura 2A).
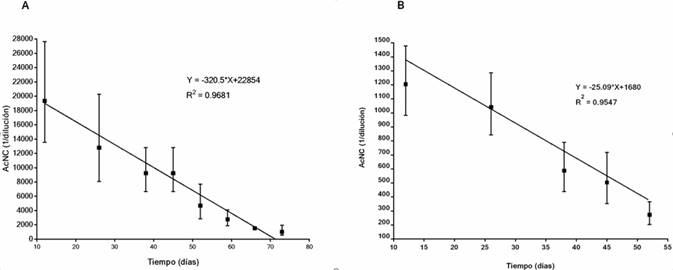
Fig. 2 Curso temporal de AcNC en las crías de cerdas vacunadas. A) madres vacunadas con Porvac( y mantenidas en condiciones controladas en áreas del CENPALAB. B) madres vacunadas con VVA y Porvac( en unidades de producción.
También se evaluó el curso temporal de los AcNC en 2 camadas de crías provenientes de cerdas inmunizadas con VVA y revacunadas con Porvac(. Los títulos de AcN de las madres en el momento del parto fueron 1: 3200 y 1: 6400. La G de los títulos AcNC en estas crías fue 1: 1309 a los 12 días de nacidas. Los títulos de AcNC fueron disminuyendo y la G fue de 1:308 a los 53 días de edad (figura 2B).
Desafío con una dosis letal del VPPC en crías de madres vacunadas con Porvac(
El desafío viral se realizó a los 63 días de nacidos, cuando se detectaron títulos de AcN con una G de 1:100, en las crías de madres vacunadas. La puntuación clínica aumentó en las crías controles sin AcNC, a partir de los 3 dpc. Se observó una evolución rápida hacia un estado crítico de salud, con temperaturas rectales entre 40,3 °C y 41,4 °C desde el 4 dpc (figura 3B). Por el contrario, la puntuación clínica no se incrementó en los cerdos con AcNC, excepto en un animal que experimentó fiebre superior a 40 °C en los 10 y 11 dpc (figura 3A). De las crías estudiadas, 5 fueron negativas para el aislamiento viral y tampoco se observaron lesiones macroscópicas en sus órganos. La cría con evento febril fue positiva al aislamiento viral en sangre y en el bazo, donde se observaron infartos marginales, aunque se mantuvo sin otros signos clínicos de PPC.
Vacunación con Porvac( en crías con anticuerpos neutralizantes calostrales
Todas las crías presentaban elevados títulos de AcNC al momento de la aplicación de la primera dosis de Porvac(. El grupo A exhibió una G de 1:780 y el Grupo B una G de 1:1262. Al completar el esquema, la G de los títulos neutralizantes fue 1:4017 y 1:4496 para los grupos A y B, respectivamente. Estos títulos de AcN se mantuvieron superiores a 1:3000 hasta los 180 dpv (figura 4). No se encontraron diferencias estadísticas significativas entre ambos grupos a partir de los 7 días después de la segunda dosis (Mann Whitney, p< 0,05).
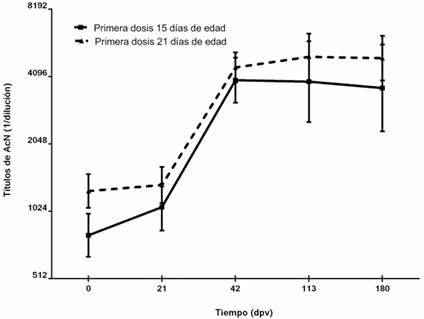
Fig. 4 Curso temporal de los títulos de AcN en crías con altos niveles de AcNC vacunadas con Porvac(. Los cerdos recibieron 2 dosis de Porvac( a los 0 y 21 dpv comenzando en la segunda o la tercera semana. Los valores representan la G de los títulos de AcN y los intervalos de confianza. Dpv: días postvacunación. Línea continua: primera dosis en la segunda semana. Linea discontinua: primera dosis en la tercera semana.
Desafío con una dosis letal del VPPC después de 6 y 9 meses de la vacunación con Porvac(
Al completar el esquema vacunal se detectaron títulos con una G por grupo superior a 1:3000 y permanecieron elevados hasta los 6 meses. Los títulos disminuyeron entre los 7 y 9 meses, pero siempre superiores a 1:1000. No se encontraron diferencias significativas en los títulos de AcN entre los diferentes tiempos estudiados entre la segunda inmunización y el final del estudio (Kruskal-Wallis test, p= 0,2792).
Los animales se retaron tanto a los 6 como a los 9 meses. Tras el reto los animales controles mostraron valores entre 10 y 14 de la puntuación clínica a los 8 dpc. La temperatura promedio a los 8 dpc fue de 41,4 °C y 41,0 °C para los grupos de 6 y 9 meses, respectivamente. Se aislaron virus infectivos de la sangre de todos los controles a los 3 y 8 dpc. Se observó una marcada leucopenia en estos cerdos con valores por debajo 5 × 109 células/ L hasta el día del sacrificio (material complementario).
Por el contrario, los cerdos vacunados no mostraron signos clínicos de PPC. La temperatura rectal permaneció estable (39,3 ± 0,2) durante 21 dpc. No se observaron lesiones patológicas en los órganos de estos animales. Tampoco se detectó replicación viral en ninguna de las muestras de sangre evaluadas. Se detectó una ligera reducción de los conteos totales de leucocitos entre los días 3 y 14 después del desafío en los cerdos retados al mes 6 de vacunación. Una reducción más acentuada se manifestó en los animales retados a los 9 meses de vacunación. Todos los animales recuperaron los valores normales de linfocitos para a los 21 dpc (material complementario).
DISCUSIÓN
Los resultados evidenciaron que la vacuna fue segura y bien tolerada pues no se documentaron efectos adversos locales ni sistémicos. Ha sido necesario destacar que en el estudio de la seguridad en crías se administró el doble del volumen recomendado, tal como indicaron las regulaciones.38,39 Esto ofreció un margen de seguridad considerable contra cualquier repetición accidental durante el proceso de vacunación.
Según se ha tenido conocimiento, esta ha sido la primera vez que el adyuvante MontanideTM ISA 50 V2 se usó en un candidato vacunal para cerdos. Por consiguiente, a pesar de los antecedentes de seguridad que han existido en otras especies, la demostración de la seguridad y tolerancia que ha ofrecido Porvac( en cerdos ha sido novedosa y relevante.
Por otra parte, CD154 por su condición de autoantígeno, su inclusión en la vacuna ha podido inducir efectos adversos de naturaleza autoinmune. Aunque algunos inmunógenos que contienen CD154 se han evaluado en animales, este es también el primer ensayo de seguridad de una vacuna que contiene esta molécula. La inclusión de este autoantígeno en la formulación no generó efectos adversos a corto plazo de ningún tipo. El estudio de posibles efectos adversos a largo plazo deberá realizarse en el futuro en reproductoras.
Se evidenció que Porvac® ha sido capaz de inducir una inmunidad protectora en las crías vacunadas en edades tan tempranas como 15 días de nacidas, y los 4 esquemas de inmunización evaluados indujeron altos títulos de AcN. Estos títulos fueron superiores a 1:50, aceptado como el umbral para la protección contra PPC.40-42 Por tanto, cualquiera de estos regímenes puede ser recomendado para los diferentes sistemas productivos.
Todas las crías nacidas de cerdas inmunizadas solo con Porvac( o en combinación con VVA exhibieron títulos de AcNC muy por encima del umbral de protección (1:50), al menos hasta las 8 semanas de edad. La correspondencia observada entre los títulos de AcN en las cerdas gestantes y los AcNC en las crías lactantes se ha informado anteriormente.43
Para conocer si los AcNC eran capaces de proteger a las crías, estas se confrontaron con una carga letal del VPPC. Se confirmó que los AcNC fueron suficientes para conferir protección a la descendencia, aún con títulos próximos al umbral de protección, durante las primeras 10 semanas de vida.
Se demostró además, que Porvac( ha sido capaz de generar una respuesta robusta de AcN en las crías en presencia de niveles elevados de AcNC al momento de la vacunación. Esto ha permitido la vacunación de las crías en edades muy tempranas, lo cual ha podido reducir el número de animales susceptibles a infectarse en una región donde exista alta circulación viral.
Finalmente, se evidenció que los altos títulos de AcN han permanecido al menos hasta 9 meses después de la vacunación y que eran capaces de proteger a los cerdos frente a un desafío viral. Esta inmunidad esterilizante debe contribuir a detener la transmisión horizontal del virus e ir disminuyendo la circulación viral en las piaras que se mantienen en un programa permanente de vacunación.
El conjunto de estos resultados ha sido relevante desde el punto de vista práctico, pues evidenció la ausencia de una ventana inmunológica en los rebaños inmunizados con Porvac(. Los cerdos lactantes adquirieron los AcNC de sus madres vacunadas y estos los mantuvieron protegidos durante las primeras semanas de vida hasta el momento de la vacunación. Estos AcN a su vez no interfirieron con la respuesta inmunitaria de las crías al recibir la vacuna y ha logrado brindar protección a los animales durante el resto de su vida. De esa forma se garantizó que, con una alta cobertura de vacunación, se reduciera prácticamente a 0 el número de animales susceptibles y portadores del virus.
Estos hallazgos reforzaron el concepto de que Porvac( ha podido ser útil para la vacunación en regiones endémicas para PPC y que ha podido introducirse aunque se haya utilizado previamente una VVA, como es el caso de nuestro país.
Esta vacuna de subunidad ha demostrado una eficacia similar a las VVA y aportó además las ventajas inherentes a las vacunas de subunidad, tales como: no libera virus vivo al campo, permitir la discriminación entre los animales infectados y vacunados (DIVA) y se ha presentado más estable a temperatura ambiente. Por estas razones se consideró una alternativa promisoria para el control de la enfermedad en Cuba y se introdujo desde la fase de control. En nuestro estudio, Porvac( fue la primera vacuna de subunidad contra la PPC que empleada en el control de esta enfermedad en una región endémica. Se comenzó a usar desde 2018 y su aplicación ha permitido la disminución del número de focos de esta enfermedad en el país.
Conclusiones
La aplicación de Porvac( ha sido segura y bien tolerada en las categorías más sensibles (crías y reproductoras).
La capacidad de Porvac( de inducir un elevado nivel de AcN protectores en las crías no se ha afectado al iniciar la vacunación durante la segunda o tercera semana tecnológica, ni al emplear 15 o 21 días de intervalo entre las 2 dosis.
Las crías de madres vacunadas con Porvac( adquirieron elevados títulos de AcNC que duraron al menos 8 semanas y protegieron a las crías de una confrontación viral letal.
Los altos títulos de AcNC no interfirieron con la eficiencia de la vacunación con Porvac( que confirió una robusta inmunidad protectora de larga duración suficiente para proteger de por vida a la masa porcina.