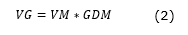Introducción
El género Cinchona, de la familia botánica Rubiaceae, conocido como "cascarilla o árbol de quina" está conformado por 23 especies (Andersson y Taylor, 1994). Es nativo de los Andes sudamericanos (Garmendía, 2005). Se distribuye a lo largo de la zona tropical y ecuatorial de la cordillera de los Andes, desde los 10° de latitud norte hasta los 20° de latitud sur. En Ecuador se encuentran 12 de estas especies, (Ulloa y Jørgensen, 1995), donde cuatro son endémicas y ocho nativas. Generalmente son arboles de tamaño mediano a pequeño o arbustos con corteza amarga, pueden alcanzar una altura que puede llegar a los 25 metros (Mahecha et al., 2016). En condiciones naturales el género Cinchona presenta baja tasa de germinación y regeneración, encontrándosela únicamente en lugares apartados y en pequeños grupos (Buddenhagen et al., 2004).
La especie C. pubescens (árbol de quinina, quina roja, cascarilla, quina) es un árbol de hoja perenne, de 1 025 m de altura, con un diámetro a la altura del pecho (DAP) de 2080 cm en Ecuador (Jugar, 2015). Es allá que tiene mayor área de distribución geográfica dentro de su género en el continente americano y se encuentra desde el norte de Bolivia hasta Costa Rica. Está introducida en Tahití, zona del Pacífico, Hawai, Asía y en Tanzania, África. Esta especie crece en altitudes entre 300 y 3 300 m (Jäger, 2015), muy robusta por lo que se utilizaba como patrón de injerto. El contenido en alcaloides totales es del 3,8 %, de ellos menos de 50 % de quinina. Se considera rara y en peligro de extinción en su área de distribución nativa en Ecuador (Günter et al., 2004), mientras que (Jäger y Kowarik, 2010) y (Jäger, 2015), la consideran como invasora, en las condiciones insulares de Galápagos.
En la zona de Intag, Imbabura Ecuador, la especie C. pubescens se encuentra ubicada en bosques relictos, bosques secundarios y formando parte de sistemas silvopastoriles, a altitudes superiores a los 1 600 y hasta los 3 000 m s.n.m. con una escasa abundancia pues, según los pobladores del lugar, sus árboles son talados con fines maderables, coincidiendo con (Gómez, 2016), que plantea similar situación para Distrito de Kañaris, Región Lambayeque, en Perú.
En el estudio de las cadenas de abastecimiento de germoplasma forestal en Ecuador (Prado, Samaniego y Ugarte, 2010) plantean que existe poca disponibilidad de semillas forestales de calidad en cantidad, suministro oportuno para cubrir la demanda de los productores. Afirman también que existe limitada información técnica y científica de las técnicas de producción, procesamiento y almacenamiento de semillas forestales de muchas especies nativas que garanticen la viabilidad de las mismas.
Las técnicas para la colecta, procesamiento y almacenamiento de las semillas, constituye una condición básica para diseñar los programas de reforestación, restauración ecológica y desarrollo agroforestal. Afirman Ceballos y López (2007) que son escasos los estudios en especies nativas, tal es el caso de la especie C. pubescens, sobre calendarios fenológicos y sobre la recolección y beneficio (limpieza, secado, contenido de humedad y almacenamiento) de semillas forestales en Colombia, lo mismo que en Ecuador. Dada la adaptabilidad de esta especie a las condiciones de Intag y otras zonas del país, permite ser usada con diversos fines dentro de los programas forestales del país.
Las semillas almacenadas constituyen un medio de producción de primera importancia en los programas producción de plantas de un país, sin embargo, las semillas no pueden conservar su capacidad de germinación de forma indefinida. El mantenimiento de su viabilidad depende mucho de las condiciones de almacenaje (Doria, 2010).
En general, la heterogeneidad de las semillas forestales no permite homologar una misma técnica de almacenamiento, pues muchas demuestran buen comportamiento en el almacenamiento, mientras que otras, por el contrario, se deterioran rápidamente bajo las mismas condiciones. El manejo de la humedad relativa del aire y la temperatura del amiente, son dos factores claves para lograr los mejores resultados en el almacenamiento de las semillas, e influyen directamente en la velocidad de respiración de las mismas (Blanco, Durañona y Acosta, 2016).
La cascarilla tuvo un uso en el pasado por su contribución con el alcaloide quinina para actuar sobre el paludismo. La especie más utilizada fue C. officinalis, en tanto la primera especie empleada fue la C. pubescens. Sobre esta base del conocimiento, químico se sintetizó. El virus que provoca el paludismo ha mutado y que se requieren nuevos productos sintéticos, además de conocer los compuestos químicos de otras especies de Cinchona, por esto el estudio deC. pubescens. Se hace necesario entonces, conocer diferentes aspectos de su fisiología, entre otros: época de fructificación, viabilidad de las semillas y las condiciones de almacenamiento que permitan tener una exitosa germinación de las mismas.
El objetivo de esta pesquisa consistió en determinar tanto la calidad de las semillas como los mejores métodos de almacenamiento de las semillas de C. pubescens, colectadas en la zona de Intag, Noroccidente de Los Andes en Ecuador.
Materiales y métodos
La colecta de frutos se efectúo en la localidad de Pucará Alto, Intag, Imbabura, Ecuador, donde fueron seleccionados 30 individuos al azar como árboles candidatos en un sistema silvopastoril, los que se señalizaron y georreferenciaron. La fenología de la especie se realizó mediante observación directa en campo y determinándose el momento más adecuado para la recolección de los frutos, que se efectuó en el mes de septiembre, teniendo en cuenta la relación del color de estos con su estado de maduración, que se correspondió con el de marrón a pardo.
El secado fue en condiciones ambientales bajo sombra, durante tres días, para lo cual fueron colocados en una tela y removidos constantemente para obtener un secado homogéneo. El proceso de extracción de las semillas se realizó manualmente, de frutos seleccionados de acuerdo al mejor estado fitosanitario y de mayor largo y ancho. Las semillas extraídas fueron secadas, mediante proceso similar a los frutos en condiciones ambientales encima de una mesa del laboratorio. Se procedió a su limpieza parcial, mediante procedimiento manual, eliminando los restos de frutos de mayor dimensión.
Para la determinación de la calidad de las semillas se empleó las Normas ISTA (2016) en la pureza, peso de 1 000 semillas, contenido de humedad y poder germinativo.
Se estudiaron tres factores que consistieron en: tipo de envases, medio de almacenamiento y tiempo. Los niveles por factores fueron:
Tipos de envases: FT- funda traslúcida; FC- funda plástica oscura; CT- cristal traslúcido; CC- cristal de color ámbar.
Medio de almacenamiento: N- natural al ambiente y R- refrigeración 6-8 °C.
Tiempo. Primer ensayo: T1- un mes; T2- dos meses; T3- tres meses; T4- cuatro meses; T5- cinco meses y T6- seis meses.
Segundo ensayo T1- para una semana; T2- para dos semanas; T3- para tres semanas y T4- para cuatro semanas.
Se evaluaron 48 tratamientos para el primer ensayo y 32 tratamientos para el segundo ensayo, con el empleo de un diseño irrestricto al azar, en condiciones de laboratorio.
Las observaciones sobre germinación, se hicieron durante 40 días, a las 10:00 a.m.
Poder germinativo (Ecuación 1).
Vigor germinativo (Ecuación 2).
Donde:
VM |
valor máximo o pico que se presenta entre los valores producto de la división del porcentaje acumulado de germinación y la cantidad de días que se tardó en obtenerse |
GDM |
es la germinación media diaria, calculada como la razón entre el porcentaje final de germinación (PG) y el número de días transcurridos hasta llegar a ese valor |
Se verificaron los supuestos para la realización del análisis de varianza trifactorial, los que se incumplieron, y se pasó a realizar prueba no paramétrica de Kruskal-Wallis.
Resultados
La semilla colectada mostró una pureza de 75,8 %, este resultado es por el tipo de fruto: una cápsula dehiscente, reduciendo las impurezas desde el proceso de secado del fruto y al momento de la extracción. Se obtuvo un peso de 0,315 g para 1 000 semillas de C. pubescens, mientras el porcentaje de contenido de humedad de las semillas fue de 13,6 %. El poder germinativo fue muy bajo, 12 %, el inicio de la germinación a los 29 días y culminó a los 36, en tanto, el valor de 0,43 para el vigor germinativo fue ínfimo.
Ensayos de almacenamiento
En el primer ensayo de germinación en semillas de C. pubescens, a partir de un mes de almacenamiento, se obtuvo cero porcentaje de germinación, para los ambientes y tipos de envase empleados.
Para el segundo ensayo con periodos de evaluación semanales se obtiene que, los supuestos de homogeneidad y normalidad para los resultados del poder germinativo se incumplen (Figura 1 y Figura 2), que muestra una forma de abanico en la distribución de los residuales de germinación.
La gráfica de normalidad de los datos del poder germinativo (Figura 2), más los resultados de la prueba de Shapiro-Wilk (P < 0,05), indican el no cumplimiento del supuesto de normalidad. La prueba de Kruskal-Wallis (Tabla 1) muestra diferencias significativas entre los tratamientos (P = 0,002).
Tabla 1 - Poder germinativo de los tratamientos
| Tratamientos | Medias | Tratamientos | Medias |
| FTRT1 | 9,25 a | FTNT4 | 0,00 j |
| FTNT1 | 8,75 ab | CCRT4 | 0,00 j |
| CTRT1 | 8,50 abc | CTNT4 | 0,00 j |
| CCNT1 | 8,00 abc | FCNT4 | 0,00 j |
| CTNT1 | 7,25 abcd | FCRT4 | 0,00 j |
Tipos de envases: CT- cristal translúcido; CC- cristal de color ambar; FT- funda plástica translúcida; FC- funda plástica negra; R- refrigeración; N- ambiente; T1- una semana y T4- cuatro semanas Letras diferentes en las filas y columnas indican diferencias significativas para P < 0,05
El tratamiento con fundas transparentes en refrigeración durante una semana, con un 9,25 % de germinación, fue el mejor tratamiento (Tabla 1), en tanto los de peor comportamiento se corresponde con los tratamientos de semana cuatro, con independencia del medio y el tipo de envase, pues muestran cero porcentajes de germinación.
Al eliminar los tratamientos de la semana cuatro de almacenamiento, los supuestos de homogeneidad y normalidad para los resultados del poder germinativo se incumplen (Figura 3 y Figura 4), se muestra una forma de abanico en la distribución de los residuales de germinación.
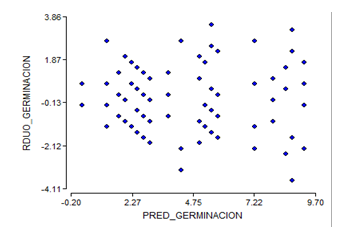
Fig. 3. - Diagrama de homogeneidad del poder germinativo de semillas de C. pubescens tras tres semanas de almacenamiento
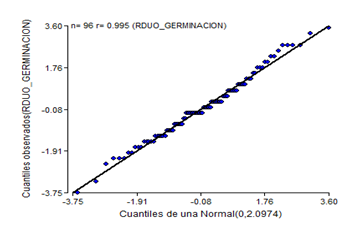
Fig. 4. - Diagrama de probabilidad normal del poder germinativo de semillas de C. pubescens tras tres semanas de almacenamiento
La gráfica de normalidad de los datos del poder germinativo a las tres semanas (Figura 4), más los resultados de la prueba de Shapiro- Wilk para P < 0,05, indican el no cumplimiento del supuesto de normalidad.
La prueba de Kruskal-Wallis expresa diferencias estadísticas significativas entre los tratamientos para las tres semanas de almacenamiento respecto al variable poder germinativo. La prueba de comparación de medias (Tabla 2), muestra diferencias entre el tratamiento. Se ratifica el tratamiento de funda transparente en refrigeración a la semana uno dentro del mejor grupo, al cual también se incorporan los tratamientos de funda transparente en medio natural y cristal traslúcido en refrigeración, ambos también para la primera semana.
Tabla 2 - Poder y vigor germinativo de los tratamientos para tres semanas de almacenamiento
| Tratamientos | Poder germinativo (%) | Vigor germinativo | Tratamientos | Poder germinativo (%) | Vigor germinativo | Tratamientos | Poder germinativo (%) | Vigor germinativo |
| FTRT1 | 9,25 a | 0,35 a | FTNT2 | 0,03 de | 0,03 de | FTRT3 | 2,25 cdef | 0,01 e |
| FTNT1 | 8,75 a | 0,27 ab | FCRT1 | 0,08 cde | 0,08 cde | CCRT2 | 2,25 cdefg | 0,01 e |
| CTRT1 | 8,50 a | 0,25 ab | CTNT2 | 0,04 de | 0,04 de | FCRT3 | 2,00 defg | 0,01 e |
| CCNT1 | 8,00 ab | 0,15 bcde | CCNT2 | 0,04 de | 0,01 e | FTNT3 | 1,75 defg | 0,001 e |
| CTNT1 | 7,25 abc | 0,21 abcd | CTRT3 | 3,00 bcdef | 0,01 e | CCRT3 | 1,25 efg | 0,001 e |
| CTRT2 | 5,75 abcd | 0,04 de | FCRT2 | 3,00 bcdef | 0,01 e | CTNT3 | 1,25 efg | 0,01 e |
| FTRT2 | 5,50 abcd | 0,03 de | FCNT1 | 0,02 e | 0,02 e | FCNT2 | 1,25 fg | 0,001 e |
| CCRT1 | 5,50 abcd | 0,13 bcde | CCNT3 | 2,75 cdef | 0.01 e | FCNT3 | 0,025 g | 0,001 e |
Tipos de Leyenda: Envases: CT- cristal traslúcido; CC- cristal de color ámbar; FT- funda plástica traslúcida; FC- funda plástica negra; R- refrigeración; N- ambiente: T1- una semana; T2- dos semanas; T4- tres semanas; T4- cuatro semanas. Kruskal Wallis P < 0,01. Letras diferentes en las filas y columnas indican diferencias significativas para P < 0,05
Los resultados de las pruebas de normalidad y homogeneidad para el vigor germinativo manifestaron similar tendencia que el poder germinativo. Ambas pruebas no se cumplen (Figura 5 y Figura 6), se observa con típico cono para la homogeneidad y la normalidad que ratifica su incumplimiento según la prueba de Shapiro- Wik para una P< 0,01.

Fig. 5. - Diagrama de homogeneidad del vigor germinativo de semillas de C. pubescens tras tres semanas de almacenamiento
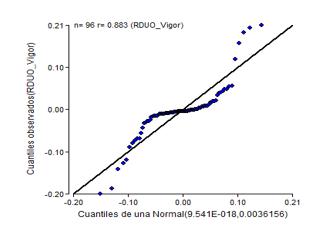
Fig. 6 - Diagrama de probabilidad normal del vigor germinativo de semillas de C. pubescens tras tres semanas de almacenamiento
Los resultados de la comparación de medias para el vigor germinativo (Tabla 2) muestra que no existe una relación biunívoca entre el orden de los tratamientos respecto al poder germinativo. Se consigue que se mantenga el tratamiento de funda traslúcida en refrigeración a la semana uno como el mejor, pero a partir del mismo cambia el grupo en el cual se ubican los tratamientos, respecto al agrupamiento de las medias para el poder germinativo.
 Letras diferentes indican diferencias significativas para P < 0,05
Letras diferentes indican diferencias significativas para P < 0,05Fig. 7. - Comportamiento del poder y vigor germinativo de los factores en estudio
Al realizar la comparación de las medias de los factores de estudio para el poder y vigor germinativo, Figura 7, se observa que los envases traslúcidos son superiores a los envases de color oscuros, en los que se destaca la funda transparente, en tanto no existe diferencias significativas entre los medios y la primera semana alcanza una media superior a las restantes, siendo la tercera semana, la de peor comportamiento.
Discusión
En la experiencia se obtuvo 77,1 % de pureza en C. officinalis, mientras que (Caraguay et al., 2016) alcanzaron el 38,04 %, en la misma especie. Este resultado esta dado por el proceso de beneficio realizado desde la selección de los frutos de mayor tamaño y mejor estado sanitario, más el manejo de las semillas desde la extracción de los frutos y su limpieza inicial, elementos favorecedores para obtener una semilla con menos impurezas.
El peso de 1 000 semillas resultante, es mayor al que plantean (Campos et al., 2014) de 0,024 g. Se coincide con dichos autores en relación a que este comportamiento podría ser una de las desventajas de germinación, pues cuando las semillas poseen menor tamaño poseen reservas mínimas (Pascualides y Ateca, 2013; Alvarado et al., 2015; Rodríguez y Pompa, 2016; Ruíz et al., 2018), y ellas pueden hacer uso de las mismas de manera rápida después de la cosecha, aportando poco al crecimiento de la nueva planta. Esto constituye un riesgo para la no ocurrencia de la germinación, pues este proceso tan complejo puede iniciarse desde la fase de imbibición, sin que necesariamente ocurra la activación de la síntesis y degradación, conducentes a la división y elongación celular, para que ocurra la ruptura de la cubierta seminal por el embrión.
El resultado de humedad en las semillas, 13,6 %, es menor al encontrado por (Campos et al., 2014), con valor de 16,67 % en la misma especie. El contenido de humedad inicial puede influir en el período de imbibición de la semilla (Hernández et al., 2018), lo que implica una mayor velocidad en la absorción de agua para las semillas de menor contenido de humedad. Esta mayor velocidad de absorción al inicio de la imbibición no implica un comportamiento superior en la germinación de las semillas (Vargas et al., 2015), que al estudiar dos contenidos de humedad de la semilla en cuatro especies (S. saman, 11,5 y 6,1 %; P. dulce, 13,8 y 5,5 %; J. caucana, 8,4 y 3,5 %; T. rosea, 8,3 y 3,6 %) no obtiene diferencias significativas para la germinación entre los niveles de humedad inicial de las semillas para cada especie. Por otra parte (Lines et al., 2006), evaluaron cinco contenidos de humedad (4,8 %, 10,5 %, 21,3 %, 26,3 % y 40,3 %) y encontraron que la semilla germina en menor tiempo y mayor porcentaje con el contenido de humedad más elevado y que la disminución en el porcentaje de germinación es proporcional a la disminución en el contenido de humedad.
Un mayor tiempo de secado de las semillas en razón de obtener un menor contenido de humedad en estas, puede afectar su capacidad germinativa porque, la absorción de humedad por las semillas para alcanzar su equilibrio higroscópico durante el proceso de imbibición, provoca el deterioro de la membrana plasmática de las semillas y disminuye su calidad fisiológica (Crivelari et al., 2019).
El comportamiento del poder germinativo, 12 % fue muy bajo, y puede estar dado por diferentes causas: embriones no desarrollados, embriones muertos, semillas muy pequeñas y de escasa reserva germinativa, entre otras. Las semillas de C. pubescens presentan dificultades en su germinación, (Campos et al., 2014), pues está influenciada directamente por la maduración fisiológica. Una causa a considerar también sería el nivel de humedad de las semillas una vez realizado el secado, pues un bajo porcentaje de humedad implica que la semilla tiene un potencial mátrico negativo, por lo que tiende a embeberse muy deprisa (fase I), independientemente de que la semilla esté durmiente o sea viable (Matilla, 2008).
Semillas pequeñas con escasa reservas y con una baja humedad, realizan una rápida absorción de agua, lo que provoca alteraciones temporales en la permeabilidad diferencial de las membranas de la semilla y, por consiguiente, una pérdida al medio circundante de solutos y diferentes metabolitos de bajo peso molecular (azúcares, ácidos orgánicos, iones, aminoácidos, péptidos, etc.), corroborado en los resultados de (Ribeiro et al., 2015). Los resultados posibilitan asumir como baja la activación metabólica de las semillas, lo que impide que las mismas desarrollen la fase II (meseta), periodo de retraso de absorción de agua, sin llegar a la activación del embrión. Semillas muertas y latentes mantienen este nivel de típica hidratación de la fase II, al contrario de semillas germinando ellas no entran a la fase III, resultado asociado a la protrusión de la radícula. Todo concuerda con lo concluido por (Marler, 2019) , pues la velocidad de imbibición durante la fase física, no necesariamente se correlaciona directamente con la velocidad de germinación final.
En la imbibición, las semillas se transforman de un estado seco inactivo (sin traducción) a un estado metabólico completamente activo, y traducen selectivamente subconjuntos de estos ARNm almacenados. Por lo tanto, las semillas proporcionan un interruptor único de encendido / apagado (Sajeev et al., 2019), regulado por el desarrollo para la traducción. Los resultados del poder germinativo muy bajo de las semillas de C. pubescens en el estudio, sugieren que su activación pudo ser reducida en las semillas que no lograron germinar, aún, cuando desarrollaron la fase I de la imbibición.
En relación al tiempo de máximo de germinación, 36 días, no coinciden con el obtenido por (Bargali y Singh, 2007) que fue de 22 días, ni con Campos et al. (2014), Cinchona sp. procedentes del centro poblado de La Cascarilla-Jaén, con sustratos de suelos originarios, que fluctuó entre 12 y 24 días, independientemente de la procedencia de los distintos lugares del mencionado poblado.
El vigor germinativo tuvo un comportamiento ínfimo, 0,43, en concordancia con el bajo poder germinativo y la duración de la germinación. Aquellas especies que distribuyen la energía que dedican a la fructificación en producir un gran número de semillas pequeñas, como es el caso de C. pubences, esta capacidad de distribuirse ampliamente pues tiene mayores oportunidades de que las semillas encuentren un sitio favorable para crecer (Rossetto et al., 2000). Su tamaño pequeño contribuye de manera escasa al crecimiento de la nueva planta, que queda con altas posibilidades de morir al depender con precocidad, de los recursos disponibles en el medio. Otro dato importante es que estas plantas son sensibles al daño de agentes bióticos y abióticos, siendo su supervivencia mínima, lo cual se compensa por el gran número de semillas que producen los individuos de esta especie.
Ensayos de almacenamiento
La no germinación de las semillas al mes de almacenamiento, coincide con lo planteado por Acosta (1945), referente a que, cuando las semillas están frescas germinan entre un periodo de 11 y 20 días y si son viejas, según sea el periodo de almacenamiento, el porcentaje de germinación disminuye, por tanto, las semillas de esta especie al ser sometidas a almacenamiento superior a un mes, pierden su viabilidad.
Los resultados evidencian que el factor tiempo influye en la germinación porque, las semillas de C. pubescens al ser sometidas a cada uno de los tratamientos de conservación en tiempos de 1 a 4 semanas, baja el porcentaje de germinación conforme se aumenta el tiempo de conservación hasta llegar a un valor de cero a la cuarta semana, con independencia del medio de almacenamiento y el tipo de envase empleado.
Los tratamientos en condiciones de refrigeración para los diferentes tipos de envases en la primera semana de almacenamiento mostraron una mejor tendencia en el comportamiento de la germinación. Ortiz et al. (2004) resaltan a las cámaras climatizadas con acondicionador de aire doméstico como ventajosas, ratificando el efecto favorable de las bajas temperaturas en el almacenamiento de semillas. Por su parte Ruíz et al., (2017), Valverde et al., (2019), ratifican que los tratamientos refrigerados mostraron significación respecto a los tratamientos no refrigerados.
Al estudiar el almacenamiento de semillas de Dypsis lutescens,Doria et al., (2012), encontraron que el mejor envase fue polietileno negro seguido de frascos plásticos traslúcidos, en tanto los mejores tratamientos fueron los de polietileno negro en refrigeración y condiciones ambientales. Estos resultados difieren a los obtenidos en esta investigación pues las fundas de polietileno traslúcido fueron las de mejor comportamiento, pero coinciden al manifestarse como mejor envase en ambas condiciones de almacenamiento.
En relación al requerimiento de luz, la mayoría de las especies arbóreas se comportan como indiferentes (Flores et al., 2017), germinando tanto en condiciones de luz como de oscuridad. Con base a que, ecológicamente la percepción de la luz por la semilla puede actuar como un indicador de la cantidad de luz disponible para la plántula, puede indicar profundidad de siembra, sombreamiento por doseles vegetales y disturbios de suelos. Se sustenta este comportamiento en que la presencia o ausencia de luz indica a las semillas si están próximas a la superficie o enterradas, por otro lado, la razón rojo/rojo lejano (R/RL) es un indicador de presencia y tamaño de claros de bosque, es decir, de la densidad del dosel de acuerdo con lo expuesto por Escobar y Cardoso, (2015). En la experiencia destaca que cuatro de los cinco tratamientos con mejor comportamiento tiene la característica de un envase de tipo traslúcido, lo que permite suponer que las semillas de C. pubencens podrían manifestar mejor su germinación, con niveles determinados de presencia de luz durante su almacenamiento, ya sea este artificial o natural en el banco de semillas del suelo.
Al emplear el almacenamiento hermético, los recipientes evitan la entrada de aire y humedad al producto. En estas condiciones, la respiración de la semilla y de los insectos (cuando los hay) agota el oxígeno existente, provocando la muerte de estos últimos y la reducción de la actividad de la semilla, por lo que el almacenamiento puede durar mucho tiempo sin que exista deterioro.
Al abrir los envases para extraer las semillas al momento de los montajes de germinación, se realiza un intercambio gaseoso con el medio ambiente local. Una vez cerrado el envase, en su interior se restablece un intercambio de humedad entre las semillas y el medio en el interior del envase, lo cual provoca generalmente un aumento del contenido de humedad en las semillas. Este aspecto resulta más relevante para el almacenamiento en condiciones ambientales, lo que puede acelerar el deterioro de las semillas, a diferencia del ambiente en frío pues la humedad en el microambiente del envase es menor, dado que la humedad relativa en la nevera es también menor (Ruíz et al., 2017).
El vigor germinativo de los tratamientos muestra similar tendencia que el poder germinativo, pero se distingue que existen algunos incrementos para algunos casos, y está dado por la reducción del número de días en manifestar el máximo poder germinativo acumulado. En la experiencia se obtienen valores inferiores a uno hasta cero, en tanto Campos et al. (2014) lograron valores desde cero hasta el 13,5 de vigor germinativo.
Conclusiones
La calidad que presentaron las semillas de C. pubescens es baja en relación al porcentaje de germinación, al de bajo peso y al de pureza física media.
La germinación de las semillas de C. pubescens no ocurre a partir de un mes de almacenamiento, con una reducción significativa a partir de la primera semana, en tanto fundas transparentes como envase es la mejor opción, sin que existan diferencias entre el medio de refrigeración y medio natural.











 texto en
texto en