INTRODUCCIÓN
Internacionalmente se considera que las funciones que se llevan a cabo en el Servicio de Farmacia hospitalaria, dentro del entorno de un estudio con medicamentos, son fundamentales para el buen funcionamiento de una investigación clínica. El área de ensayos clínicos (EC) en ese servicio se encuentra interrelacionado con el personal de los distintos servicios que realizan este tipo de investigaciones en las instituciones de salud, así como con los promotores, los inspectores y los revisores de diverso tipo.
El desarrollo y la implementación de un Expediente o manual de normas y procedimientos para ensayos clínicos en Farmacia es la mejor garantía para asegurar que se realicen correctamente las tareas dentro de la investigación que corresponden al personal farmacéutico. La exigencia y la responsabilidad son altas en el caso de los ensayos clínicos: por un lado, deben realizarse las funciones que corresponden en el marco legal y que establecen la institución y el país mediante las regulaciones nacionales e internacionales para la prescripción y el control de este tipo de fármacos y, por otro, existe el compromiso de garantizar la idoneidad, la transparencia y el respeto a los postulados éticos de toda investigación efectuada en seres humanos.
Las Guías de Buenas Prácticas Clínicas, las Guías de la Conferencia Internacional de Armonización1 y el Código de Regulaciones Federales2 son estándares nacionales e internacionales que guían la forma en que son conducidos los ensayos clínicos. En ellos se mencionan, someramente, el papel y las responsabilidades del personal farmacéutico en la ejecución de investigaciones clínicas. La Autoridad Nacional Reguladora de Medicamentos de Cuba y el Centro Estatal para el Control de la Calidad de los Medicamentos, Equipos y Dispositivos Médicos de Cuba (CECMED) han adaptado estas guías y tomado en consideración la terminología, el contexto y el entorno nacional de manera que, al cumplir lo establecido internacionalmente, los procesos descritos se ajusten a lo que realmente se realiza en Cuba.3 Las guías de Buenas Prácticas Clínicas, las guías de la Conferencia Internacional de Armonización1 y el Código de Regulaciones Federales son estándares nacionales e internacionales que guían la forma en que son conducidos los ensayos clínicos. En ellos se mencionan, someramente, el papel y las responsabilidades del personal farmacéutico en la ejecución de investigaciones clínicas. El CECMED ha adaptado estas guías y ha tomado en consideración los términos, el contexto y el entorno nacional de manera que, al cumplir lo establecido internacionalmente, los procesos descritos se ajusten a lo que realmente se realiza en Cuba; no obstante, en ninguna de ellas se recogen, de manera explícita, las normas y los procedimientos para el manejo del producto de investigación (PI) en farmacia. Es importante considerar especialmente la variabilidad inter-hospitalaria y el hecho de las diferencias de procedimientos entre promotores; en ocasiones, una farmacia hospitalaria atiende productos de investigación clínica de tres o más promotores.
Actualmente, en casi la totalidad de las provincias del país, se conducen ensayos clínicos con productos del Centro de Inmunología Molecular (CIM) y del Centro de Ingeniería Genética y Biotecnología (CIGB) fundamentalmente, a los que se unen otros centros de investigación como el Instituto Finlay de Vacunas y el Centro de Bioactivos Químicos de la Provincia de Villa Clara. Estos sitios de investigación, a pesar de que se rigen por el Sistema Nacional de Salud cubano, difieren en sus características estructurales, su infraestructura, los recursos humanos y materiales y la experiencia del personal, entre otros; por tanto, los procesos no son llevados a cabo de igual manera. Sin embargo, se exige a los centros hospitalarios en los que se ejecutan ensayos clínicos una correcta utilización de los registros que provee cada promotor para las investigaciones.
En el Hospital “Arnaldo Milián Castro” se comenzaron a desarrollar ensayos clínicos en el año 1994; hasta el momento se han ejecutado un total de 48 investigaciones clínicas.
En los inicios las funciones del personal farmacéutico en estos estudios se realizaron siguiendo las Guías de Buena Prácticas Clínicas (BPC) establecidas nacional e internacionalmente. A partir de 2006 comenzó a utilizarse el Manual de normas y procedimientos para farmacia hospitalaria4 y la Resolución 26-2000: Requerimientos para el manejo y uso de los productos en investigación en los ensayos clínicos y responsabilidades de las partes.5 Desde 2007 se incorporaron elementos de los Procedimientos Normalizados de Operación (PNO) elaborados por los centros promotores para el manejo del producto de investigación de ensayos clínicos; sin embargo, las características propias del hospital condicionaron que los procedimientos no respondieran completamente a la forma de realización de los procesos referentes a los ensayos. Esto se debe a que los PNO son documentos escritos por expertos en un tema específico, pero el proceso no se considera completo si cada entidad no elabora sus propios procedimientos en atención a sus requisitos específicos y los adopta.
En 2011 se comienza a elaborar en la institución el sistema documental de los procesos de evaluación y tratamiento de pacientes en ensayo clínico, que quedó validado e implementado en 2013, el PE-PIF/01: Manejo del producto de investigación por el personal farmacéutico, el primer procedimiento propio para esta área de trabajo.
Las evaluaciones sucesivas de este procedimiento, el aumento de los estándares de calidad en todos los sectores de la investigación clínica, la necesidad de una administración ágil en las relaciones con los centros en los que se producen los productos de investigación y la rigurosidad en el proceso motivaron la creación y la implementación de un Expediente de normas y procedimientos de Ensayos Clínicos en Farmacia propio del hospital, que engloba los requerimientos internacionales y los nacionales con las particularidades inherentes a cada promotor y a las características de la institución.
MÉTODOS
Se realizó una investigación de intervención en sistemas y servicios en el manejo y el uso de los productos en investigación en los ensayos clínicos ejecutados en el Hospital Universitario Clínico Quirúrgico “Arnaldo Milián Castro” (AMC) de la Ciudad de Santa Clara, Provincia de Villa Clara, durante los años 2018 y 2021.
Universo: los 60 procesos involucrados en el tratamiento médico de pacientes incluidos en ensayos clínicos.
Muestra: los 11 procesos de manejo y uso del producto de investigación, la muestra fue seleccionada de forma intencional por representar los procesos principales en un sitio de investigación que dan respuesta a los objetivos de incremento de la calidad relacionados con la gestión de ensayos clínicos en los Servicios de Farmacia hospitalaria.
Se realizó un estudio de intervención y, conjuntamente, se elaboró el sistema de gestión de los procesos de manejo y el uso del producto de investigación. Para el análisis y la implementación del sistema documental se utilizaron los aspectos comunes de metodologías descritas en la literatura acerca de sistemas documentales según las normas ISO 9000.6,7
Modelado y descripción de los procesos de manejo y uso del producto de investigación
Se elaboraron los mapas de los procesos y se tomaron como guía los PNO de la European Medicines Agency (EMEA)8 y la Normativa para la regulación de ensayos clínicos en humanos.9 Se definieron las entradas y las salidas generadas en la farmacia hospitalaria para ensayos clínicos, ya sea en forma de producto o de documentación. Se elaboró el diagrama de flujo del producto de investigación en ensayo clínico.
Se identificaron las actividades que forman parte de los procesos y las principales relaciones que entre ellas existen y se definieron las áreas de investigación involucradas en cada caso, así como los puntos críticos en la ruta del producto de investigación.
Implementación del sistema documental
La implementación del sistema documental constó de las siguientes etapas:
Etapa 1. Determinación de necesidades del sistema documental (2018-2019)
Se realizó un plan de elaboración de documentos que incluyó PNO, registros, modelos y certificados:
Documentos a elaborar: según las necesidades de documentación determinadas mediante el mapa de procesos.
Estructura de los documentos: se definieron los objetivos, el alcance y las responsabilidades de los ejecutantes y revisores de cada procedimiento.
Formato de los documentos: los procedimientos se elaboraron siguiendo el formato establecido que incluye título, logotipo y nombre de la institución, código interno según cuadro de clasificación de documentación hospitalaria nacional, vigencia, versión, páginas, nombre completo, cargo y firma de quienes elaboran, revisan, aprueban y otorgan el visto bueno de cada procedimiento, así como la fecha.
Definición del personal responsable de cada fase de elaboración de los documentos: se realizó a partir de la experiencia que tenían en la conducción de los ensayos clínicos.
Etapa 2. Diseño del sistema documental (2019-2020)
Se elaboraron los documentos previstos y se sometieron a aprobación. El personal responsable de la aprobación y el visto bueno se designó según consideraciones curriculares y administrativas de la entidad.
En distintos momentos de estas dos etapas se empleó el enfoque a través de informantes clave como técnica participativa para la búsqueda de consenso. Este rol fue desempeñado por 10 profesionales seleccionados en atención a su amplio conocimiento sobre el contexto institucional y el problema de este estudio. Participaron dos investigadores del Centro de Ingeniería Genética y Biotecnología y una cifra igual por el Centro de Inmunología Molecular y por el Centro Nacional Coordinador de Ensayos Clínicos; por el Hospital “Arnaldo Milián” cuatro especialistas fueron solicitados para esta tarea. Estos informantes clave poseían experticia demostrada en las áreas administrativa, farmacéutica, asistencial y de ensayos clínicos. En la mayoría de las oportunidades la forma de obtener la información fue personalmente, mediante la entrevista en profundidad abierta. En la minoría de las oportunidades se emplearon las vías electrónica y telefónica. La cantidad de consultas fue variable y se dio por concluida la valoración sobre la documentación en la segunda etapa al obtener la conformidad con la estructura y el contenido del manual.
Etapa 3. Implementación del sistema documental (2020-2021)
Se pusieron en práctica los documentos elaborados y se orientó su uso en las áreas de investigación de la institución involucradas en los procesos de manejo y uso del producto de investigación, que se consideraron clientes de la actividad, así como los promotores de investigaciones clínicas en ejecución o propuestas a ejecutar. Se determinó evaluar los resultados de la implementación dentro de un rango de tres años a partir de la fecha de vigencia del manual diseñado.
RESULTADOS
El Manual de normas y procedimientos de Ensayos Clínicos en Farmacia quedó estructurado en cuatro partes. Primeramente cuenta con los acápites básicos para un manual de organización y procedimientos: carátula o portada, índice o contenido, introducción y objetivos del manual. La segunda corresponde a documentos establecidos por el Ministerio de Salud Pública, dados por el Manual de Normas y Procedimientos para farmacias hospitalarias, que contempla disposiciones generales de la actividad y la Regulación 26/00: Requerimientos para el manejo y uso de productos en investigación en ensayos clínicos y responsabilidades de las partes del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). La tercera parte del manual abarca todos los procedimientos, registros y modelos diseñados en la institución y también contempla determinados documentos propios de los promotores de investigaciones clínicas que solicitan la participación del centro asistencial en sus investigaciones. Por último, se ofrece un glosario de términos para la mejor comprensión de la actividad.
Entre las funciones que se llevan a cabo en el área de ensayos clínicos del Servicio de Farmacia hospitalaria con los medicamentos en investigación se destacan:
Recepción de los medicamentos: se verifica que se ha recibido en las condiciones adecuadas toda la medicación registrada (unidades, fármaco, lote y caducidad). La recepción se confirma con la información recibida por el promotor del ensayo y se comunica la recepción correcta.
Almacenamiento o custodia: se garantiza que la medicación se almacena de forma adecuada, cumpliendo con las especificaciones del protocolo y de las indicaciones del fabricante. El almacenamiento debe cumplir las normas de conservación establecida por el promotor en cuanto a temperatura, humedad y exposición a la luz, entre otras.
Control de stock: se garantiza que siempre haya medicación disponible para un nuevo paciente o para terminar el tratamiento de los pacientes incluidos en el ensayo clínico y se solicitan nuevos envíos cada vez que se necesiten. Se garantiza la retirada de la medicación caducada.
Dispensación: se realiza la preparación y la manipulación de los medicamentos según las instrucciones que se indique en cada ensayo clínico.
Se identifica, por receta médica oficial, y se consignan en ella, de manera clara, los siguientes datos: ensayo clínico de que se trate, fecha de la dispensación, código del paciente, unidades de fármaco entregado y dosis a administrar, siguiendo el procedimiento establecido al efecto.
Además, se debe proporcionar información relativa a la administración (esquema de dosificación, a la toma de la medicación con relación a los alimentos, al lugar de conservación o cualquier otra información solicitada) al personal al que se dispensa.
Trazabilidad: se lleva una trazabilidad correcta del medicamento suministrado para cada paciente para, en el caso de retirada por una alerta sanitaria o por la finalización anticipada del ensayo, poder conocer a quién está destinada la medicación.
Destrucción o devolución (o ambos): en dependencia de cada fabricante o ensayo clínico la medicación se devuelve al promotor, que se encarga de su destrucción, o se destruye por el propio Servicio de Farmacia, previa especificación documental de por qué se procede así mediante un acta de destrucción.
Mapas de procesos
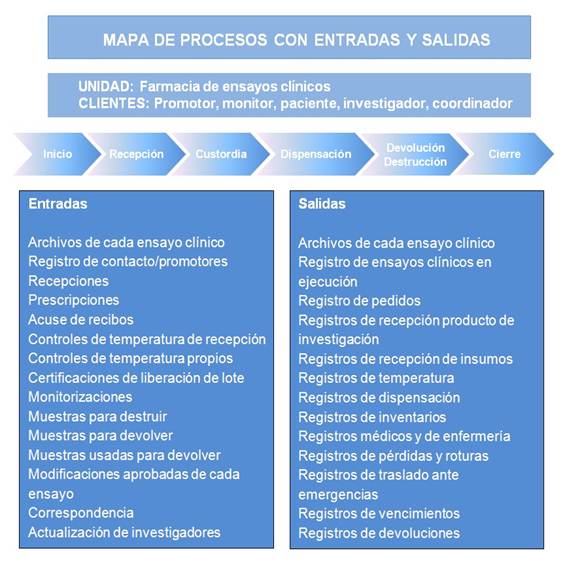
La Figura 1 representa el mapa del proceso de manejo y uso que describe el proceso de forma general y los subprocesos que lo conforman. Se resaltaron las entradas y las salidas generadas en la Farmacia hospitalaria para ensayos clínicos, ya sea en forma de producto o de documentación.
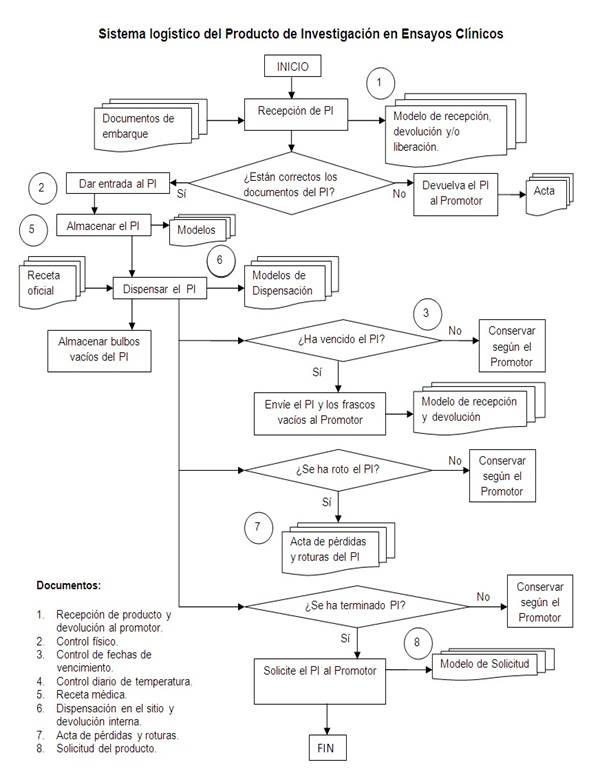
La Figura 2 representa el diagrama de flujo del producto de investigación en ensayo clínico centrado en los subprocesos específicos de recepción, custodia, dispensación y devolución/destrucción.
Sistema documental
En la Tabla 1 se relacionan los procedimientos específicos elaborados, los registros generados y otros documentos, con su código, que conforman el sistema documental en los procesos de manejo y uso de los productos de investigación en ensayo clínico. Algunos de los documentos corresponden a modelos oficiales establecidos por el Ministerio de Salud Pública de Cuba, otros corresponden a documentación propia de cada centro promotor.
DISCUSIÓN
La importancia de la representación de los procesos a través del mapeo dentro de la faceta de la gestión de calidad de una entidad o servicio, en este caso el manejo y el uso del producto de investigación en ensayo clínico, es indudable. Al mapear los procesos se contribuye a hacer visible el trabajo que se lleva a cabo de una forma distinta a la que ordinariamente se conoce, permitiendo así notar tareas o pasos que a menudo pasan desapercibidos y que, sin embargo, afectan el resultado final del trabajo.10
Para establecer la gestión basada en los procesos se tienen que identificar todos los procesos que se incluirían en cada uno de los tres grandes bloques: estratégicos, operativos y de soporte. A partir de aquí se elabora el mapa de procesos que ayuda a identificar sus interrelaciones y que resulta una aproximación que define la organización como un sistema de procesos interrelacionados, que muestra cómo sus actividades están relacionadas con los clientes externos, los proveedores y los grupos de interés, que da la oportunidad de mejorar la coordinación entre los elementos clave en el sistema y que es un método para visualizar las actividades de la farmacia en relación con los ensayos clínicos a todos los niveles mediante los procesos ordenados por sus jerarquías y relaciones.11,12
La realización del mapa de procesos implica que se definan roles y responsabilidades en la farmacia y los factores involucrados, mejora el flujo de información entre las diferentes funciones y el hecho de tener objetivos definidos a todos los niveles propicia que los distintos niveles dentro del hospital estén alineados en la visión global de la institución.13 Además, los objetivos definidos en todos los niveles están alineados a la visión organizacional, con el mapa de procesos se consiguen indicadores claves de desempeño que sirven también para identificar oportunidades importantes. Con un mapa de procesos se consigue tener más orden y alinear visiones de la empresa, en este caso la farmacia vinculada a la actividad de ensayos clínicos, y se logra una perspectiva global con obligación a posicionar cada proceso.12,14
Con la definición de especificidades en la recepción, la custodia, la dispensación y la devolución/destrucción como subprocesos operativos dentro de la actividad de uso y manejo del producto de investigación en ensayo clínico para la farmacia de la institución, aumenta la flexibilidad y la adaptabilidad del trabajo, se eliminan actividades que no aportan valor ni investigativo ni práctico y se incrementa la capacidad de los especialistas dedicados a la tarea, lo que potencia la gestión de la calidad y la mejoría en la productividad.
La representación de los cuatro subprocesos operativos se realizó mediante un diagrama de flujo que representa la esquematización gráfica de un algoritmo que muestra gráficamente los pasos o procesos a seguir para alcanzar la solución de cada problema.15
En sentido general esta representación permite:
Definir nivel de detalle de la información: establecer pautas de desarrollo de la actividad en áreas generales o específicas.
Trabajar en equipo para armar el diagrama: en el momento de construir el diagrama de flujo de procesos lo más importante es trabajar con todos los sectores involucrados, así pueden detectarse los momentos en que hay un cambio de manos de la responsabilidad.
Estandarizar el diagrama de flujo y capacitar: en el caso de que existan varias personas en el mismo rol es importante validar si todas las personas realizan las tareas en la misma forma. De no ser así, deben ser capacitadas. Un ejemplo sería el completamiento de la receta para producto de investigación en ensayo clínico, que requiere especificidades que no siempre son del dominio de los investigadores. El alcance de consenso en estas actividades permite la transparencia en la ejecución.
Estudiar los tiempos sobre el diagrama de flujo para mejorarlos: esta práctica consiste en la aplicación de técnicas para estimar el tiempo necesario para desarrollar cierta tarea realizada en base a una norma o estándar. Aunque la medición del trabajo normalmente es realizado para tareas repetitivas en industrias de manufactura, su influencia es evidente en ciertos puntos del diagrama como el almacenamiento del producto de investigación, de tal forma que se mantenga la cadena de frío, la disminución de los tiempos de espera entre solicitud y la entrega de producto, entre otros.15,16
Se diseñó la serie documental para el manejo y el uso de los productos de investigación en ensayo clínico, dada por procedimientos específicos, registros y otros documentos. Se definió una estructura homogénea para todos los documentos, su formato y el personal responsable de cada fase de elaboración. Lo integran el Manual de normas y procedimientos para Farmacia hospitalaria y la Resolución 26-2000: Requerimientos para el manejo y el uso de los productos en investigación en los ensayos clínicos y las responsabilidades de las partes como documentos de carácter regulatorio general.
Fueron elaborados once procedimientos específicos, veinte registros y tres documentos de otro tipo. Seis registros corresponden a modelos de los PNO establecidos por los promotores y dos responden a documentos establecidos por el Ministerio de Salud Pública. Todos los documentos fueron sometidos a revisión y aprobación. La responsabilidad de la revisión estuvo a cargo, en todos los casos, del Coordinador de Investigación Clínica. La aprobación y el visto bueno para su puesta en práctica correspondieron al Subdirector de Medios Diagnósticos y Consulta Externa y al Director General de la institución, respectivamente.
Se destacan registros especializados para el contacto y el control del personal involucrado en la actividad (médicos, enfermeros, farmacéuticos especializados en la actividad de investigación clínica y personal perteneciente a centros promotores encargados del manejo del producto). No se ha determinado en la bibliografía consultada la existencia de procedimientos para la protección del producto de investigación ante situaciones de desastre o emergencias, elemento que si se considera en el presente sistema documental y que se consideró uno de los principales aportes de esta investigación. En este sentido se elaboró un procedimiento específico y un registro de movimiento que contemplaría situaciones críticas como la falta de abastecimiento eléctrico para la conservación del producto. Se diseñó también un procedimiento de emergencias para casos de desastres, de origen natural o tecnológico, con un registro de movimiento de producto de investigación y la documentación correspondiente y un plan de medidas a ejecutar.
El personal involucrado en la conducción de los ensayos clínicos en cada área de investigación que tributara a la actividad de manejo y al uso de productos de investigación fue orientado en función de la puesta en práctica de lo descrito en los documentos y asesorado en los puntos críticos de los procesos.
CONCLUSIONES
La existencia de documentación propia de la institución, ya sean procedimientos para algunas de estas actividades o manuales de organización terminados, supone un paso de avance en el diseño acorde a la necesidad individual, tan necesario ante los desafíos cada vez mayores de las investigaciones clínicas, lo que posibilita lograr el adecuado funcionamiento de un ensayo clínico a todos los niveles y con una excelente calidad de trabajo, de esta forma se consigue minimizar errores y una recepción, un almacenamiento y una administración efectiva de la medicación, así como preparar y dispensar el producto de investigación de manera correcta.
Se aseguró realizar ensayos clínicos con estándares de calidad ajustados a las particularidades del hospital para alcanzar el cumplimiento de las Buenas Prácticas Clínicas.