Introducción
Las infecciones intrabdominales (IIA) constituyen un diverso grupo de procesos intra y retroperitoneales que incluyen infecciones no complicadas, en las que el evento se limita al órgano de origen y no involucra el peritoneo (apendicitis, diverticulitis, colecistitis, etcétera) y complicadas, cuando se extiende al peritoneo, desencadenando cuadros generales y peritonitis difusas o localizadas como los abscesos intrabdominales.1,2,3 Representan la tercera causa (en incidencia) de sepsis luego de la neumonía y la infección urinaria y la segunda causa de muerte en unidades de terapia intensiva. Entre el 10 % y los 15 % de los pacientes con IIA complicadas desarrollan sepsis o shock séptico, en el curso de la enfermedad, con una elevada mortalidad. La principal fuente de infección, en el 60 % de los casos, es colónica seguida por la infección apendicular y biliar.3,4
Desde tiempos remotos existe la imperiosa necesidad de atender de forma prioritaria a los pacientes en peligro de muerte, situación que se refleja desde el año 1854 durante la Guerra de Crimea, cuando Florence Nightingale, citada por Loveday HP,5 consideró que era preciso separar a los soldados en estado de gravedad de aquellos que solo tenían heridas menores para cuidarlos de manera especial, con lo cual se logró reducir la tasa de mortalidad de heridos en el campo de batalla del 40 % al 2 %.
La medicina intensiva es la rama de la medicina que se ocupa del paciente en estado crítico, que se define como aquel que presenta alteraciones fisiopatológicas que alcanzan un nivel de gravedad tal que representan una amenaza real o potencial para su vida y que al mismo tiempo son susceptibles de recuperación. Por lo tanto, hay cuatro características básicas que definen al paciente crítico:6
Enfermedad grave.
Potencial de revertir la enfermedad.
Necesidad de asistencia y cuidados de enfermería continuos.
Necesidad de un área tecnificada, unidad de cuidados intensivos (UCI).
En este orden de ideas se puede mencionar que la morbimortalidad de la IIA es significativa y constituye la segunda causa más frecuente de mortalidad por infección en la UCI, lo cual depende del origen anatómico del inóculo bacteriano, con una variación entre el 5 % y el 50 %, con un incremento de hasta el 80 % si se acompaña de bacteriemia o fallo multiorgánico.7,8
Cabe agregar que el porcentaje de recidivas, la tasa de infecciones o de supervivencias y el difícil control de la IIA en ocasiones constituyen un fiel reflejo de una práctica clínica cada vez mejor, asentada en bases científicas encaminadas a la consecución de estándares preestablecidos que muestran la calidad de un servicio quirúrgico. Sin embargo, se han detectado grandes variaciones en la calidad de la asistencia entre países, regiones y hospitales,9,10 lo cual traduce el vacío de conocimiento sobre el problema o controversia existente, así como la evidencia no conclusiva debido a la gran variabilidad clínica en el diagnóstico y control de la IIA.9,10,11 Los datos nacionales que evalúen directamente el valor de marcadores clínicos, imaginológicos y de laboratorio establecidos en la decisión de reintervenciones abdominales tras una IIA, son escasos, todo lo cual motiva la realización de la presente revisión.
El objetivo del artículo fue profundizar en los conocimientos actuales sobre el manejo de la infección intrabdominal en la unidad de cuidados intensivos
Métodos
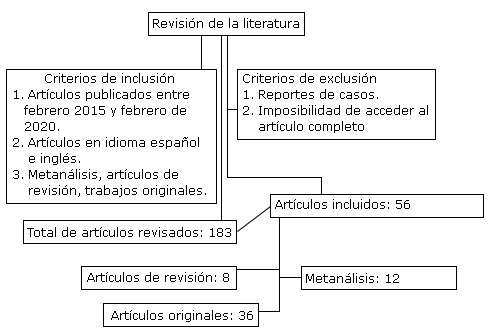
Se realizó un artículo de revisión de tipo exploratorio-descriptivo para profundizar el tema en cuestión, en el cual se consultaron fuentes primarias y secundarias de información a través de las bases de datos Scopus, Medline, Cochrane y Redalyc bajo los criterios de sus revisores. (Fig.).
Las búsquedas fueron específicas en idioma español e inglés con las siguientes palabras claves: infección intrabdominal, diagnóstico, tratamiento y pronóstico. Se utilizó el paquete informático EndNote X 9.3.1 de gestión de referencias. En un segundo momento se realizó una revisión meticulosa de los artículos de forma manual por los cuatro autores de la revisión con la aplicación de criterios de selección específicos acorde al tema estudiado.
Desarrollo
La peritonitis constituye un proceso patológico habitual en los servicios quirúrgicos y causa entre el 11 % y el 14 % de los ingresos, así como el 2,8 % de las operaciones en general. En los servicios de emergencias el 2 % de los enfermos se atienden por esta afección. La presencia de la enfermedad en la UCI, es similar a la de las neumonías y las bacteriemias con pronóstico y costo de atención comparables.12,13,14 Los pacientes con peritonitis llegan a representar el 2,5 % de todos los ingresos de pacientes críticos. Uno de cada cuarenta enfermos graves padece una infección peritoneal. Asimismo, esta constituye el 25 % de todas las sepsis. Antes de la introducción del tratamiento quirúrgico, la tasa de mortalidad por peritonitis alcanzaba aproximadamente el 88 %. En los años 20 de la pasada centuria, cuando los principios de la terapéutica operatoria comenzaron a ser comúnmente aceptados, esta disminuyó hasta alrededor del 50 %. En las décadas siguientes, el pronóstico no se modificó significativamente a pesar del empleo de los antibióticos y la mortalidad alcanzó el 70 %. En la actualidad continúa con cifras elevadas y tasas que oscilan entre el 8 % y 60 %.15,16,17) En Cuba, en 1987, la mortalidad por peritonitis en la unidad de cuidados intensivos del Hospital “Vladimir Ilich Lenin” de Holguín era de 59,2 %.18 En otras instituciones de salud del país, en años recientes, se situó entre 19,3 % y 47,5 %; por lo que todavía representa un azote en los servicios de cirugía general y de cuidados intensivos.19
Tipos de infección intrabdominal
La clasificación de la infección intrabdominal se puede realizar desde diferentes perspectivas. Por ejemplo, a partir de su localización, intraperitoneal o retroperitoneal. Según la extensión que afecte (peritonitis localizada o difusa), o según la capacidad del huésped de coleccionar la infección (absceso intrabdominal).8,18 La IIA no contenida, peritonitis, puede ser primaria, si no se documenta un foco intrabdominal responsable, o secundaria, si se produce a consecuencia de una perforación gastrointestinal o a partir de un absceso visceral. La IIA se denomina monomicrobiana si el patógeno responsable es único, o polimicrobiana si se identifican varias especies. Dependiendo de si el paciente adquiere esta infección sin previa relación con el medio sanitario, se define como IIA comunitaria, y nosocomial si la adquiere estando ingresado. Dentro de la clasificación de IIA nosocomial se encontraría el grupo específico de las IIA secundarias postoperatorias. Cuando la peritonitis persiste a pesar del tratamiento antibiótico y control de foco repetido, en el contexto de un paciente grave, hablamos de la peritonitis terciaria;19 es una infección recurrente de la cavidad peritoneal que ocurre > 48 horas después del control de la peritonitis secundaria aparentemente exitoso y adecuado de forma quirúrgica. Es más común en pacientes críticos o inmunocomprometidos y puede asociarse a menudo con bacterias resistentes a múltiples antibióticos.8,17,18
Si bien parece que la incidencia de la infección intrabdominal difusa (peritonitis) se mantiene constante, se ha observado un incremento de la infección localizada en forma de abscesos intrabdominales (AIA).19 El motivo es multifactorial y en primer lugar responde a la mayor incidencia de algunas infecciones órgano-específicas (diverticulitis, pancreatitis, colecistitis), que reciben un diagnóstico y tratamiento antibiótico cada vez más precoz en huéspedes con mejor respuesta inmune. Ello favorece la localización de la infección y permite un control de foco menos agresivo y mejor tolerado por el paciente. Las infecciones postoperatorias de órgano-espacio son otra fuente de AIA. Aunque la infección intrabdominal postoperatoria puede presentarse como una peritonitis difusa, también puede hacerlo en forma de AIA.19,20,21,22
La mayoría de las IIA activan la cascada inflamatoria; sin embargo, una infección intrabdominal que causa los efectos sistémicos de la sepsis se describe como sepsis abdominal.23
La peritonitis aséptica, química, se produce cuando entran en la cavidad abdominal sustancias irritantes. La inflamación de la serosa peritoneal es inicialmente estéril. Casi todas las sustancias que producen peritonitis aséptica pueden servir de coadyuvantes cuando ocurre una contaminación bacteriana, como, por ejemplo, contenido gástrico, jugo pancreático, bilis, orina, sangre, meconio, quilo, bario, etcétera.24,25
La clasificación de la gravedad clínica de los pacientes con peritonitis aguda (PA) se basa en las definiciones de sepsis. La mortalidad está directamente relacionada por el estado de sepsis al diagnóstico, aumentando en los pacientes que desarrollan disfunción orgánica y shock séptico. Pudiendo clasificar la PA como: sin sepsis, con sepsis y con shock séptico.25
La mortalidad por infección intrabdominal asociada a la atención hospitalaria es más alta que las IIA adquiridas en la comunidad. Las IIA no postoperatorias asociadas a la atención sanitaria, que surgen en pacientes hospitalizados por razones no relacionadas con enfermedades abdominales, tienen un pronóstico particularmente desfavorable.23
En estos casos, el diagnóstico se retrasa a menudo debido a un bajo índice de sospecha, un deficiente estado de salud subyacente y alteraciones sensoriales. Las IIA asociadas a la atención sanitaria muestran una tendencia mucho mayor a guardar relación con patógenos resistentes a fármacos de espectro reducido y, en consecuencia, son más propensas a ser tratadas de un modo inadecuado, contribuyendo al incremento de los fracasos terapéuticos y a una mayor incidencia de morbilidad y mortalidad.24,25
Microbiología
La peritonitis primaria afecta tanto a adultos como a niños. (26 Son infecciones monomicrobianas producidas por bacterias aerobias como Streptococcus pneu-moniae, Streptococcus pyogenes o Mycobacterium tuberculosis.25,26 Puede observarse en pacientes cirróticos y/o inmunocomprometidos.26,27 La cirrosis y la ascitis predisponen a la infección por disminución de las proteínas totales y de los niveles del complemento, con deterioro en la opsonización bacteriana y disminución de la quimiotaxis y fagocitosis de polimorfonucleares; la falta de defensas locales hace posible el crecimiento de los gérmenes en el líquido ascítico. Estos llegan por vía hematógena a través de la contaminación por sangre y por los conductos linfáticos (translocación bacteriana).28
La peritonitis secundaria es una extensión de un proceso infeccioso de inicio local. El tipo de microorganismo que se encuentra en las peritonitis secundarias depende de la altura del tracto digestivo en que se origina. Si las bacterias que se identifican son del tracto digestivo alto, serán cocos Gram positivos, mientras que si proceden del tracto digestivo bajo serán aerobios y anaerobios con predominio de bacterias Gram negativas. Las bacterias aerobias aisladas con mayor frecuencia son Escherichia coli, Klebsiella spp., Enterobacter spp., Pseudomonas aeruginosa y Enterococcus spp., mientras que entre las anaerobias se incluyen Bacteroides del grupo fragilis, Peptostreptococcus y Clostridium perfringens.24 En la mayoría de las ocasiones se asocian la flora aerobia y anaerobia, debido a que las bacterias aerobias potencian el crecimiento de las anaerobias al utilizar el oxígeno disponible. Esta flora variará si la persona infectada ha recibido antibióticos previamente o si ha presentado una estancia hospitalaria prolongada.25
A diferencia de la peritonitis secundaria, los cultivos de las muestras peritoneales de los pacientes con peritonitis terciarias son positivos para microorganismos con una capacidad patogénica menor en el paciente inmunocompetente y con resistencia antibiótica variable como Enterococcus spp., Candida albicans, Estafilococos coagulasa negativa, Enterobacter spp. y Pseudomonas aeruginosa26 y enterobacterias productoras de BLEE (betalactamasas de espectro extendido) y/o carbapenemasas. El aislamiento de Enterococos en el cultivo intraperitoneal se asocia a un incremento en la mortalidad.24,25
La mayoría de los abscesos intrabdominales son constituidos por flora mixta (organismos aeróbicos y anaeróbicos). El aerobio más frecuentemente aislado es Escherichia coli y el anaerobio Bacteroides fragilis, que actúan de forma sinérgica. En pacientes bajo tratamiento antibiótico prolongado y con persistencia del foco primario, los cultivos pueden mostrar hongos y otros patógenos nosocomiales como Enterococcus sp. Los diferentes orígenes de la infección condicionan el tipo de microorganismos y, a su vez, una densidad determinada. Por ejemplo, como consecuencia de una herida penetrante abdominal cabe esperar flora cutánea, mientras que en la enfermedad pélvica inflamatoria se esperará hallar Neisseria gonorrhoeae o Chlamydia trachomatis.28
Patogénesis
El desarrollo de las infecciones intraabdominales se produce por la sinergia entre bacterias aerobias y anaerobias; en la primera etapa del primero al séptimo días predominan los fenómenos provocados por las endotoxinas bacterianas de los gérmenes gramnegativos, en especial Escherichia Coli.32 Proliferan los gérmenes anaerobios a medida que el oxígeno va siendo consumido, principalmente Bacteroides fragilis (20 Por tanto, la fase de absceso se establece entre el quinto y el séptimo día en adelante. Los abscesos intrabdominales se producen en un 25 % de los pacientes tratados de peritonitis generalizada. (30 Otros mecanismos que se cree que favorecen la sinergia son la secreción de nutrientes por un tipo de bacteria que permite el crecimiento de otras más virulentas y secreciones bacterianas que protegen a otras bacterias de las defensas del huésped.15
Ciertos factores ayudan a la proliferación bacteriana, la presencia de sangre procura el sustrato proteico y el hierro acelera la replicación bacteriana. La bilis tiene un efecto detergente ante la fibrina y evita el sellado de las perforaciones y/o su aislamiento. La presencia de detritus determina una reacción a cuerpo extraño. La fibrina disminuye la quimiotaxis de los leucocitos polimorfonucleares y secuestra bacterias formando abscesos o zonas de difícil acceso a los antibióticos. La propia respuesta inflamatoria, encaminada a la erradicación de la infección y a facilitar la reparación tisular, aumenta la permeabilidad vascular, dando paso a proteínas y leucocitos, pero a su vez aumenta el paso de líquido, produciendo un tercer espacio. La degranulación de los mastocitos, con la liberación de histamina y serotonina, puede conllevar una situación de inflamación adversa que provoca daño tisular.32,33,34
Diagnóstico
El diagnóstico de la infección intrabdominal en el enfermo crítico requiere un elevado índice de sospecha. Por razones obvias, los síntomas clínicos como el dolor abdominal a menudo no pueden evaluarse.16,17,18 El 85 % o más de los enfermos presentan fiebre persistente superior a 38 °C y leucocitosis, desviación izquierda o ambos. Sin embargo, la primera manifestación puede ser el desarrollo de una nueva disfunción orgánica: cardiovascular, respiratoria, renal y hepática (elevación de la bilirrubina y de las transaminasas), además de acidosis metabólica y arritmias supraventriculares. En los enfermos previamente operados, el íleo prolongado (> 3 días), la evidencia de infección de la herida quirúrgica y la aparición de un síndrome de respuesta inflamatoria sistémica o una disfunción orgánica a partir del cuarto día del postoperatorio son asimismo sospechosos.32,33,34
Se utilizan varios marcadores séricos en el diagnóstico. Entre estos: la proteína C reactiva (PCR), la procalcitonina (PCT) y el lactato, los cuales no son específicos de sepsis abdominal. Tras un procedimiento quirúrgico programado, el pico de PCT y PCR se produce, respectivamente, en el primer y en el segundo día del curso postoperatorio.34,35,36 No obstante, si éste transcurre sin complicaciones es de esperar que al quinto día la concentración de ambos reactantes se haya reducido a menos de la mitad de la concentración máxima previa.36,37,38
La prueba de imagen estándar para la evaluación del abdomen es la tomografía computarizada (TC).39 Con el uso combinado de contraste oral, rectal e intravenoso (IV) pueden localizarse la mayoría de las colecciones intrabdominales (incluidas las retroperitoneales), soluciones de continuidad del tubo digestivo y gas extraluminal, así como objetivar signos de isquemia intestinal. Los únicos inconvenientes son la necesidad del traslado del enfermo y la eventual nefrotoxicidad de los contrastes IV. Una TC completamente negativa indica una muy baja probabilidad de que la laparotomía detecte un foco infeccioso quirúrgicamente tratable y, por lo tanto, se puede justificar una conducta expectante. La única excepción a esta regla es que exista una fuerte sospecha clínica de isquemia intestinal. La ecografía abdominal, por el contrario, puede realizarse con un equipo portátil en la propia unidad. Es menos sensible que la TC, excepto para el estudio de la vía biliar y la demostración de ascitis. Tanto la TC como la ecografía pueden servir para dirigir la colocación de un drenaje percutáneo.39,40
Una técnica de especial consideración si se dispone del equipo y del personal adecuados es la laparoscopia en la propia UCI, que estaría indicada en enfermos en los que no se considere oportuna la realización de una TC abdominal o cuando persista la sospecha diagnóstica a pesar de la negatividad o carácter no concluyente de las pruebas de imagen.39,41,42
En enfermos con hemodinámica muy inestable puede considerarse la práctica de un lavado peritoneal diagnóstico, que consiste en la introducción de 1-2 l (20 ml/kg) de suero salino fisiológico en la cavidad abdominal a través de un catéter, e investigar en el fluído recuperado la presencia de bacterias, leucocitos, contenido intestinal, bilis o líquido hemático (este último sería sospechoso de isquemia intestinal aguda).44
En el enfermo crítico siempre es mejor la práctica de una intervención quirúrgica dirigida por una prueba de imagen que a ciegas. No obstante, cabe recordar que en ocasiones resulta evidente que el enfermo sufre una sepsis intrabdominal tributaria de intervención quirúrgica. En tales casos, la única exploración indicada es la cirugía y no la práctica de pruebas de imagen que sólo confirman un diagnóstico obvio y demoran innecesariamente la resolución del problema.45,46
Gran relevancia adquiere también el diagnóstico microbiológico. Hay que practicar dos hemocultivos a todo enfermo con infección intrabdominal, a pesar de que la tasa de positividad no supera el 25 %. La presencia en los hemocultivos de anaerobios ha de hacer sospechar siempre un foco abdominal. Debe practicarse la tinción de Gram y el cultivo de todo líquido obtenido por punción (ascitis, colección intrabdominal). En enfermos con peritonitis secundaria está indicada la práctica de un cultivo del exudado peritoneal siempre que exista riesgo de implicación de flora resistente o cuando el aislamiento de un organismo inesperado pueda justificar cambios en la actitud terapéutica.47
Se han utilizado, además, índices predictivos como complemento en el diagnóstico de la infección de la cavidad abdominal. El objetivo de los índices predictivos es predecir los resultados del tratamiento, identificar la posibilidad de infección intrabdominal temprana, sobre todo en el postoperatorio, y así elegir el tratamiento oportuno. Los predictores y escalas pronosticas de gravedad, falla orgánica y sepsis son bien conocidos, los más utilizados son APACHE II (Acute Physiology and Chronic Health Evaluation), SOFA (Sequential Organ Failure Assesment), qSOFA (quick Sequential Organ Failure Assesment), SAPS II (Simplified Acute Physiologic Score); sin embargo, están diseñados para predecir mortalidad en poblaciones de pacientes, pero no en pacientes individualmente. También existen escalas específicas para determinadas patologías, como el índice de peritonitis de Mannheim, con una sensibilidad de 95.9 % y especificidad de 80 % para predecir mortalidad en 28 días.48,49,50
Tratamiento
Los resultados en el tratamiento de la infección intrabdominal dependen de manera fundamental de tres aspectos: la gravedad de la infección, las reservas premórbidas del paciente y el compromiso fisiológico presente. La meta, por supuesto, es la recuperación del enfermo, para lo cual el tratamiento se centra en tres pilares fundamentales: tratamiento de soporte, uso de antimicrobianos y control del foco de contaminación séptico.51,52
El tratamiento de soporte tiene como objetivo mejorar las condiciones generales del paciente en el menor tiempo posible mediante una adecuada reanimación y restauración del homeostasis, reevaluando la respuesta clínica y realizando un ajuste dinámico apropiado.54,55 Se basa fundamentalmente en la presencia o no de sepsis para la aplicación de protocolos de monitorización y resucitación hemodinámica precoz y de soporte sistémico siguiendo las guías de la campaña para sobrevivir a la sepsis.47
Diversos estudios52,53 han demostrado que el tratamiento antibiótico adecua do precoz reduce la mortalidad en pacientes con sepsis y shock séptico. Esto se ha demostrado específicamente en pacientes con peritonitis co munitaria grave y en peritonitis postoperatorias, asociándose la antibiote rapia empírica inadecuada a un incremento de la estancia hospitalaria y de las complicaciones quirúrgicas. Además, se ha demostrado que la modificación del tratamiento antibiótico una vez conocido el resultado de los hemocultivos no modifica el pronóstico de estos pacientes.
La terapia con antibióticos continuada no previene el fracaso del tratamiento en pacientes con IIA complicada.37 En 2019, un ensayo clínico multicéntrico de EE. UU. (El estudio STOP-IT),54) encontró que los pacientes con peritonitis y un control adecuado de la fuente pueden tratarse con 4 días de terapia con antibióticos. Este fue un estudio bien diseñado, aunque se debe mencionar que la mayoría de los pacientes no estaban críticamente enfermos, y la extrapolación de los datos en la UCI se debe hacer con precaución.55 Las pautas actualizadas de la Surgical Infection Society53 recomiendan limitar los antimicrobianos a 96 horas en pacientes que hayan tenido la fuente adecuada.
Los datos referentes a la duración óptima de la antibioticoterapia, en las IIA complicadas en pacientes críticos en las unidades de cuidados intensivos, son deficientes. Considerando el mal pronóstico y la falta de evidencia clara disponible sobre cursos cortos de antibioticoterapia, la duración de la misma en estas infecciones graves debe ser individualizada acorde a la evolución clínica de los pacientes críticamente enfermos.54,55
A principios del siglo XX la mortalidad general de la sepsis intrabdominal era de un 90 %, lo cual disminuyó de forma considerable en un 50 % con la aplicación de los principios definidos por Kischner y mencionados por Yamuch GJ et al. (55 sobre eliminar la fuente de infección, remover el pus y los detritus intrabdominales. Hasta hace algún tiempo la resolución del foco séptico era el objetivo primario y primordial al enfrentar a un paciente con una sepsis quirúrgica severa. Lo que se hacía y se enseñaba era que el paciente había que operarlo a la brevedad y la cirugía debía ser lo más breve posible. Era proverbial entre los cirujanos el "tajo y la mecha" para significar llegar rápido al foco y dejar un drenaje o “es mejor mirar y ver, que esperar para ver”.3,55 Con alguna frecuencia, a veces alarmante, los pacientes fallecían en el quirófano, o salían de él con falla renal o falla multiorgánica que ocasionaba un mal desenlace. Si bien la brevedad en el tratamiento es la elección se necesita acompañarlo de medidas de soporte vital para realizar la cirugía en las mejores condiciones fisiológicas posibles.
El manejo quirúrgico de las infecciones intrabdominales se basa en: la eliminación del foco de contaminación, reducción de la contaminación de la cavidad peritoneal y tratamiento de la infección residual.4,28,55 La clave para el éxito es la cirugía oportuna que detenga el depósito de bacterias y adyuvantes proinflamatorios en la cavidad peritoneal (bilis, sangre, heces, bario, etcétera). Todas las demás medidas son de pequeña utilidad si de inicio no se logra el control de la fuente del inóculo, ya que tanto las defensas del paciente como los antibióticos serán insuficientes.27,28 Esto no es una controversia, es una realidad que debe tomarse como dogma.
En ocasiones existen fallas en la cirugía inicial, lo cual provoca persistencia o recurrencia de la infección intrabdominal, en muchas ocasiones con retraso diagnóstico. Por este motivo se acuñó el concepto de nuevas modalidades agresivas de manejo, las cuales procuran un control de la fuente de infección y un control de daños extendido.14,23,55
Dentro de estas modalidades encontramos la relaparotomía secuencial que no es más que la ejecución de operaciones secuenciales a intervalos fijos (24 - 72 h) sin relación con la situación del paciente.14 Se suspenden cuando la cavidad peritoneal está macroscópicamente limpia. Cuando la decisión de una intervención no se planifica de manera fija o programada, sino que se basa en el progreso clínico del paciente durante el curso postoperatorio inmediato se aplica el concepto de relaparotomía a demanda. Existen estudios que han comparado estas estrategias y no han obtenido resultados concluyentes en cuanto a la superioridad de una u otra.21,28,30
La relaparotomía, en cualquiera de sus modalidades, y la laparostomía son medidas terapéuticas indicadas sólo en pacientes muy seleccionados y con condiciones específicas. Por lo tanto, la decisión de reoperar es extremadamente difícil; los criterios clínicos son subjetivos. Tochie y otros,28,29,30 obtienen con frecuencia comentarios de todos los involucrados en el cuidado diario del paciente, incluido el intensivista, el consultor de enfermedades infecciosas y los radiólogos. Cuando un paciente entra en la unidad de cuidados intensivos, después de una intervención o tras un acontecimiento agudo, el cirujano que lo ingresa también entra en un medio nuevo.15,30,31
Aproximadamente el 40 % de los pacientes diagnosticados con peritonitis secundaria necesitan tratamiento en unidades de cuidados intensivos.16 Los índices de mortalidad asociados a peritonitis secundaria severa solo han decrecido ligeramente en las últimas décadas, manteniendo un rango del 20 al 60 %, manteniéndose como un importante campo de investigación.26,43
Existen muy pocos datos en la literatura sobre infecciones intrabdominales en el paciente crítico, lo que deja a los expertos en una disyuntiva: no proponer guías de manejo debido a la ausencia de evidencia o proponer guías basadas en otras por extrapolación con situaciones similares.55
Consideraciones finales
Las infecciones intrabdominales en la Unidad de Cuidados Intensivos representan un importante problema de salud. El origen de la infección y su adquisición dentro o fuera de los servicios sanitarios son factores determinantes en la gravedad del enfermo. La presencia de sepsis empeora proporcionalmente el pronóstico. El diagnóstico requiere de experticia debido a las características de estos pacientes. Aun con la disponibilidad de marcadores séricos y los equipos de imaginología modernos el índice de sospecha debe ser elevado. Los índices predictivos todavía presentan una baja especificidad. Los patógenos aislados, en ocasiones, son difíciles de erradicar y es de vital importancia el control del foco séptico para garantizar la efectividad del tratamiento de soporte y antimicrobiano. Teniendo como premisa esto último se utilizan modalidades terapéuticas agresivas que deben ser aplicadas en pacientes rigurosamente seleccionados y por médicos con experiencia. El tratamiento de estos enfermos debe ser aplicado en consonancia con la evidencia científica y su éxito depende, en gran medida, de la estrecha comunicación entre cirujanos, intensivistas e imaginólogos. A pesar del desarrollo imperante en la sociedad moderna estamos ante una problemática que mantiene índices de morbimortalidad similares durante las últimas décadas y la poca evidencia en la literatura nacional e internacional dificulta la elaboración de criterios para el manejo de esta patología en la Unidad de Cuidados Intensivos.