INTRODUCCIÓN
La medicina tradicional en la actualidad es un soporte fundamental en la prestación de servicios de salud alrededor del mundo, su finalidad es prevenir y tratar ciertas enfermedades, particularmente las crónicas.1
La OMS2,3,4) ha publicado informes sobre la resistencia antimicrobiana, pues los antibióticos han dejado de ser efectivos, causan miles de defunciones al año, cifra que podría elevarse a 10 millones para 2046, planteando un reto mundial para desarrollar nuevos antimicrobianos. En 2015 se estableció el Sistema Mundial de Vigilancia de la Resistencia a los Antimicrobianos (GLASS en inglés)5 para monitorear la resistencia y el consumo de antimicrobianos. El informe5 del año 2022 reportó que la resistencia fue principalmente por infecciones del torrente sanguíneo y tracto urinario.
Existe escasa evidencia científica del uso terapéutico de Tropaeolum tuberosum (mashua) y Ullucus tuberosus (melloco) para tratar y prevenir dolencias, sin embargo, la presencia de compuestos bioactivos en ellas respalda sus propiedades medicinales.6 La actividad biológica de estos fitoquímicos podría ayudar en el tratamiento de enfermedades;7 la mayoría de los medicamentos autorizados tienen origen natural, por lo tanto, los productos naturales siguen siendo fundamentales en el proceso de descubrimiento y desarrollo de nuevos medicamentos.8
Como son escasos los estudios que respaldan la actividad biológica de los tubérculos andinos, el objetivo de esta investigación es determinar la actividad hemoaglutinante, anticoagulante y antimicrobiana de los extractos de los tubérculos andinos Tropaeolum tuberosum (mashua) y Ullucus tuberosus (melloco).
MÉTODOS
La investigación fue experimental, in vitro; la población estuvo constituida por los tubérculos andinos inventariados en los mercados del Cantón Riobamba, Provincia de Chimborazo, Ecuador; se seleccionaron 2 especies que la medicina ancestral utiliza: Ullucus tuberosus (Melloco blanco, caramelo y rojo) y Tropaeolum tuberosum (Mashua amarillo). Los nombres científicos fueron consultados en la literatura científica publicada.9
Se tuvieron como variables: dependiente, la actividad hemoaglutinante, anticoagulante y antimicrobiana. Independiente, las especies de tubérculos andinos seleccionados; e interviniente, el lugar de producción, altitud, condiciones de cultivo y época del año.
Preparación de los tubérculos andinos para la obtención de extractos
Los tubérculos fueron lavados con agua corriente, se enjuagaron con agua destilada, se escurrieron para secarlos; luego fueron cortados con cáscara y sometidos al proceso de extracción acuosa. Para el proceso de extracción etanólica los tubérculos limpios y secos se rallaron, el material rallado fue secado en estufa a 45 °C y pulverizado con un molino eléctrico.
Métodos de extracción
Extracción en solución salina fisiológica (SSF) estéril
El material utilizado fue esterilizado en autoclave a una temperatura de 121 °C con 15 psi de presión, por 15 minutos; 50 g de cada tubérculo fue licuado con 20 mL de SSF estéril, colocado en envases de plástico con tapa de rosca e incubado a 4 °C por 24 horas, para extraer lectinas por infusión en frío.10 La mezcla fue filtrada y centrifugada a 6000 r.p.m. por 15 minutos; el sobrenadante fue colectado en tubos plásticos cónicos con tapa y congelado a -20 °C.
Extracción por maceración con etanol al 96 %
De cada especie, 25 g fueron deshidratados y pulverizados en un molino eléctrico de cuchilla y colocados en frascos de vidrio con tapa hermética. Se les adicionó 100 mL de etanol al 96 %; la mezcla fue agitada cada 24 h por 7 días y filtrada utilizando papel filtro Whatman No. 40. El filtrado colocado en un matraz de destilación se evaporó a una presión de vacío de 113 mbar con baño de maría a 60 °C. Evaporado el solvente, el extracto fue recuperado adicionando 5 mL de dimetilsulfóxido (DMSO) al 99,99 %, alícuotas de 1 mL en tubos Eppendorf se prepararon y conservaron a 4 °C. (11
Actividad hemoaglutinante
Preparación de las suspensiones de eritrocitos nativos
Cinco (5) mL de sangre A, B y O obtenida de 3 donantes voluntarios sanos, 2 mujeres y 1 hombre, mayores de edad, que otorgaron su consentimiento informado. Fueron diluidos cada uno con 10 mL de SSF estéril y centrifugadas a 4000 r.p.m. por 5 minutos, el sobrenadante fue descartado, el procedimiento repetido 3 veces para eliminar interferentes. Luego, 1 mL de cada paquete de eritrocitos lavados fue diluido con 19 mL de SSF, para obtener una suspensión de eritrocitos, aproximadamente, al 5 %.10
Evaluación de la actividad hemoaglutinante
De cada extracto acuoso 0,1 mL y 0,1 mL de cada suspensión de eritrocitos al 5 %, se mezclaron en tubos de ensayo, se incubaron a temperatura ambiente por 30 minutos y luego centrifugados a 4000 r.p.m. por 1 min, el grado de aglutinación fue registrado de acuerdo con el esquema propuesto por Boorman y otros:12 (4+)= muy fuerte aglutinación; (3+)= fuerte aglutinación; (2+)= moderada aglutinación; (1+)= débil aglutinación; (½+)= muy débil aglutinación; (0+)= suspensión de eritrocitos no aglutinado y (H) hemólisis.12
Títulos de hemoaglutinación
Se estimó mediante una dilución doble seriada con SSF estéril de cada extracto acuoso, con un volumen final de 0,1 mL en cada tubo a los que se agregó 0,1 mL de eritrocito de cada grupo sanguíneo respectivamente, siguiendo el procedimiento descrito para la hemoaglutinación, el título correspondió a la última dilución en la cual se detectó aglutinación.
Actividad anticoagulante
Preparación del pool de plasma citratado
El plasma humano citratado de 5 donantes voluntarios sanos, 3 mujeres y 2 hombres mayores de edad, que otorgaron su consentimiento informado, se mezcló un pool de plasma y alícuotas de 1 mL en tubos Eppendorf conservados a -20 °C.
Tiempo de protrombina (TP) de la mezcla plasma citratado y extractos acuosos
El TP, estimado según instrucciones técnicas del fabricante Pacific Hemostasis® y del Instituto de Normas Clínicas y de Laboratorio (CLSI), (13 utilizando el reactivo Tromboplastina D. Con la finalidad de corregir el efecto dilución se mezcló 100 µL del pool de plasma citratado, con 100 µL de SSF, el valor del TP obtenido aplicando la técnica, se tomó como referencia, la prueba se realizó por triplicado.
Tiempo de tromboplastina parcial activado (TTPa) de la mezcla del plasma
citratado y los extractos acuosos
El TTPa, estimado según instrucciones técnicas del fabricante Pacific Hemostasis® y del Instituto de Normas Clínicas y de Laboratorio (CLSI),13 utilizaron el reactivo ATTP-XL-ácido elágico y el cloruro de Calcio (CaCl2) 0,02 M. Con la finalidad de corregir el efecto dilución se mezcló 100 µL del pool de plasma citratado, con 100 µL de SSF, el valor del TTPa obtenido y aplicaron la técnica, se tomó como referencia, la prueba se realizó por triplicado.
Actividad antimicrobiana
Método de difusión en agar para la actividad antimicrobiana
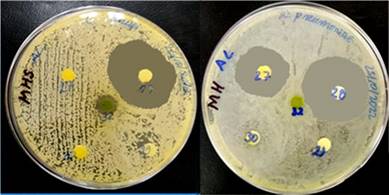
Aplicando la técnica de Kirby Bauer14) y del CLSI,15 se evaluó la actividad antimicrobiana contra cepas ATCC bacterianas grampositivas (Enterococcus faecalis 29212 y Staphylococcus aureus 25923, gramnegativas (Escherichia coli 25922, Klebsiella pneumoniae 70063 y Proteus mirabilis 25933) y micóticas del género Candida (C. albicans 1023, C. tropicalis 66029, C. krusei 14243 y C. glabrata 4843). Se prepararon inóculos bacterianos a 1,5 x 108 UFC/mL con el patrón de turbidez 0,5 de McFarland e inóculos micóticos a 3,0 x 108 UFC/mL con el patrón de turbidez 1,0 de McFarland,11) inoculando placas de Petri con agar Müeller Hinton y agar Sabouraud Dextrosa azul de metileno respectivamente, discos estériles de 6 mm de diámetro y 2 mm de grosor impregnados con los extractos acuosos y etanólicos y discos estériles con antibióticos, antimicóticos y con SSF estéril como controles que fueron colocados equidistantemente en las placas, que se incubaron a 37 ºC por 24 horas para las bacterias y 48 horas para las levaduras, los halos de inhibición del crecimiento microbiano se midió con un escalímetro bajo lupa en milímetros.
Análisis estadístico
Este análisis de varianza y comparación de media utilizando el método de Tukey (95 % de confianza) se realizó mediante el software estadístico Minitab® de MiniTab Inc. PA, EE. UU. para evaluar las diferencias significativas en el estudio de la actividad antimicrobiana; para ello se realizaron comparaciones entre los valores de la media aritmética de los halos de inhibición del crecimiento microbiano, obtenidos por la acción de los diferentes extracto y los valores de la media aritmética de los halos de inhibición del crecimiento microbiano de los controles positivos utilizados, que fueron aplicados sobre cada especie microbiana ATCC, proporcionando una evaluación detallada de la eficacia antimicrobiana de los diferentes extractos.
RESULTADOS
Actividad hemoaglutinante
Evaluación de la actividad hemoaglutinante
El extracto acuoso de T. tuberosum exhibió una fitoaglutinina capaz de aglutinar fuerte y selectivamente glóbulos rojos A (4+), mientras que U. tuberosus exhibió una fitohemolisina (H) contra los 3 grupos sanguíneos luego de 18 horas de incubación.
Título de hemoaglutinación
El extracto acuoso de Tropaeolum tuberosum (mashua) mostró aglutinación hasta la dilución 1/8, por lo tanto, el título fue de 8 valor que corresponde al inverso de la última dilución en la que hubo actividad, lo que indica una concentración baja de la fitoaglutinina.
Actividad anticoagulante
TP y TTPa del plasma citratado + el extracto de las especies de tubérculos seleccionados
El TP evidenció que Ullucus tuberosus (rojo) posee actividad procoagulante discreta al acortar el TP (20 s) con relación al valor control (23+/-1), los otros extractos no mostraron actividad. El TTPa reveló que Ullucus tuberosus (blanco, caramelo y rojo) posee actividad anticoagulante inhibiendo parcialmente la actividad de la coagulación de la vía intrínseca y común, alargando el TTPa con valores de 71, 67 y 101 s respectivamente con relación al valor control (32+/-2), en cambio Tropaeolum tuberosum inhibió totalmente la actividad de la coagulación de la vía intrínseca y común con un TTPa que superó los > 300 s.
Actividad antimicrobiana
Método de difusión en agar para la actividad antimicrobiana
El extracto acuoso de Tropaeolum tuberosum inhibió solo el crecimiento S. aureus y Klebsiella pneumoniae con halos de menor diámetro respecto del control con diferencia estadística significativa (p< 0,05). El extracto etanólico inhibió el crecimiento de todas las bacterias, contra Escherichia coli y Enterococcus faecalis con halos de mayor diámetro respecto del control con diferencia estadística significativa (p< 0,05) y halos similares al control contra Staphylococcus aureus, Klebsiella pneumoniae y Proteus mirabilis con diferencia estadística no significativa (p> 0,05).
El extracto acuoso de Ullucus tuberosus blanco y caramelo inhibieron el crecimiento de todas las bacterias con halos de menor diámetro respecto del control con diferencia estadística significativa (p< 0,05), excepto la variedad caramelo que no inhibió el crecimiento de Proteus mirabilis; los extractos etanólicos de Ullucus tuberosus inhibieron el crecimiento de todas las bacterias, con halos de mayor diámetro contra Escherichia coli y Enterococcus faecalis respecto del control y de menor diámetro en la variedad rojo contra S. aureus con diferencia estadística significativa (p< 0,05), excepto la variedad rojo que no inhibió el crecimiento de E. faecalis; además halos similares en diámetro al control con diferencia estadística no significativa (p> 0,05) contra S. aureus, K. pneumoniae y P. mirabilis (tabla 1, Fig. 1).
Tabla 1 - Resultados de la actividad antibacteriana con la medición de halos de inhibición de crecimiento de los extractos acuosos y etanólicos frente a bacterias ATCC
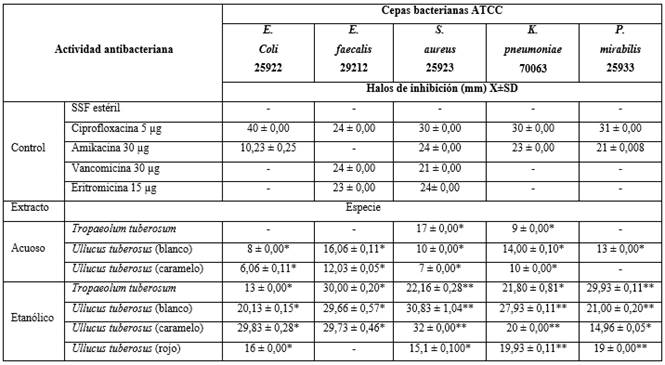
Leyenda: * p< 0,05; **p> 0,05. Valores promedio (X) de los halos de inhibición ± 1 Desviación Standard (DS) y cálculos de probabilidad que indican diferencias significativas (p< 0,05) y no significativas (p> 0,05) el análisis de varianza y comparación de media se realizó mediante el test de Tukey.
El extracto acuoso de Tropaeolum tuberosum inhibió el crecimiento de Candida albicans y Candida. tropicalis con halos de menor diámetro y diferencia estadística significativa (p< 0,05) respecto del control. El extracto acuoso de Ullucus tuberosus variedades blanco, caramelo y rojo solo inhibieron el crecimiento de C. tropicalis con halos de menor diámetro y diferencia estadística significativa (p< 0,05). Los extractos etanólicos no mostraron poseer actividad, con excepción de Ullucus tuberosus variedad blanco que inhibió el crecimiento de Candida krusei con halo de menor diámetro y una diferencia estadística significativa (p< 0,05) respecto del control (tabla 2, Fig. 1).
Tabla 2 - Resultados de la actividad antimicótica con la medición de halos de inhibición de los extractos acuosos y etanólicos frente a levaduras ATCC
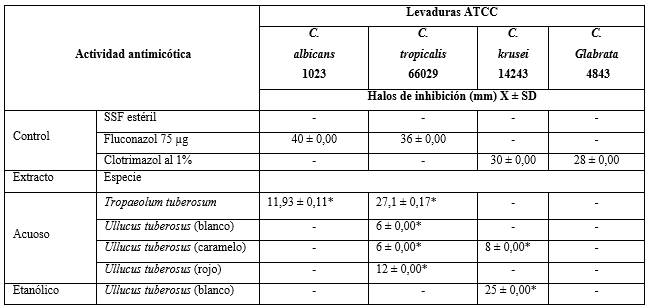
Leyenda: * p< 0,05; Valores promedio (X) de los halos de inhibición ± 1 Desviación Standard (DS) y cálculos de probabilidad que indican diferencias significativas (p< 0,05) el análisis de varianza y comparación de media se realizó mediante el test de Tukey.
DISCUSIÓN
La actividad hemoaglutinante evidenció que Tropaeolum tuberosum aglutinó únicamente eritrocitos A, entonces posee una lectina específica que se une a N-acetil-galactosamina (GalNAc), lo cual difiere con lo reportado por Aguas y otros,16 en el 2019, que no la evidencian. Ullucus tuberosus no mostró actividad hemolizante, lo cual difiere de lo reportado por Silva y otros17 que reportan actividad hemoaglutinante, discrepancias debidas probablemente a variables intervinientes, por otra parte, fue reportada una débil actividad específica para eritrocitos A en la variedad roja, actividad hemolizante en la caramelo y ninguna en la amarilla.18 Esta actividad ratifica el estudio de Cheung y otros19 en 2018, que destacan el potencial de los compuestos bioactivos para investigaciones biomédicas.
El TP no evidenció actividad en los extractos de ambos tubérculos, lo cual difiere con Djabayan y otros18 que reportan actividad anticoagulante discreta de la vía extrínseca. El TTPa reveló actividad anticoagulante parcial en Ullucus tuberosus y total en Tropaeolum tuberosum (TTPa> 300 s) , lo que coincide con Chang y otros,20 quienes reportan la misma actividad en el tubérculo Corydalis ambigua. Mientras que Djabayan y otros18 informaron actividad procoagulante por acortamiento del TTPa, discrepancia que requiere ser resuelta con un estudio comparativo.
La actividad antibacteriana en extractos acuosos reveló inhibición del crecimiento de S. aureus y K. pneumoniae en Tropaeolum tuberosum y diferencias estadísticas significativas. En cambio, Ullucus tuberosus variedad blanco y caramelo inhibieron a todas las bacterias estudiadas excepto variedad caramelo que no inhibió a P. mirabilis, lo que coincide con Djabayan y otros,18Mejía y otros,21 y Silva y otros.17 Los extractos etanólicos de ambas especies inhibieron el crecimiento de las bacterias estudiadas, con diferencia estadística significativa en Tropaeolum tuberosum, resalta la inhibición de E. coli y E. faecalis con un halo mayor que Amikacina y de S. aureus, K. pneumoniae y P. mirabilis con estadística no significativa pero halos de inhibición muy similares a los antibióticos control que ratifican la presencia de un metabolito de amplio espectro, que requiere ser identificado mediante estudios fitoquímicos.
Los extractos etanólicos de Ullucus tuberosus inhibieron el crecimiento de todas las bacterias utilizadas la mayoría con diferencia estadística significativa, excepto U. tuberosus (rojo) que no mostró actividad contra E. faecalis, resalta U. tuberosus (blanco y caramelo) que inhibieron a E. faecalis, S. aureus, K. pneumoniae y P. mirabilis con diferencia estadística no significativa y halos de inhibición similares e incluso mayores a los antibióticos controles.
La actividad antimicótica de los extractos acuosos de T. tuberosum y U. tuberosus reveló actividad con diferencia estadística significativa atribuible a una lectina, ya que los extractos etanólicos de ambas especies no mostraron esta actividad, dado que los solventes orgánicos desnaturalizan a las lectinas, excepto en U. tuberosus (blanco) que inhibió el crecimiento de C. krusei, lo que no ocurrió con el extracto acuoso, tal vez por encontrarse en una concentración baja.
En este sentido, se coincide en afirmar que la actividad antimicrobiana de especies vegetales son una alternativa para obtener biofármacos;22,23 por ejemplo, la actividad de T. tuberosum (mashua) puede deberse al contenido de isotiocianatos, que poseen efectos antibacterianos y antifúngicos importantes.24,25,26
Se concluye que: T. tuberosum posee actividad hemoaglutinante específica contra eritrocitos humanos A y U. tuberosus posee actividad hemolítica contra los grupos sanguíneos; hay actividad anticoagulante contra las proteínas plasmáticas de la coagulación de la vía intrínseca y común en T. tuberosum; hay actividad antibacteriana in vitro en los extractos acuosos y etanólicos, pero mayor en los extractos etanólicos y actividad antimicótica en todos los extractos acuosos frente a diferentes especies del género Candida.