INTRODUCCIÓN
Aedes aegypti (L) (Diptera: Culicidae), es una especie cosmopolita y vector de enfermedades como la fiebre amarilla, el dengue, Chikungunya y otras arbovirosis,1,2 situación que ha obligado a las autoridades gubernamentales a realizar estrategias para su control.3 Su plasticidad ecológica le ha permitido reproducirse de manera exitosa en el medio urbano,4 ya que la ovoposición de las hembras ocurre tanto en reservorios naturales como artificiales; sus estadios larvales se desarrollan generalmente en aguas dulces,5) sin embargo, pueden llegar a sobrevivir en aguas salobres.6
Las variaciones de la temperatura del agua en la que se desarrollan las larvas de mosquitos influyen en su sobrevivencia.7 Es así que el desarrollo de Ae. aegypti, se reduce cuando la temperatura del agua disminuye o aumenta debido al intervalo óptimo fisiológico, que oscila entre los 16 a 35 °C.8
Los factores abióticos ambientales han repercutido en un incremento de la intensidad y distribución del dengue en el mundo. (9 El conocimiento del efecto de la temperatura sobre la tasa de desarrollo y supervivencia de los mosquitos, es un factor esencial para elaborar estrategias adecuadas para su control.10
También, la salinidad del agua es una variable que interviene en el éxito de la supervivencia de estadios inmaduros de mosquitos. Bajo estas circunstancias, las larvas de diversas especies son tolerantes a diferentes concentraciones salinas, incluyendo diversas especies del género Aedes.11,12
En el estadio de pupa, la tolerancia al agua salobre se logra por la presencia de una cutícula menos permeable que posee capas gruesas esclerotizadas impermeables a los iones.5 En condiciones naturales y controladas, los estadios inmaduros pueden sobrevivir dentro de intervalos de 16 a 17 ups (unidades prácticas de salinidad).13 En cuanto a las larvas de Ae. aegypti, estas se han detectado sobreviviendo y cerrando su ciclo de vida dentro de pozos domésticos con aguas salobres entre 2 y 9 ups.14)
Así, en virtud de que las variables ambientales pueden definir las estrategias de control y eliminación de las poblaciones locales de Ae. Aegypti, este estudio tiene el objetivo de evaluar el efecto de diferentes temperaturas y salinidades en la eclosión de huevos y la supervivencia de larvas, pupas y adultos bajo condiciones de laboratorio.
MÉTODOS
El estudio se realizó en las instalaciones del Laboratorio de Calidad de Agua y Acuicultura Experimental (LACUIC) del Centro Universitario de la Costa de la Universidad de Guadalajara (CUCOSTA), Puerto Vallarta, Jalisco, México, localizado entre los 20° 422´ 192.2´´ N y 105° 132´ 162.2´´ O.
Obtención de material biológico
Estadios larvales (III y IV) de Ae. aegypti se obtuvieron de dos reservorios (charcas) temporales (de mayo a octubre de 2017), ubicadas en la localidad de Ixtapa, municipio de Puerto Vallarta, Jalisco. Las características físico-químicas del agua en dichos reservorios fueron (promedio de siete registros llevados a cabo a las 12:00, en un periodo de 30 días): temperatura 29 ± 2 °C; oxígeno 2,1 ± 1 mg/L; pH, 7,8 ± 1,2; salinidad 0,3 ups. Las larvas se colectaron con pipetas de transferencia Pasteur de 1 mL, se trasladaron al laboratorio y se identificaron utilizando claves morfológicas de acuerdo con Ibáñez-Bernal y Martínez-Campos, Darsie y Ward, así como Carpenter y La Casse.15,16,17
Posteriormente, se transfirieron a dos jaulas entomológicas de 40 x 37 x 70 cm, para su desarrollo somático hasta alcanzar la etapa adulta. Los adultos se alimentaron con una solución de miel de abeja (dilución 1:1 con agua potable) y recurso hematofágico (sangre humana) por exposición cutánea, durante periodos de 15 min cada 24 h, durante 10 días.18)
Para la ovoposición de las hembras se utilizaron recipientes plásticos PET de 400 mL rellenos con agua potable de la red hidráulica. Dentro de cada recipiente se colocaron paletas de madera como superficies de puesta de huevos. Las paletas de madera se retiraron de los recipientes al detectar huevos adheridos y se transfirieron en un área seca con temperatura ambiente no regulada hasta su utilización.
Evaluación de diferentes temperaturas sobre la eclosión
Se evaluaron ocho temperaturas: 15, 17, 20, 25, 27, 30, 32 y 35 °C, así como un tratamiento control a temperatura ambiente (24 ± 2 °C).
El diseño experimental para cada temperatura consistió en seis unidades experimentales (UE) de material plástico transparente PET de 1 L de capacidad. Las UE fueron alojadas en acuarios de 40 L aforados a 20 L con agua corriente. La temperatura del agua se controló con calentadores con termostato a 20, 25, 27, 30 y 32 °C. Una vez ajustada la temperatura de los acuarios con los valores de experimentación, se introdujeron las UE aforadas a 500 mL hasta que la temperatura de cada una se igualara con la del acuario correspondiente. Para ajustar la temperatura de uno de los tratamientos a 35 °C, se utilizó una incubadora Thermo® en la que se introdujeron directamente las UE, mantenidas a 35° C; el fotoperiodo se ajustó a 12:12 (luz:oscuridad). Para los experimentos con temperaturas de 15 y 17 °C, se utilizó el mismo sistema de acuario con el agua enfriada con ayuda de un enfriador o “Chiller” marca Resun®.
En cada UE para las diferentes temperaturas, se colocaron 15 huevecillos (n= 90 en total para todos los tratamientos). La eclosión de los huevos ocurrió y se registró en un período de 12 a 96 h. Durante el transcurso del experimento se midió diariamente la temperatura del agua y la concentración de oxígeno disuelto. La temperatura ambiental en el laboratorio se mantuvo alrededor de los 24,7 ± 2,0 °C, la humedad relativa cerca del 58.9 % y el fotoperiodo proporcionado fue de 12:12 h (luz:oscuridad).
Evaluación de diferentes salinidades sobre la eclosión y supervivencia
Se evaluaron siete concentraciones salinas: 0,3; 2; 5; 10; 15; 18 y 22 ups, obtenidas al mezclar en diferentes proporciones agua marina con agua dulce declorada y verificadas con un conductímetro YSI 556 MPS®. Las UE fueron las mismas que se usaron en el experimento de temperatura, solo que aforadas a 900 mL y con 100 huevecillos por tratamiento y por triplicado. La eclosión se registró a las 1, 5, 24, 72, 96 h, de iniciado el experimento. La temperatura ambiental del laboratorio registró una temperatura de 24,5 ± 2,0 °C, humedad relativa de 61 % y se proporcionó un fotoperiodo de 12:12 h (luz:oscuridad).
Evaluación de diferentes salinidades sobre la supervivencia de larvas de Ae. aegypti del estadio IV
Se evaluaron las siete concentraciones salinas y UE del experimento anterior, solo que estas últimas aforadas a 900 mL. En cada una se colocaron 50 larvas por quintuplicado. La supervivencia se registró a la 1, 5, 24 y 48 h de iniciado el ensayo. Las condiciones ambientales del laboratorio se mantuvieron en 25 ± 2 °C, 61 % de humedad relativa, así como un fotoperiodo de 12:12 h (luz:oscuridad). Las larvas muertas tornaron a un color blanco opaco y no presentaban movimiento.
Efecto de la salinidad sobre el éxito de supervivencia del estadio imago de Ae. aegypti
Se experimentó con las mismas siete concentraciones salinas del ensayo anterior. Los huevecillos (n= 500) se colocaron en las UE aforadas a 900 mL. La eclosión se registró a las 1, 5, 24 y 48 h de iniciado el experimento. El laboratorio se mantuvo a una temperatura de 24 ± 1 °C y 64,8 % de humedad relativa. Dentro de las UE el promedio de temperatura del agua fue de 23,68 ± 1,0 oC. Se contaron los días transcurridos hasta estadio de pupa de las larvas y hasta que lograron el estadio adulto. De estas, se calculó la proporción sexual.
Efecto de la salinidad sobre la ovoposición y eclosión de Ae. aegypti
La puesta de huevecillos se evaluó cada 24 h, por cada una de las salinidades en las mismas concentraciones salinas de los experimentos anteriores. Se utilizaron 40 hembras y 10 machos que se colocaron en la jaula entomológica ya descrita. Dentro de ella se colocaron las UE aforadas a 300 mL con agua ajustada y las siete salinidades por triplicado. La puesta de huevecillos se midió cada 24 h por 4 días. Concluida esta fase, los huevecillos se extrajeron para registrar su tiempo de eclosión en un periodo de 48 h. Este mismo procedimiento se repitió para todas las salinidades. Los huevecillos no eclosionados se transfirieron a agua dulce para evaluar nuevamente su eclosión por un periodo de 48 h. Las condiciones ambientales del laboratorio se mantuvieron en 26 ± 1 °C, 70 % de humedad relativa, con un fotoperiodo de 12:12 h (luz:oscuridad).
Análisis estadístico
Solo para los experimentos de salinidad se aplicaron análisis estadísticos. Para evaluar el efecto de diferentes salinidades sobre la supervivencia de larvas del estadio IV, se aplicó un análisis de varianza de una vía (ANOVA), con una significancia de α= 0,05 previas pruebas normalidad test de Shapiro- Wilk (α= 0,05) y homocedasticidad de los datos (Barlett; α= 0,05).
Se aplicó la prueba de Kruskal-Wallis (p =0,05), a los datos de número de huevecillos eclosionados y número de larvas muertas; posteriormente se realizó una prueba de comparaciones múltiples, Tukey (Duun; p= 0,05), para conocer si había diferencias entre las cuatro salinidades (0,3; 2; 5 y 10 ups) sobre la proporción sexual.
Se aplicó una prueba de Kruskal-Wallis (p= 0,05), para analizar los datos de número de huevecillos ovopositados y número de huevecillos eclosionados en relación con las diferentes salinidades. Todos los análisis estadísticos se realizaron con la ayuda del programa Sigma Plot 11.0. (Exact Graphs and Data Análisis®).
RESULTADOS
En las ocho temperaturas probadas se observó solo la eclosión; se registró la supervivencia de estadios larvales en las primeras 24 h, de las temperaturas de 17 a 32 °C. La temperatura mínima (15 °C), favoreció el 100 % de eclosión entre las 24 y 48 h. La temperatura de 35 °C no registró eclosión en las 96 h de duración del experimento.
En el estudio del efecto diferentes salinidades sobre la sobrevivencia de larvas del estadio IV, se registró el 100 % de la supervivencia a las salinidades menores (0,3 a 10 ups), el 40 % a 15 ups y el 100 % de mortalidad a las salinidades de 18 y 22 ups. Solo se encontraron diferencias significativas (p˂ 0,05) en 15,18 y 22 ups.
En la tabla 1 se observa que todas las concentraciones salinas evaluadas registraron el 100 % de eclosión en las primeras 24 h. Las concentraciones más bajas (0 a 10 ups) registraron el 100 % de supervivencia a las 48 h; las salinidades más altas llegaron al 100 % de mortalidad a las 48 h posteriores a su eclosión. La concentración de 15 ups ejerció el 50 % de mortalidad después de 48 h.
Tabla 1 Efecto de concentraciones salinas sobre la eclosión y mortalidad de larvas de Aedes aegypti
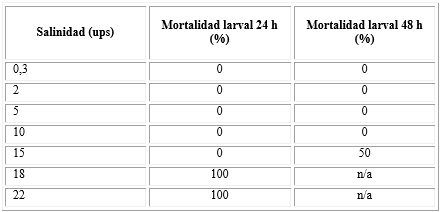
n/a: no aplica. B La eclosión fue del 100 % en todas las concentraciones evaluadas. Solo se encontraron diferencias significativas en la concentración de 15 ups (p<0.05).
En todas las concentraciones evaluadas se obtuvo el 100 % de eclosión. La figura muestra que el mayor porcentaje de supervivencia hasta el estadio adulto se obtuvo en las salinidades bajas 0,3 ups (92 %); 2 ups (93 %); 5 ups (80 %); 10 ups (73 %).
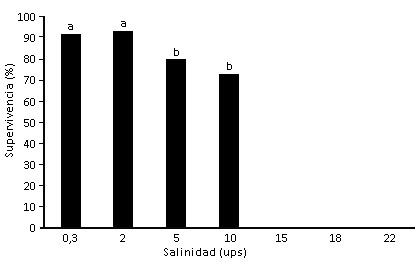 Letras diferentes indican diferencias significativas (p<0.05).
Letras diferentes indican diferencias significativas (p<0.05).Fig Supervivencia de estadios larvales hasta la fase de adulto de Ae. aegypti bajo diferentes salinidades.
El estadio de pupa lo alcanzaron al séptimo día (95 % del total de larvas) y el estadio adulto lo alcanzaron al décimo (90 % del total de larvas). Las salinidades de 22, 18 y 15 ups provocaron mortalidad total de las larvas. No se encontraron diferencias significativas (p˃ 0,05) entre los tratamientos de 0,3; 2; 5 y 10 ups.
La proporción sexual de hembras y machos no fue significativa (relación 1:1) en las salinidades de 0,3; 2 y 10 ups. Solo en la salinidad de 5 ups hubo diferencias estadísticas (p˂ 0,05) al encontrarse 2:1 hembras y machos.
Los resultados de la ovoposición a diferentes salinidades se muestran en la tabla 2. En todas las salinidades evaluadas (0,3-22 ups) se registró ovoposición. La eclosión solo se llevó a cabo en las salinidades bajas (0,3; 2; 5 y 10 ups) a partir de las 12 a 24 h, posteriores a la puesta. En las salinidades mayores (15, 18 y 22 ups) no se registró eclosión posterior a 72 h. Cuando los huevecillos no eclosionados, de las salinidades de 15, 18 y 22 ups, fueron transferidos a agua dulce, eclosionaron entre las 24 y 48 h. No hubo diferencias (p˃ 0,192) entre los tratamientos de las seis salinidades sobre la eclosión, considerando las eclosiones de los huevecillos no eclosionados una vez transferidos al agua dulce.
Tabla 2 Ovoposición de hembras de Ae. aegypti y porcentaje de eclosión bajo diferentes salinidades, después de transferencia al agua dulce
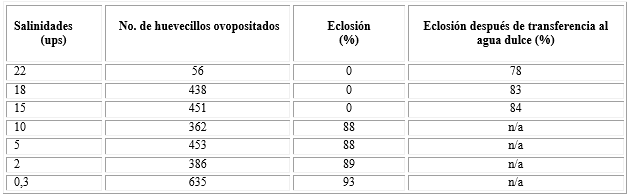
No hubo diferencias significativas (p˃ 0,192) entre los tratamientos de las seis salinidades sobre la eclosión, considerando las eclosiones de los huevecillos no eclosionados una vez transferidos al agua dulce.
DISCUSIÓN
El presente estudio demuestra que las cepas locales de Ae aegypti pueden eclosionar y sobrevivir en un rango de temperatura entre 15 y 32 °C en condiciones de laboratorio. Lo anterior contribuye a su gran plasticidad ecológica.4 Se ha demostrado que la temperatura ambiental influye la reproducción y desarrollo larval de poblaciónes de Ae. aegypti en la naturaleza. Estudios de campo relacionan el efecto de la temperatura sobre la abundancia de esta especie.19,20
Aunque no fue el objetivo del presente trabajo y no se evaluó la supervivencia larvaria sino solo la eclosión, diversos autores han estudiado el amplio rango térmico en el que larvas de diferentes especies de mosquitos, pueden desarrollarse y sobrevivir.21,22,23)
En el caso del género Aedes se ha demostrado que la eclosión se puede dar desde temperaturas de 12 °C hasta relativamente altas de 38 °C.24,25,26,27 La supervivencia larvaria también puede fluctuar de manera importante de acuerdo con las temperaturas. De manera general temperaturas bajas ocasionan una supervivencia menor, sin embargo, no ocasionan mortalidades totales en inmaduros ya que pueden soportar temperaturas de 13 °C.28
En relación con las concentraciones salinas en el presente estudio se registró eclosión del 100 % de los huevecillos desde 0,3 a 22 ups, pudiendo las larvas mantenerse vivas en un 100 % hasta una salinidad de 10 ups, y de 50 % en 15 ups. Otros estudios también muestran la capacidad de las larvas del género Aedes para sobrevivir en condiciones salobres similares.29,30,31,32) Este comportamiento es favorecido por estrategias fisiológicas presentes en el género Aedes para soportar diferentes salinidades que conservan sus capacidades reproductivas incluyendo la posibilidad de regular la presión osmótica de su hemolinfa y adecuarla a la presión osmótica ambiental, y eliminar el exceso de iones a través del sistema excretor.11 Otras especies de mosquitos han evolucionado el segmento rectal secretor de sal, lo cual permite que toleren diversos rangos de salinidad.12
En el caso de la región de la costa del Pacífico mexicano, los esteros son ecosistemas usuales y, bajo los resultados obtenidos, se sugieren como hábitats alternativos para poblaciones de Ae. aegypti donde pueden completar su ciclo biológico, encontrando que las salinidades fluctúan de los 3-7 ups. En el caso particular de Puerto Vallarta (ciudad en la que se llevó a cabo este estudio), la presencia de esteros (estero El Salado y estero Boca Negra) dentro de la mancha urbana pueden beneficiar la generación y dispersión de poblaciones importantes de mosquitos. En estudios previos en los que se ha llevado a cabo la colecta de larvas por ovitrampas en diferentes zonas urbanas y suburbanas, se ha demostrado que, en las comunidades aledañas y cercanas a los esteros antes mencionados, el número de larvas de Ae. aegypti y otras especies de culícidos es mayor que en zonas alejadas de estas (resultados no publicados). Las salinidades de estos cuerpos de agua pueden fluctuar en el transcurso del año debido tanto a los regímenes de mareas como de la estación lluviosa. La probabilidad de supervivencia de las larvas se incrementa con la disminución de la salinidad del agua, evento que es usual en este tipo de ecosistemas.5
Tal hecho queda constatado con los resultados en los cuales los huevecillos en las salinidades mayores probadas no llegaron a eclosionar; sin embargo, cuando estos mismos fueron transferidos a agua dulce se completó el proceso, lo que evidencia su resistencia ante condiciones adversas.
Los ciclos reproductivos naturales y la distribución del género Aedes han sido influenciados por el aumento global de la temperatura.33 En las zonas tropicales y no tropicales se han acentuado los casos de enfermedades transmitidas por estos vectores.34,35 Incluso en las temporadas y zonas consideradas como poco aptas para el desarrollo de estos insectos se registran casos de enfermedades como el dengue.(7 Si bien existen estrategias que ayudan a controlar la reproducción y diseminación de las poblaciones de mosquitos (sobre todo prevención para la eliminación de reservorios de agua domésticos y uso de larvicida), el control de las poblaciones suburbanas y silvestres se torna más complicado. Con base en los resultados de este estudio, la eliminación de cuerpos costeros de agua natural, salobre o dulce (lagunas costeras y esteros) podría pensarse como la estrategia obvia; sin embargo, su viabilidad es nula, ya que representan ecosistemas muy importantes para el equilibrio ecológico de las zonas en los que se encuentran.
Los resultados en el presente estudio demuestran que las cepas locales de Ae. aegypti tienen la capacidad de reproducirse, eclosionar y sobrevivir bajo diversas condiciones ambientales de temperatura y salinidad del agua.
Las condiciones de laboratorio establecidas en el presente estudio son similares a aquellas registradas en campo bajo las condiciones de una zona tropical, altas temperaturas del agua en mayo, temporada de verano, y relativamente bajas en los meses de invierno. Bajo el escenario actual de la región en la que se realizó el estudio, altas temperaturas y alta pluviosidad, una de las pocas soluciones concretas es (además de continuar con los programas activos de eliminación de reservorios de agua domésticos, larvicidas y adulticidas) el uso de controladores biológicos,36 es el uso de repelentes para evitar las picaduras de mosquitos vectores.37) Nuestras investigaciones actuales van en ese sentido.














