Introducción
La diabetes mellitus tipo 2 constituye una enfermedad cardiovascular de origen metabólico, caracterizada por la hiperglucemia que, como factor bioquímico predominante, debido al déficit de insulina, provoca la resistencia a esta hormona en los tejidos periféricos. El exceso de nutrientes induce la hiperestimulación y causa la disfunción de las células β pancreáticas.1
La diabetes mellitus se relaciona con un estado de hipercoagulabilidad y la formación de trampas extracelulares de neutrófilos en la sangre; estos se relacionan con un estado inflamatorio y protrombótico, especialmente hipofibrinólisis.2 La hiperglucemia crónica aumenta la producción de radicales libres del oxígeno y el nitrógeno. Estos dislocan la proliferación de neutrófilos y linfocitos, aumentan la actividad de la mieloperoxidasa (MPO) y el proceso de apoptosis celular.3
La ceruloplasmina (CP) EC 1.16.3.1 es una glicoproteína, perteneciente a la familia de las oxidasas multicobre (oxidan sus sustratos al aceptar electrones en los centros de cobre con la reducción concomitante del oxígeno y la producción de dos moléculas de agua). Tiene alta especificidad por el hierro, con una elevada actividad ferroxidasa, que disminuye la toxicidad del ion ferroso en los tejidos y se expresa, fundamentalmente, en los hepatocitos y macrófagos, con un peso molecular de 132 KDa.4 Constituye una proteína de fase aguda, que actúa como agente antiinflamatorio, al reducir la cantidad de polimorfonucleares adheridos al endotelio, y se considera un eliminador extracelular de superóxido.5) El incremento de la tirosina nitrada y la cisteína oxidada mitigan la actividad ferroxidasa de la CP, la cual disminuye la sobrevida de los pacientes con insuficiencia cardíaca.6
La MPO EC 1.11.1.7 pertenece a la familia de las peroxidasas y contiene el grupo prostético hemo. Se produce principalmente en los neutrófilos polimorfonucleares, con un peso molecular de 150 KDa; se libera al líquido extracelular después del estrés oxidativo y en respuesta a la inflamación. Constituye el único tipo de peroxidasa que usa H2O2 para oxidar haluros y pseudohaluros, y formar diferentes ácidos hipohalosos. La liberación controlada de MPO en el sitio de infección destruye los microorganismos; en cambio, si se descuida ocasiona inflamación y daño tisular. La artritis reumatoide, la diabetes, el cáncer, las enfermedades cardiovasculares y hepáticas se vinculan con los oxidantes derivados de la actividad de la MPO,7) cuyo incremento conecta la respuesta inflamatoria con el estrés oxidativo en el síndrome metabólico.8
Las lipoproteínas de baja densidad se modifican por el ácido hipocloroso y el ácido hipotiocianoso, producidos por la MPO, y favorecen la inflamación y la disfunción endotelial; además, disminuyen la producción de óxido nítrico e inducen la pérdida de la actividad de la óxido nítrico sintasa endotelial.9
Los oxidantes de la MPO desarrollan cambios endoteliales y complicaciones cardiovasculares en la insuficiencia renal;10,11 además, contribuyen a la formación de células espumosas, la apoptosis y la activación de metaloproteinasas en la matriz, que pueden desestabilizar las placas ateroscleróticas.12
La CP constituye el inhibidor fisiológico endógeno de la MPO y protege a la célula de los oxidantes de esta enzima durante la inflamación.13 La concentración de la MPO y la actividad de la CP séricas se incrementaron en pacientes con enfermedad coronaria crónica14 y con insuficiencia cardíaca,15 cuando se compararon con los sujetos sanos.
A pesar de la interacción en el plasma de la CP y de la MPO en pacientes diabéticos tipo 2 nunca se ha realizado una evaluación paralela de estas enzimas; por ello, el objetivo del presente trabajo fue evaluar la relación entre la CP y la MPO, determinadas simultáneamente en el suero de pacientes diabéticos tipo 2.
Métodos
Se realizó una investigación descriptiva transversal. Se estudiaron los diabéticos tipo 2 que asistieron a la Casa de Atención al Diabético de Santa Clara, Villa Clara, durante marzo de 2019 y marzo de 2020. Mediante muestreo intencional se incluyeron 362 pacientes y conformaron el grupo control 110 sujetos sanos, donantes del Banco de sangre de Santa Clara.
Este trabajo se diseñó teniendo en cuenta las normas éticas para la investigación científica en muestras de origen humano. El proyecto y el consentimiento informado para el estudio se aprobaron por el Comité de Ética de la Unidad de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara. La caracterización de los casos incluidos en el estudio se obtuvo de las historias clínicas del centro asistencial.
Las variables de respuestas fueron las siguientes:
Actividad de las enzimas MPO y CP en el suero de los pacientes diabéticos.
Cociente de la actividad de la MPO y la CP ( R MPO/CP).
Concentración de proteínas totales, glucosa, colesterol, triglicéridos y creatinina en suero.
Índice de masa corporal (IMC) y circunferencia de la cintura.
Las variables de respuesta se declararon baja, normal o alta, a partir de la comparación con los valores establecidos; a excepción de las actividades enzimáticas cotejadas con los totales del grupo control. Los complementarios se hicieron según el protocolo establecido en la institución. Las muestras se extrajeron por venopunción, a los pacientes en ayunas, el primer día del ingreso, y se procesaron en el laboratorio de bioquímica de la Unidad de Investigaciones Biomédicas. Se mantuvieron a temperatura ambiente hasta la liberación del suero, se centrifugaron a 2,500 rpm durante 10 minutos en una centrífuga refrigerada Minor ´S´ a 4 oC y se recolectó 1 ml de suero en microtubos de 1,5 ml. Este se almacenó a -70 °C hasta su análisis, que no excedió las 48 horas.
Para determinar la actividad de la CP, se empleó el método de Siotto y otros16 con pequeñas modificaciones. Se preparó el reactivo (R1) buffer acetato de sodio 0,1 M pH 5.0 y el reactivo (R2) dihidrocloruro de o-dianisidina 7,8 mmol/L. La solución se confeccionó inmediatamente antes de su uso con una proporción de 1 ml de R2 y 4 ml de R1; se obtuvo una concentración final de o-dianisidina de 5 mg/ml. La reacción inició al añadir 150 µL del suero a 2850 µL de la solución de trabajo, se midió la absorción de la luz a 460 nm frente blanco agua a los 2 y 7 minutos, en un espectrofotómetro UV-Visible T60, PG Instruments, acoplado a una computadora con el programa UV-Win5. Para expresar los datos en unidades internacionales se determinó el coeficiente de absorción molar del producto de oxidación de la o-dianisidina a 460 nm y a 25 oC, y se usó el sistema peróxido de hidrógeno/peroxidasa de rábano con las condiciones de reacción previamente descritas.
Para establecer la actividad enzimática de la MPO se empleó el método descrito por Krawisz y otros17 con pequeñas modificaciones. Se utilizó una solución de H2O2 (30 mmol/L), o-dianisidina (0,65 mmol/L) y buffer fosfato 0,05 M pH 6,0. La mezcla de reacción contenía 100 µL de suero y 2850 µL de la solución de o-dianisidina en buffer fosfato pH 6.0; la reacción inició con la adición de 50 µL de H2O2 (30 mmol/L), y se midió la absorción de la luz a 460 nm frente a blanco agua a 2, 3 y 5 minutos en el espectrofotómetro. Los datos de actividad se expresaron mediante el sistema peróxido de hidrógeno/peroxidasa de rábano, las condiciones de reacción previamente descritas y la variación de la concentración de la peroxidasa.
La cuantificación del colesterol, los triglicéridos y la glucosa se hizo por métodos enzimáticos; mientras que la creatinina y las proteínas totales por colorimétricos. Para ello se utilizaron los kits diagnósticos Helfa de la Empresa de Productos Básicos “Carlos J. Finlay” de La Habana.
Con los datos clínicos y los resultados de los exámenes de laboratorio, se elaboró una base de datos en Microsoft Excel 2010 y se analizó mediante el programa SPSS para Windows Versión 21. Se utilizaron los estadísticos de tendencia central media y el error estándar de la media. Se calcularon frecuencias absolutas y relativas. Los hallazgos se presentaron en textos y tablas. Se aplicó el test de bondad de ajuste Shapiro Wills para comprobar si los datos de la actividad enzimática cumplían la distribución normal (p ˂ 0,05). Los rangos medios se compararon a partir de la prueba no paramétrica de Mann-Whitney, y con la de Spearman se evaluó la correlación de la actividad de las enzimas en suero.
Resultados
En los 362 diabéticos predominaron el sexo femenino con 209 (57,7 %) y, según el color de la piel, los blancos con 280 (77,3 %). La edad media y el error estándar fueron de 60 ± 0,6, un 49 % de los casos superaba los 60 años. Resultaron obesos 174 pacientes y 278 tenían obesidad abdominal. El 72 % presentó hiperglucemia. Los triglicéridos y el colesterol se mostraron elevados en 157 y 102 casos, respectivamente. Solo en el 5 % de la muestra la creatinina estuvo alterada.
Las actividades de la CP y la MPO, expresadas en U/L, se incrementaron significativamente en los pacientes diabéticos, en relación con el grupo control; de forma similar ocurrió con las actividades específicas de ambas enzimas, expresadas en mU/mg proteínas. La actividad de la MPO fue mayor que la de la CP (tabla 1).
Tabla 1 Resultados de las actividades séricas de la CP y MPO en los dos grupos estudiados
| Actividades enzimáticas | Grupos | ||
|---|---|---|---|
| diabéticos n = 362 | control n = 110 | ||
| Ceruplasmina U/L media ± ES | 32,29 ± 0,77 | 26,36 ± 1,18 | 0,000 |
| Específica de la Ceruplasmina mU/mg de proteínas media ± ES | 0,45 ± 0,011 | 0,36 ± 0,017 | 0,000 |
| Actividad de la mieloperoxidasa U/L media ± ES | 1 838,93 ± 55,52 | 394,27 ± 19,36 | 0,000 |
| Actividad específica de la mieloperoxidasa mU/mg de proteínas media ± ES | 25,57 ± 0,80 | 5,42 ± 0,27 | 0,000 |
Leyenda: p nivel de significación prueba no paramétrica Mann Whitney.
El cociente RMPO/CP de los pacientes diabéticos superó cuatro veces al del grupo control, o sea, se determinó un contraste relevante entre ambos grupos (tabla 2).
Tabla 2 Resultados del cociente RMPO/CP en los dos grupos estudiados
| Grupos | n | R MPO/CP media ± ES | |
|---|---|---|---|
| Diabéticos | 362 | 71,79 ± 3,57 | 0,000 |
Leyenda: p Nivel de significación prueba no paramétrica Mann Whitney
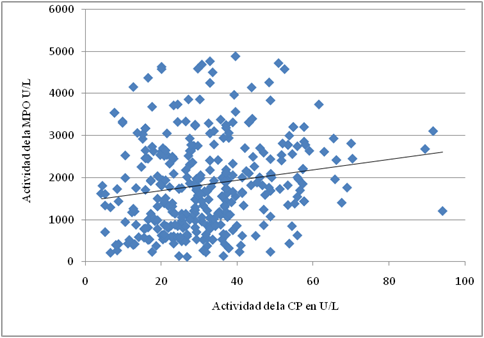
Las actividades de la MPO y la CP en los pacientes diabéticos no se interrelacionaron de manera importante, según la prueba no paramétrica de Spearman, el coeficiente de correlación entre ambas y el nivel de significación de Mann Whitney (R = 0,183 p = 0,000) (fig).
Discusión
La hiperglucemia provoca un estado de toxicidad que puede afectar el funcionamiento de las células β,1 disminuir la síntesis de insulina, e incrementar los neutrófilos en sangre, asociados a un estado inflamatorio y protrombótico.2) En los pacientes diabéticos no controlados aumentan los radicales libres del oxígeno y el nitrógeno, lo cual amplía el riesgo de enfermedades cardiovasculares6 y la enfermedad renal diabética.18 Además, la hiperglucemia crónica altera el comportamiento de las proteínas plasmáticas mediante la glicación no enzimática.19
La inflamación constituye un mediador importante en la resistencia a la insulina debido a la obesidad.20 La inflamación crónica de bajo grado y la resistencia a la insulina, asociada a anomalías metabólicas, se han propuesto como el "suelo común" para la diabetes mellitus tipo 2 y las enfermedades cardiovasculares;21 esto explica porque los diabéticos con elevado IMC de esta investigación presentaron mayor riesgo cardiovascular.
Las actividades de la CP y la MPO en el suero resultaron altamente significativas, teniendo en cuenta la función bioquímica de estas enzimas y la influencia sobre ellas del complejo entorno redox donde se ubican. La CP en condiciones de estrés oxidativo severo puede cambiar su estatus de antioxidante a oxidante (oxidar los lípidos), reducir la biodisponibilidad del óxido nítrico y la apoptosis celular en el endotelio.22 En los pacientes con diabetes mellitus tipo 2 suben los niveles séricos de la CP,23 lo cual coincide con los resultados de este estudio.
Asimismo, el desarrollo de la MPO y sus oxidantes derivados dañan los tejidos, y provocan enfermedades relacionadas con la disfunción endotelial.7 La MPO actúa sobre las proteínas de la matriz extracelular, mitiga la disponibilidad del óxido nítrico y media en la activación de los neutrófilos.24 Los niveles elevados de esta enzima se asocian a un mayor riesgo cardiovascular en las personas con enfermedad renal crónica10) y enfermedades autoinmunes.25 Las lipoproteínas de baja densidad modificadas por el ácido hipocloroso, producido por la MPO, se hallan presentes en las lesiones ateroscleróticas y propagan la inflamación.9 El incremento de la actividad de la MPO, encontrado en este trabajo, concuerda con lo reportado en pacientes con diabetes mellitus tipo 2.26,27
Cuando la MPO supera a la CP, estimula el daño tisular y conlleva a serias complicaciones. Aunque se considera a la CP el inhibidor endógeno de la MPO,13 no se apreció este efecto en la investigación; por ello sería conveniente evaluar el comportamiento de estas enzimas en pacientes prediabéticos para profundizar en la relación de ambas en una situación metabólica menos comprometida.
La baja correspondencia entre la actividad de la MPO y la CP indica que su relación depende del comportamiento diferencial en pacientes descontrolados metabólicamente y obesos. El incremento de la MPO pudiera relacionarse con un agravamiento del cuadro clínico del paciente diabético.