Introducción
El íleon terminal es uno de los segmentos del intestino delgado más importantes de la barrera epitelial intestinal, y considerado el sitio clave tanto de la absorción de nutrientes como del control metabólico energético y general del organismo.1 La pérdida de su integridad resulta del daño originado por disbiosis o agentes metabolómicos presentes en la luz intestinal. En dependencia de la diversidad de los microorganismos y del equilibrio de los elementos bióticos y abióticos en la luz intestinal, se genera una respuesta inflamatoria responsable de la disfunción de la barrera intestinal, expresada en malabsorción, descontrol metabólico, intolerancia inmunitaria, circulatoria y, por ende, pérdida de la conservación de la integridad y funcionalidad de otros órganos y sistemas, digestivos y extradigestivos.2,3
Evidencias emergentes reportan al íleon terminal como sitio de inicio de la amplificación de la respuesta inflamatoria generada por la disbiosis, la exposición a ácidos biliares, así como del descontrol metabólico energético, lipídico, glucémico, y del colesterol, entre otros. Todos, relacionados a comorbilidades asociadas en general a trastornos del eje hepático- intestinal.4,5
El objetivo de este artículo es describir las evidencias histomorfológicas y los aspectos biomoleculares del íleon terminal, que justifican su función como sitio clave en la absorción de nutrientes, la regulación del sistema inmunitario y el metabolismo energético en general, así como de la integridad y función de otros órganos. También, citar los hallazgos histomorfológicos del íleon terminal de los pacientes fallecidos que pudieran justificar su relación con los estadios clínicos de los pacientes infectados por el SARS-CoV2, al presentar un síndrome metabólico como expresión de la COVID-19.
Métodos
El método consistió en una revisión sistemática y crítica sobre la estructura histomorfológica, y los aspectos biomoleculares del íleon terminal, en los idiomas español e inglés, de los sitios Web de PubMed, SciElos, Lilacs, y Elservier, desde el año 2000 hasta el 2021. Se utilizó, como criterios de selección, un índice de materia médica, las palabras claves: íleon terminal, ileítis, barrera epitelial intestinal, virus SARS-CoV-2, COVID-19, y la abreviatura: IT (íleon terminal), para adquirir las evidencias relacionadas con los mecanismos biomoleculares del proceso inflamatorio que puedan estar expresadas en los hallazgos preliminares observados en el íleon de los fallecidos de la COVID-19.
La novedad del presente artículo consiste en ofrecer una revisión actualizada de las características histológicas del íleon terminal como barrera epitelial intestinal, cuya pérdida en la COVID-19 pudiera justificar el descontrol metabólico e inmunitario en el curso de los estadios clínicos extremos de estos pacientes. Los reportes que reconocen la participación del tractus digestivo en la COVID-19, describen muy poco los hallazgos histomorfológicos del íleon. Esto motivó la cita de los hallazgos preliminares que pudieran expresar una relación entre la pérdida de la barrera intestinal en los fallecidos con la progresión clínica de la COVID-19 hasta la muerte, por ende, realizar estudios más amplios del íleon terminal con la perspectiva de lograr nuevas intervenciones terapéuticas que permitan conservar o restaurar la integridad de la barrera epitelial intestinal.
Resultados
Íleon: evidencias actuales
El íleon es un segmento de 2 cm de diámetro que abarca las 3/5 partes del intestino delgado. Está constituido por cuatro capas: mucosa, submucosa, muscular y serosa, que conforman la barrera epitelial intestinal. Los pliegues circulares de mucosa y submucosa (válvulas de Kerckring o plica), las vellosidades intestinales o villi y las células epiteliales, son sus estructuras más importantes.1,6
Las células epiteliales que integran su pared bajo diversos tipos y funciones definidas son: -los enterocitos (absorben las vitaminas liposolubles y de la vitamina B12, los ácidos biliares, xenobióticos y oligoelementos como el magnesio); - las células secretoras de la mucosa y submucosa como las caliciformes (secretoras de mucina), las endocrinas, que conforman el sistema neuroendocrino difuso (SNED) y controlan el metabolismo del colesterol, las lipoproteínas y, la glucosa, así como la secreción de hormonas y neuropéptidos intestinales, reguladores de la motilidad, la integridad intestinal y el metabolismo en general, como el péptido YY, el enteroglucagón, las incretinas (péptidos similares al glucagón: GLP-1 y GLP-2); - las células indiferenciadas, ubicadas en las criptas de Paneth, controlan la proliferación celular, y son productoras de las defensinas y las lisozimas. Y en la lámina propia, las células inmunitarias; las secretoras de inmunoglobulinas A (IgA), como las células dendríticas y plasmáticas, los macrófagos y linfocitos. También las que integran los acúmulos de tejido linfoide que se extiende hasta la submucosa, como los folículos linfoides y los linfocitos intraepiteliales B y T) que secretan biomoléculas antinflamatorias o proinflamatorias, denominados placas de Peyer.7-12)
El íleon terminal es una barrera dinámica, semipermeable y reversible que permite el paso de moléculas por difusión facilitada o diferencia de gradientes, capaz de mantener la adaptabilidad y la microbiota intestinal en respuesta a modificaciones ambientales e internas por enfermedad, fármacos, hormonas o dieta.7,11,12 Además, se reporta que estudios biomoleculares han identificado diversos receptores nucleares, acoplado a la proteína G de Takeda de membrana y, transportadores, formando parte de las estructuras celulares que conforman el íleon terminal, a través de los cuales ejerce su función de barrera, y es considerado como el segundo tejido del organismo con mayor distribución y expresión del receptor renina angiotensina 2 (ACE2).13
Enterocito
Estudios biomoleculares actuales de los enterocitos esclarecen los mecanismos que regulan y mantienen la integridad morfo-funcional del sistema digestivo y extradigestivo. Uno de los hallazgos más importantes a nivel de sus membranas y citoplasmas, ha sido la identificación y caracterización de los receptores nucleares, como el farnesoide X (RFX) y el de la vitamina D (RVD), y a nivel de la membrana, el acoplado a la proteína G de Takeda o uno de sus tipos, el factor de crecimiento epidérmico 5 (TGR5, por sus siglas en inglés), entre otros. Ambos cumplen acciones de regulación de las actividades biológicas del enterocito, y su pérdida se expresa en la disfunción intestinal o insuficiencia intestinal.14 También han sido identificados los trasportadores, compuestos bioquímicos que regulan la captación y salida de diversos metabolitos como los ácidos biliares a través de la circulación enterohepática, como el apical de sales biliares dependiente de sodio (TASBNa+), ubicado en la membrana externa del enterocito; el del ácido biliar ileal (TIAB) intracitoplasmático y; el ubicado en la porción basolateral del enterocito, el heterodímero α/β, denominado también transportador entérico de solutos orgánicos (OSTα/β).15,16 Una vez activados, estos receptores y transportadores ejercen acciones reguladoras y protectoras en el organismo, en especial, la propia homeostasis de los ácidos biliares que mantiene la integridad funcional del eje hepático-intestinal, la microbiota, el sistema inmunitario y el metabolismo energético y específico.17
Las evidencias de estas propiedades reguladoras han permitido también el reporte por sus investigadores de la incorporación para el control, prevención, e incluso, curación, de los efectos citotóxicos de los ácidos biliares, de nuevas intervenciones terapéuticas como la del ácido ursodesoxicólico, un ácido biliar terciario, hidrofílico potente, agonista del RFX hepático e intestinal y modulador bioquímico del metabolismo de los ácidos biliares primarios y secundarios.16
Por otra parte, los hallazgos biomoleculares asociados en la actualidad a las propiedades físico-química de los ácidos biliares, por su acción como moléculas de señalización y, ligandos endógenos sobre los receptores descritos tanto en los enterocitos como, incluso, en los ubicados en las membranas plasmática de las células epiteliales de los órganos extradigestivos, regulan las actividades biológicas de los ácidos biliares, tales como la proliferación celular, la microbiota, la motilidad intestinal, el transporte de agua y electrolitos, el papel pleiotrópico del metabolismo energético y el general (colesterol, lípidos, glucosa), la sensibilidad de la insulina, la absorción del calcio, la liberación de las enzimas pancreáticas, las hormonas y los neuropéptidos gastrointestinales. También regulan la permeabilidad intestinal celular y paracelular del epitelio intestinal, la respuesta inmunitaria, la autofagia celular, su actividad antimicrobiana, así como también el control de la integridad del tejido pulmonar, cardiovascular, renal y cerebral; por eso, en condiciones fisiopatológicas se relacionan con la secuencia del proceso inflamatorio-carcinogénesis tanto del aparato digestivo como del extradigestivo. Por tanto, los reportes de investigaciones realizadas en el orden fisiológico, molecular y histomorfológicos del enterocito sugieren que el control de su integridad, representan una alternativa terapéutica más para controlar diversas comorbilidades que surgen por trastornos del eje hepático-intestinal como ocurre en la esteatosis hepática, la obesidad, la diabetes mellitus tipo II, y el fallo multiórgano.(18-23
Barrera epitelial intestinal
La barrera epitelial intestinal es una unidad funcional compleja y selectiva por su composición celular, y la primera defensa innata del aparato digestivo que selectivamente regula el transporte de metabolitos de la digestión, los componentes bacterianos de la microbiota, el sistema inmunitario, el medio interno y la circulación desde la luz intestinal hacia los tejidos subyacentes para ejercer sus acciones de conservación e integridad del eje hepático-intestinal y de los órganos extradigestivos.24,25 Estas acciones, unidas al mucus (mucina) secretado por las células caliciformes, a las proteínas transportadoras, integrales, periféricas, los lípidos de anclaje de canales y de las uniones intercelulares, los glúcidos (Glucocalix), y a los lípidos anfipáticos e hidrofóbicos (fosfolípidos, esfingolípidos, glucolípidos, y colesterol), propician a la barrera epitelial intestinal la permeabilidad y la estabilidad celular necesaria para cumplir sus funciones.26,27
En este sentido, es de destacar que la importancia de la malabsorción de los ácidos biliares es subestimada en la ileitis. La inflamación, según su intensidad y persistencia, sobre todo del segmento más distal del íleon, y aún asociada a la disbiosis, se caracteriza desde el punto de vista biomolecular por una pérdida de los trasportadores y receptores nucleares ya descritos, un incremento de la translocación bacteriana o sus componentes, y de agentes metabolómicos como los ácidos biliares, hacia la circulación sistémica y otros tejidos, en proporciones que superan al sistema fagocítico y la capacidad del eje hepático-intestinal de aclararlos en sangre. Éste hecho origina la translocación bacteriana, disbiosis, biotransformación desequilibrada de los ácidos biliares primarios a secundarios en la luz intestinal, más la alteración de la motilidad intestinal que se expresa en la manifestación clínica típica caracterizada por diarreas secretoras, fétidas, amarillas y esteatorreas.28
La ileítis se caracteriza por la presencia de linfocitos, macrófagos, entre otras células inflamatorias, que secretan citocinas”, y destrucción celular. Al afectarse la integridad de la barrera epitelial por estar los enterocitos con lesiones estructurales, se incrementa sin control la permeabilidad para diversos microorganismos, y los agentes metabolómicos amplificadores de la respuesta inflamatoria inicial. Esto genera una respuesta inmunitaria local exagerada y descontrolada, más la disrupción de las uniones intercelulares, que favorecen la translocación bacteriana, sepsis local y sistémica, y la afectación de órganos digestivos y extradigestivos expresados en el fallo multiórgano.29,30 Según diversos estudios, la disrupción de la unión intercelular ocurre por la expresión de las proteínas zonulin (ZO-1) y ocludina y, del factor de crecimiento derivado de plaquetas (PDGF, por sus siglas en inglés) que incrementan la liberación de neutrófilos adheridos al endotelio, óxido nítrico, radicales libres y, neuropéptidos responsables de la vasodilatación local y de los efectos nocivos sobre los enterocitos y otras células epiteliales.31,32 Estos mecanismos biomoleculares se amplifican aún más, cuando la ileitis se asocia a comorbilidades como la diabetes mellitus tipo 2, obesidad, las hepatopatías crónicas de etiologías diversas , etc.33)
Disbiosis
Diversos estudios in vivo e in vitro evidencian también la importancia de la diversidad y las funciones de la microbiota intestinal en el equilibrio salud-enfermedad La interacción dinámica entre la microbiota intestinal y el sistema inmunitario del huésped son claves en la homeostasis e inhibición de la inflamación intestinal.34 La disbiosis es el estado de variabilidad adversa en la ya diversa composición de la microbiota intestinal y de la respuesta del huésped, condicionada por esta y la coexistencia con las alteraciones homeostáticas de diversos metabolitos; y establece el mantenimiento de un nuevo equilibrio entre los elementos bióticos y abióticos a expensas de la interacción subyacente entre ellos. Por ende, constituye el basamento etiopatogénico de enfermedades gastrointestinales y sistémicas.35
La cascada de señalización desencadenada por la disbiosis, induce respuestas proinflamatorias y profibrogénicas que crea hiperpermeabilidad intestinal e intolerancia inmunitaria al lesionar los enterocitos, y la homeostasis de los ácidos biliares, dando lugar a la inflamación subclínica basada en el estrés oxidativo, las señales de proliferación, la apoptosis, la fibrogénesis por activación de la NADPH oxidasa en las células de Küpffer y de las vías de señalización de NF-kB y JNK, así como, resistencia a la insulina.34,36) En este estado de hiperpermeabilidad, las endotoxinas, adhesinas e invasinas, los lipopolisacáridos, antígenos, y componentes del ADN bacterianos, pasan a la circulación portal rumbo al hígado, donde al unirse a los receptores Toll (TLR, por sus siglas en inglés de Toll-like receptors), originan la liberación de IL-1β y TNF α, los profibrógenos (TGFβ1 y PDGF) y, los ácidos biliares hidrofóbicos conjugados a glicina, a niveles suficientemente predominantes y persistentes en estos estados también, que ejercen, como antagonistas de los receptores de membrana y nucleares descritos, una acción proinflamatoria, desreguladora del sistema inmunitario e incremento adicional y persistencia de la resistencia a la insulina periférica, por tanto, de desórdenes metabólicos como para originar o amplificar las respuestas adaptativas de protección o daño sumadas al conjunto de efectos adversos según el estado de equilibrio del eje hepático-intestinal.37,38) Así se explica cómo la disbiosis incrementa la prevalencia de la diabetes, esteatosis hepática, enfermedades cardiovasculares, autoinmunes, intestinales y varios tipos de cáncer.39
Hiperpermeabilidad intestinal
Las alteraciones estructurales y biomoleculares de los componentes tisulares del íleon terminal, la disbiosis y la disfunción de la barrera intestinal descritas dejan claro la existencia del incremento de la permeabilidad intestinal, como resultado o sumada al resto de las acciones generadoras de los procesos inflamatorios que expresan la existencia de un desequilibrio del eje hepático-intestinal o viceversa. Esto, más el hecho de que el íleon terminal es el segundo tejido con la mayor distribución de receptores ACE2 después del testicular, permite inferir el condicionamiento propicio en este tejido para la participación del virus SARS CoV-2 en la disfunción de la barrera intestinal, su consecuente descontrol del metabolismo y la amplificación inflamatoria en el progreso clínico de la COVID-19, más si asocia a comorbilidades metabólicas y de inmunodeficiencias.13,40 Esta apreciación justificaría los reportes que desde el inicio de la pandemia por el SARS-CoV-2 destacan la presencia, junto al síndrome respiratorio difuso agudo, de manifestaciones gastrointestinales como las diarreas, los vómitos y el dolor abdominal, aún carentes de descripciones semiológicas, cuyos reportes oscilan entre 24.2, y 50.0 % de los enfermos de la COVID-19.40-42 Es de señalar, que los reportes sobre la intensidad y características de las diarreas desde el comienzo de la infección adquieren una connotación especial en las etapas graves de la evolución clínica y se asocian a neumonía e insuficiencia respiratoria, de modo que se incorporan a la secuencia, en orden de frecuencia, de los síntomas en la COVID-19, dadas por fiebre, tos, náuseas / vómitos y diarreas.43
Se reportan estudios de ileítis en la COVID-19 en edades pediátricas a través de la tomografía axial computarizada del íleon terminal,41) sin embargo, en la revisión realizada no se hallan estudios que aborden las características histomorfológicas del íleon terminal y aún se desconoce si son típicas e inespecíficas de la infección por el SARS-CoV-2, a pesar de ser reconocida la riqueza del íleon terminal en receptores ACE2.14,15,44,45
El receptor ACE2, es necesario para la entrada del SARS- CoV-2 a la célula, de esta forma quedaría relacionado con el daño del enterocito, de la intolerancia inmune, y del metabolismo energético, glucídico y lipídico, como expresión del descontrol del eje hepático- intestinal al originar un intestino hiperpermeable. También se ha reportado que otro de los sitios de ubicación importante de los receptores ACE2 son los colangiocitos, lo que permite suponer que el SARS CoV-2, al provocar trastornos funcionales y ruptura de la pared colangiolar, repercute en su función de vías de paso del contenido hepático, es especial de los ácidos biliares primarios conjugados a taurina o glicina, con su probable influencia adversa en la homeostasis y el fallo multiórgano como expresión adicional del desequilibrio en el eje hepático-intestinal. De esta forma, al elevarse los niveles de ácidos biliares séricos, sobresaturar y actuar de forma antagonista sobre sus receptores (Farnesoide X y TGR5) a nivel hepático, intestinales y extradigestivos (pulmón, corazón, riñón, cerebro, endotelio vascular, etc.), pudieran amplificar la respuesta inflamatoria desencadenada por el SARS-CoV-2 y expresada en la clínica de la COVID-19 por diarreas, disnea, bradicardia, trastornos en la tensión, oligoanuria, etc.46-49
Dado que el significado de la ileítis en la historia natural de la COVID-19 aún permanece sin aclarar, con todo este conocimiento recopilado se hizo necesario citar de manera preliminar los hallazgos histomorfológicos del íleon terminal en fallecidos de la COVID-19, a los cuales se les realizó con inmediatez la autopsia mínimamente invasiva. Esto permitió obtener con éxito suficientes muestras de tejido con la mucosa en estado de conservación útil para el estudio histológico. Por esta vía se logró reunir 38 muestras de una serie de autopsias consecutivas realizadas en el Hospital Militar Central “Luis Díaz Soto” por uno de los autores (TMG). La fijación en formol fue inmediata para su procesamiento histológico de rutina, imbibición en parafina, cortes histológicos a 4 µm, coloración con hematoxilina y eosina (H&E), y observación bajo microscopio de luz. En los tejidos del íleon terminal de 19 fallecidos, solo se apreció hiperplasia de las placas de Peyer, en dos de ellos con marcado adelgazamiento de la mucosa que las reviste (no se muestra). En diecisiete de ellos se encontró ileítis crónica con acortamiento marcado de las vellosidades (Fig. 1.a); erosión focal del epitelio de superficie en cuatro; marcada infiltración de células mononucleares en la lámina propia y en epitelio glandular en diez; micro trombos en capilares de la lámina propia en dos; congestión y hemorragia focal de lámina propia en ocho. Solo uno mostró enteritis en penacho (Fig.1 b). En otros seis no se encontraron alteraciones histológicas del íleon mientras en tres mostraron marcados cambios del tejido por autolisis post mortem que no permitieron su evaluación.
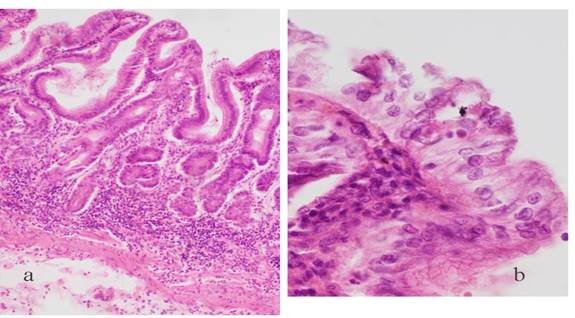 Fotos originales de la DrCs. Virginia Capó de la Paz
Fotos originales de la DrCs. Virginia Capó de la PazFig. 1 Cortes histológicos de íleon de fallecidos de la COVID-19. a) Se observa acortamiento de vellosidades entéricas, ensanchamiento de luces glandulares, alargamiento de glándulas e infiltrado inflamatorio de células mononucleares en lámina propia y capa muscular (H&E, 20X). b) Capa superficial de enterocitos que en la punta de la vellosidad muestra aumento del número de células de citoplasma claro con displasia moderada que se disponen en forma de penacho (H&E, 40X).
Finalmente, la revisión y descripción de las evidencias actuales de los aspecto estructurales y biomoleculares del íleon terminal, nos permite al citar los hallazgos preliminares observados en cortes histológicos del íleon terminal de fallecidos de la COVID-19, que la ileítis pudiera ser causa o efecto de la respuesta inflamatoria exagerada y mantenida en la COVID-19 grave o crítica, lo cual hace necesario emprender investigaciones que evidencien la distorsión de la repercusión del desequilibrio del eje hepático- intestinal por el daño tisular asociados a comorbilidades, así como una vez identificados estos hallazgos promover estudios sobre nuevas intervenciones terapéuticas en pro de la reparación de la integridad de la barrera intestinal, la inhibición de la apoptosis de los enterocitos y el restablecimiento de las uniones intercelulares, para el control de la absorción de los ácidos biliares, la disbiosis, y los trastornos metabólicos asociados a la COVID-19.
En este sentido, las propuestas devenidas comprenderían la administración de productos probióticos (control de la microbiota intestinal), de glutamina (estabilizadora de las uniones intercelulares y del stress oxidativo), de melatonina (reductora de la permeabilidad intestinal), de celulosa (generadora de ácidos grasos de cadena corta para el metabolismo celular) y del ácido ursodesoxicólico como regulador de la homeostasis de ácidos biliares además de inmunomodulador, antifibróticos, reparador tisular y de la microbiota intestinal e inhibidor de la expresión del receptor ACE2.50-54














