Introducción
El uso de medicamentos constituye la forma de actuación médica más común para reducir riesgos sanitarios, prevenir daños y tratar enfermedades.1 Representa un tópico importante en materia de gasto en salud, por lo cual es centro permanente de discusión legislativa y política.2 Garantizar un sistema de salud universal con acceso a las medicinas resulta una prioridad a nivel nacional y global.3,4,5 Los medicamentos desempeñan un papel determinante en la eficacia de los servicios sanitarios, porque aseguran un impacto directo sobre la calidad de vida de los pacientes.6
En el caso de Perú, en las últimas décadas, ha surgido un mercado de establecimientos farmacéuticos (farmacias y boticas) privados, responsables de dispensar fármacos fabricados en un laboratorio. Este nuevo actor determina la disponibilidad de un medicamento7 y su rol no se ha recogido debidamente en los modelos conceptuales utilizados para el análisis del acceso a los medicamentos.8
Con miras de evaluar este mercado emergente, el Ministerio de Salud del Perú implementó una plataforma digital llamada Observatorio Peruano de Productos Farmacéuticos (OPPF), el cual monitorea, entre otras cosas, los precios de venta al público. Solo siete países en el mundo, (Ghana, Jordania, Kyrgyzstan, Filipinas, Uganda, Zambia y Perú) cuentan con un observatorio de este tipo para garantizar la “transparencia de precios” del mercado farmacéutico según el proyecto “Medicines Transparency Alliance” MeTA de OMS. La tabla 1, resume la información disponible para cada medicamente en el OPPF.
Tabla 1 - Información disponible por medicamento en el Observatorio
| Número de establecimientos farmacéuticos con disponibilidad del medicamento. | Hace referencia a la cantidad de establecimientos farmacéuticos, farmacias y boticas, que han reportado, a fecha de colección de datos, disponibilidad del medicamento dentro de su |
| Número de presentaciones por cada medicamento. | Hace referencia a la cantidad de presentaciones o formas farmacéuticas de un mismo medicamento, ofertado en un establecimiento farmacéutico. |
| Precio de compra de un medicamento (por el paciente) en el sector privado. | Hace referencia al promedio simple de los precios de venta al público de un medicamento reportado por cada establecimiento farmacéutico en el Observatorio. |
| Precio de compra de un medicamento (por el paciente) en el sector público. | Hace referencia al precio de venta al público del medicamento dentro de alguna institución del sector público. |
Estas variables muestran la dinámica de la disponibilidad de un medicamento en el mercado farmacéutico nacional.
Existe una regulación de medicamentos controlados para establecer los mecanismos de fiscalización de los establecimientos que los dispensan. Los medicamentos controlados incluyen fármacos esenciales para niños,9 los asociados con farmacodependencia,10,11,12 fármacos para el tratamiento de enfermedades crónicas (usualmente de salud mental o problemas neurológicos refractarios), entre otros.
En Perú los medicamentos controlados se clasifican en listas y los mecanismos de regulación difieren entre ellas.13,14 Por ejemplo, en las listas IA y IB, la producción, fabricación, exportación, importación, comercio y uso se encuentran prohibidas; las listas IIA, IIB, IIIA, IIIB, IIIC, IVA, IVB, V y VI se controlan bajo distinto rigor, de forma que se pueden diferenciar según la cantidad de criterios de regulación; operativamente, se distinguen dos extremos, un régimen de control moderado (15 criterios, aplica para los medicamentos de la lista IVB) y uno de control rígido (18 criterios, aplica para los medicamentos de la lista IIA).
En la tabla 2 se muestra una síntesis comparativa de la normatividad vigente para la regularización de la venta de medicamentos controlados. La distinción entre el régimen de control rígido y moderado, se atribuye a un mayor número de criterios de control al proceso. Específicamente, la regulación rígida considera cinco criterios no contemplados en la regulación moderada: a) adquisición especial, b) receta especial, c) restricción de dosis, d) devolución al fallecer y e) balance trimestral.
Los criterios de control constituyen requerimientos obligatorios que debe asumir el establecimiento farmacéutico, y estos cinco criterios adicionales se traducen en la intensidad de las demandas logísticas donde se dispensan medicamentos controlados. La diferencia entre el control moderado y rígido se encuentra en la complejidad de la documentación para la rendición de cuentas por parte de la farmacia o botica (tabla 2). Este proceso puede ser fuente de errores, y las sanciones derivadas de ello incluyen penas privativas de libertad para el profesional responsable.
Tabla 2 - Regulación de la venta de medicamentos controlados
| Para que llegue al establecimiento farmacéutico | Adquisición común. | Adquisición bajo Formulario Oficial de Pedidos de Estupefacientes, bajo verificación de veracidad y autorización (Art. 29). |
| Para que un paciente lo adquiera | Receta común (Art. 27). Receta Retenida 02 años (Art. 36). | Receta ESPECIAL por triplicado (Art. 23). Archivo de la 1era copia de la receta ESPECIAL por dos años (Art. 30). |
| Control de las recetas médicas | Tratamientos sin restricción de dosis. No hay restricción para fechas de expedición de recetas. | Dosis en las recetas para 24 horas, solicitud especial a DIGEMID para situaciones especiales por 15 días máximo. No se atenderán recetas con expedición mayor a los tres días (Art. 26) y (Art. 31). |
| Si el paciente fallece | -- | Cuando el paciente fallezca o cambie de terapia, este debe devolver a DIGEMID los estupefacientes sobrantes junto con la última boleta de compra (Art. 32). |
| El rol de DIGEMID | Cuando DIGEMID (…) comprueba que la receta ha sido extendida con fines no terapéuticos, pondrá el hecho en conocimiento de la instancia pertinente a fin de que proceda a promover la acción penal correspondiente (Art. 34). | |
| Rendición de cuentas del establecimiento farmacéutico | No hay que presentar balances. | Emitir a la autoridad balances trimestrales relativos al empleo de los fármacos. Adjuntos a cada balance, se deberán remitir los originales de las recetas atendidas. Los balances cerrarán el último día útil de cada trimestre y se presentarán, bajo responsabilidad (sanción), dentro de los quince (15) días calendario siguientes a la fecha de cierre. Una copia de los balances quedará archivada en el establecimiento junto con las copias de las recetas y de los vales atendidos (art 50). |
Fuente: DS 023-2001/MINSA.
En la presente investigación se utilizó la data oficial del OPPF, se compararon las variables disponibles (tabla 1) para los medicamentos controlados sometidos a un régimen moderado y rígido con el objetivo de comparar la información disponible en el Observatorio para medicamentos sometidos a un régimen de control moderado y rígido en establecimientos farmacéuticos privados de Lima, Perú.
Métodos
El estudio se diseñó, en su dominio cuantitativo, como un análisis secundario de datos. Se delimitó el universo de medicamentos disponibles en Perú y, específicamente, los controlados. Dentro de estos se seleccionaron dos grupos: los fármacos de la lista IIA (régimen regulatorio rígido) y los de la lista IVB (régimen regulatorio moderado). Para ello se consideró el listado de medicamentos controlados oficial, definido por la Dirección General Medicamentos, Insumos y Drogas (DIGEMID) del Ministerio de Salud del Perú, versión 22-08-2018, vigente a fecha de este estudio.14
Cada medicamento controlado se examinó sobre la consulta en el OPPF, según la existencia en los establecimientos farmacéuticos (y así captar la disponibilidad en el mercado farmacéutico peruano). Para el grupo IIA las presentaciones más disponibles fueron fentanilo 50 mcs/H parche, metadona* 10 mg tableta, morfina* 10 mg/ml inyección, oxicodona 20 mg tableta, petidina 100mg/2ml inyección y remifentanilo 5 mg inyección. En el grupo IVB sobresalieron alprazolam 0,5 mg tableta, amitriptilina 25 mg tableta, bupropion 150 mg tableta, bromazepam 3 mg tableta, clobazam 10mg tableta, clomipramina 25 mg tableta, clonazepam 0,5 mg tableta, clordiazepóxido 5 mg tableta, clozapina 100 mg comprimido, diazepam* 10 mg comprimido, efedrina 2 mg comprimido, ergometrina 0,2 mg/ml inyección, ergotamina 1 mg cápsula, estazolam 2 mg tableta, flufenazina 25 mg/ml inyección, fluoxetina* 20 mg tableta, haloperidol* 2 mg/ml inyección, ketazolam 30 mg comprimido, lorazepam* 2 mg tableta, midazolam* 5 mg/5ml inyección, paroxetina 20 mg tableta, periciazina 40 mg/ml inyección, pseudoefedrina 100 mg suspensión, sertralina 50 mg tableta, sulpirida 200 mg tableta, tioridazina 100 mg tableta, tramadol 50 mg tableta, trifluoperazina 2 mg tableta, trimipramina 200 mg suspensión, valproato* 500 mg tableta y zolpidem 10 mg tableta. Los medicamentos señalados con asterisco pertenecen a la lista de Medicamentos esenciales para niños 2017 de OMS.15
Se exceptuaron del estudio los medicamentos que no se encontraban en ninguna farmacia como sufentanilo (IIA), anfebutamona (IVB), efedrina (IVB), levomepromazina (IVB), moclobemida (IVB), nortriptilina (IVB), pimozida (IVB), pipotiazina (IVB), sibutramina (IVB), trazodona (IVB), trihexifenidilo (IVB), zaleplon (IVB) y la zopiclona (IVB).
La consulta se realizó a través del portal web del OPPF (http://observatorio.digemid.minsa.gob.pe/) entre el 1 y 5 de enero de 2021 (ventana de observación). La búsqueda se restringió a los establecimientos farmacéuticos ubicados en el departamento de Lima, provincia Lima, donde hay más concentración de farmacias y boticas; y el observatorio muestra una mayor representatividad del mercado farmacéutico. Se tomaron en consideración todas las variables expuestas en la tabla 1.
El OPPF constituye una herramienta digital de libre acceso que ofrece el Estado peruano a toda persona con necesidad de un medicamento. Se encuentra bajo la responsabilidad del Ministerio de Salud y se promueve como un “Sistema Nacional de Información de Precios”. La data del OPPF aporta información para que el Estado, mediante la Dirección General de Insumos, Medicamentos y Drogas del Perú (DIGEMID) y el Instituto Nacional de Defensa del Consumidor (INDECOPI), inspeccione a los establecimientos farmacéuticos privados; en caso de comprobarse la inexactitud o falta de información, las farmacias o boticas pueden ser sancionadas con hasta 01 unidad impositiva tributaria (UIT) y los laboratorios con hasta 03 UIT, con posibilidad del cierre del establecimiento por 30 días.16
Por norma, todo establecimiento farmacéutico está obligado a declarar al OPPF los precios de los medicamentos en stock y disponibles al público. El OPPF también brinda el precio en soles y dólares americanos (USD) de cada medicamento y el usuario compara en cualquier farmacia del sector público (Ministerio de Salud).
El procesamiento de la data se efectuó con MS-Excel 2010 (Redmond, USA) y el procesamiento estadístico con IBM SPSS v21.0 (Armonk, USA) para Chrome. Se creó la base de datos con la información disponible en el OPPF, luego se utilizó la estadística descriptiva y un análisis comparativo según los grupos de medicamentos. Para las variables relacionadas con mediciones exactas se procedió a redondear los resultados a números enteros. La tasa de cambio de 1 USD se estimó en 3,60 soles. Se evaluó normalidad para los datos mediante la prueba de Kolmogorov Smirnov y se comparó sobre la base a diferencia de medias (mediante la prueba paramétrica ANOVA, y la prueba no paramétrica U de Mann-Whitney-Wilcoxon para muestras independientes). Se consideró un valor de p < 0,05 como significativo.
Resultados
Considerando los dos grupos de medicamentos seleccionados (IIA, IVB), se encontró que algunas de las variables de análisis siguen una distribución normal y otras no. Por ello, para efectos de un análisis comparativo se prosiguió con estadísticos no paramétricos.
Tabla 3 - Análisis de normalidad para las variables de estudio
|
|
||
|---|---|---|
|
|
|
|
| Número de establecimientos farmacéuticos con disponibilidad del medicamento. |
0,277 (0,166) |
0,131 (0,188) |
| Número de presentaciones por cada medicamento. |
0,277 (0,168) |
0,279 (0,000) |
| Precio promedio de compra de un medicamento (por el paciente) en el sector privado en soles. |
0,396 (0,004) |
0,396 (0,000) |
| Precio promedio de compra de un medicamento (por el paciente) en el sector público en soles. | -- |
0,305 (0,000) |
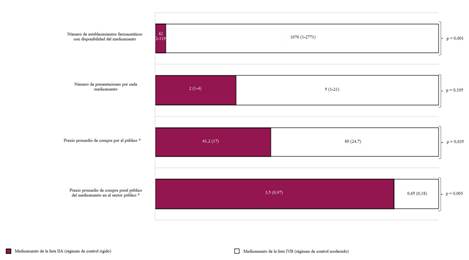
Entre los niveles de regulación de medicamentos (rígido y moderado), como muestra la figura, se observaron diferencias significativas en relación con el número de establecimientos que ofrecen el medicamento (p = 0,001), el precio promedio de venta al público en un establecimiento farmacéutico privado (p = 0,035) y el precio promedio de venta en un establecimiento público de salud (p = 0,003). La variable número de presentaciones ofertadas de un medicamento en un establecimiento farmacéutico no mostró diferencias significativas. Por tanto, un medicamento sometido a control rígido, con respecto a un medicamento sometido a control moderado, tiene menos disponibilidad de venta al público (42 vs. 1076, respectivamente), con un precio mayor [61,2 (17 USD) vs. 8,9 (4.7 USD) soles], pero en igual proporción que [3,5 (0.97 USD) vs. 0,65 (0.18 USD) soles] cuando se adquiere en un establecimiento farmacéutico público.
Discusión
Los resultados del presente estudio indicaron que los fármacos se encontraban menos disponibles y aumentaban su costo cuando se mantenían bajo un régimen de control rígido. En Perú no se hallaron publicaciones que evaluaran las existencias de los medicamentos en situación de control. El comportamiento de un medicamento sujeto a control rígido se diferencia de uno bajo control moderado; por ejemplo, alrededor de 3 mil establecimientos (100 %) ofrecen un medicamento de acceso libre, 1076 (el 34 %) los venden de la lista IVB y solo 42 (el 1,4 %), en promedio, los ofertan de la lista IIA. Los efectos negativos de los mecanismos de regulación desmotivan a los establecimientos farmacéuticos a ofertar medicamentos controlados; lo cual afecta la adquisición del fármaco cada vez que el paciente lo requiera. Esta tendencia concuerda con otras investigaciones que han evaluado la disponibilidad de los medicamentos controlados.17,18
Al disminuir las farmacias con medicamentos sometidos a un régimen de control rígido, aumenta el precio de venta al público; especialmente cuando la demanda no se analiza del mismo modo que la oferta: un establecimiento farmacéutico puede optar por no vender medicamentos controlados, pero un paciente está obligado a consumirlos. La regulación de control moderado incrementa 1,8 veces más el precio de venta en un establecimiento público con respecto al sector privado; en cambio, la regulación de control rígido lo eleva 13,6 veces. Más allá del precio del medicamento podría existir un factor especulativo, basado en la demanda insatisfecha y traducida en un incremento del precio de venta hacia el paciente.
En el mercado farmacéutico peruano los establecimientos farmacéuticos seleccionan su oferta, los escenarios más rentables y con menos complicaciones. En consecuencia, la regulación limita indirectamente la disponibilidad de un medicamento y desconoce el escenario de demanda insatisfecha por parte de los usuarios.
El control de medicamentos, según convenciones internacionales, debería establecer un equilibrio entre la garantía de seguridad y la prevención del abuso, con la disponibilidad para fines médicos e investigación. Sin embargo, la tendencia de dirigir la regulación como políticas represivas antidrogas provoca un desbalance,19 escenario válido en el Perú y nivel mundial. Esta forma de actuación no se considera suficiente para garantizar el ejercicio completo de salud porque pone en peligro el acceso a los medicamentos.
Una forma de enfrentar esta problemática sería diferenciando los niveles de regulación según su peligro real, pues la mayor parte de los medicamentos controlados se encuentran con una regulación no acorde a su seguridad:20 una revisión sistemática demostró que solo el 0,43 % de los pacientes sin antecedentes de abuso de sustancias, tratados con analgésicos opioides para aliviar el dolor, se excedieron en el uso de sus medicamentos y solo el 0,05 % desarrolló el síndrome de dependencia.20
Estudios más amplios, como encuestas a farmacias y boticas privadas, para apreciar el grado de error de la información publicada por el Observatorio, y simulaciones econométricas de oferta y demanda para evaluar causalidad, pueden complementar mejores explicaciones. Uno de los méritos del presente trabajo resulta, precisamente, mostrar el Observatorio como un instrumento de evidencia útil a políticas públicas.
La situación descrita para Lima no se refleja en otras provincias por la precariedad sanitaria en la que se encuentran (incluso no se hallan medicamentos). Explorar este aspecto pasa por ampliar el marco geográfico referencial para el análisis, según la confianza que se tenga en la data del Observatorio, cuya información se carga mensualmente al sistema por las oficinas farmacéuticas de manera obligatoria, en forma completa y actualizada conforme la legislación vigente. Tarea difícil de lograr por la cantidad de productos que comercializa una oficina farmacéutica y la variación de precios diarios, que un reporte mensual no refleja con exactitud. Las variaciones de precios y la disponibilidad a momento de compra limitan la calidad de la información del Observatorio.
En un marco de gobierno digital, el Observatorio representa una oportunidad para asegurar el ejercicio ciudadano del derecho a la salud y permite plantear la discusión en términos de cobertura. La información que recibe el ciudadano sería de mejor calidad, pero en Perú existen oficinas farmacéuticas que no pueden enviar sus reportes porque se hallan sin acceso a internet, computadora o software de gestión de stock.