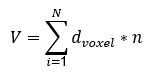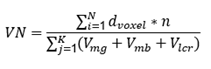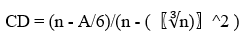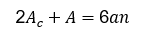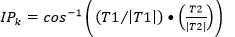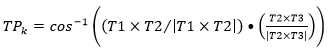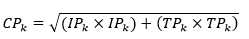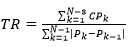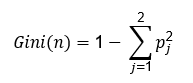Introducción
La enfermedad de Alzheimer constituye un trastorno neurodegenerativo. Conduce a una pérdida gradual e irreversible de las capacidades cognitivas e intelectuales; por tanto, limita el rendimiento de un sujeto en las actividades cotidianas. Esta patología provoca cambios atróficos en la morfología del cerebro, lo cual conlleva a la pérdida de la memoria, la orientación, el lenguaje, entre otros. Representa entre el 50 % y el 75 % de los casos de demencia en la población mundial.1
Se han considerado diferentes biomarcadores y exámenes para apoyar el diagnóstico de esta patología; entre ellos, los exámenes cognitivos y neuropsicológicos; los marcadores bioquímicos, relacionados con la concentración de los péptidos beta-amiloides (Aβ40 y Aβ42) y la proteína tau medidos en el líquido cefalorraquídeo. Se encuentran también los biomarcadores extraídos del procesamiento de las neuroimágenes.
La resonancia magnética se utiliza con frecuencia en la práctica clínica y la investigación para extraer biomarcadores que identifiquen la enfermedad de Alzheimer en las etapas iniciales.2) Entre las estructuras cerebrales más estudiadas y de particular interés se halla el hipocampo, cuya morfología se ve afectada desde la etapa de deterioro cognitivo leve.3 En esta etapa los déficits cognitivos superan lo esperado para la edad y el nivel cultural de la persona; pero no interfieren en las actividades de la vida diaria ni tienen la intensidad para establecer un diagnóstico clínico de demencia.4
Los cambios atróficos desarrollados en el hipocampo se han analizado en varios trabajos de investigación.3,5,6 Estos relacionan los cambios morfológicos, fundamentalmente de volumen, con el progreso hacia la enfermedad de Alzheimer. La literatura reporta que este indicador morfológico puede distinguir entre las poblaciones de sujetos controles y sujetos con deterioro cognitivo leve.3,5,7 Según se avanza en la enfermedad de Alzheimer, el volumen cerebral disminuye, asociado probablemente con la muerte neuronal de las diferentes estructuras.8
Henneman y otros5 reportan cambios atróficos significativos en el volumen del hipocampo para diferentes poblaciones. Los autores estudiaron las tasas de atrofia del hipocampo cerebral en pacientes con la enfermedad de Alzheimer, deterioro cognitivo leve y sujetos controles. Se incluyeron 64 pacientes con enfermedad de Alzheimer, 44 con deterioro cognitivo leve y 34 sujetos controles. Se concluyó que las medidas del hipocampo, especialmente su tasa de atrofia, discriminan mejor el deterioro cognitivo leve de los sujetos controles.
Por otra parte, Achterberg y otros9 observaron que el volumen, la forma y la textura del hipocampo resultan biomarcadores predictivos de la demencia. Otros estudios han utilizado los volúmenes de la amígdala y el hipocampo para diferenciar entre la enfermedad de Alzheimer y la degeneración lobular frontotemporal. Distinguir entre estas dos patologías se considera difícil, particularmente en las primeras etapas de la enfermedad.7 El hipocampo, como la amígdala, se reduce en volumen en los casos confirmados patológicamente de enfermedad de Alzheimer y la degeneración lobular frontotemporal en comparación con los sujetos controles.
Se han empleado nuevas métricas, entre ellas la compacidad discreta, como posible biomarcador morfológico en apoyo al diagnóstico de la enfermedad de Alzheimer.10,11Perez y otros10 y Barbará y otros11 sugieren la compacidad discreta y la tortuosidad como posibles biomarcadores de apoyo al diagnóstico de la enfermedad de Alzheimer. Perez y otros10 describen el índice de compacidad discreta, junto con el volumen, y el volumen normalizado, todos analizados en 30 sujetos controles, 30 con deterioro cognitivo leve y 30 con enfermedad de Alzheimer. Examinan, además, la materia gris, la materia blanca y los lóbulos frontal, parietal, temporal y occipital. Los autores señalan que el índice de compacidad constituye un indicador útil para la detección de los cambios asociados al deterioro cognitivo leve.
La tortuosidad se emplea como métrica para evaluar los cambios atróficos de estructuras como el lóbulo parietal y el temporal en sujetos adultos mayores, sujetos con deterioro cognitivo leve y pacientes con enfermedad de Alzheimer.11) La tortuosidad resulta sensible a los cambios atróficos de estas estructuras durante la etapa de deterioro cognitivo leve. Hasta la fecha no existe un biomarcador único, completamente específico, para predecir el deterioro cognitivo debido a la enfermedad de Alzheimer en sujetos que no presentan demencia.
Teniendo en cuenta los antecedentes descritos, este trabajo de investigación se propuso evaluar el desempeño de la compacidad discreta y la tortuosidad en los hipocampos (derecho e izquierdo), como posibles biomarcadores de neuroimágenes de resonancia magnética para discriminar entre las poblaciones de sujetos controles y sujetos con deterioro cognitivo leve.
Métodos
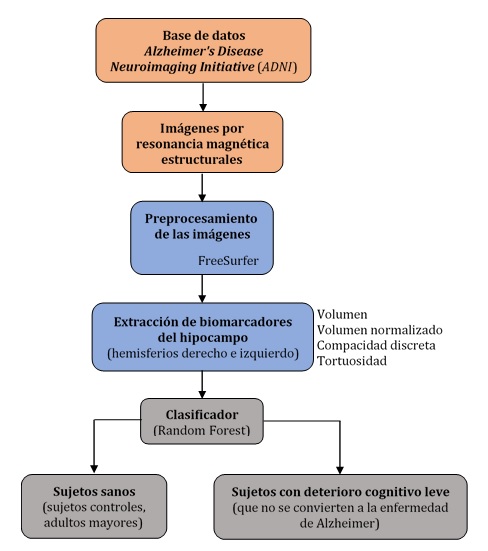
Para cumplir el objetivo se utilizó el volumen y el volumen normalizado, métricas que se correlacionaron con la compacidad discreta y la tortuosidad, mediante el análisis estadístico para estudiar las variaciones y los cambios atróficos del hipocampo. Los rasgos extraídos se incorporaron a un algoritmo de clasificación automático de bosques aleatorios para discriminar entre las dos poblaciones estudiadas.
El rendimiento de los clasificadores de bosques aleatorios (Random Forest) supera a otros clasificadores como la máquina de soporte vectorial.12 Varios autores emplean clasificadores automáticos con el algoritmo de bosques aleatorios y combinaciones de estos para dividir las diferentes etapas de la enfermedad de Alzheimer.12,13,14 Los datos de las imágenes empleados en este trabajo se obtuvieron de la base de datos del Alzheimer’s Disease Neuroimaging Initiative (ADNI) (http://adni.loni.usc.edu/).
Las poblaciones se asignaron según lo informado por expertos del ADNI, teniendo en cuenta para sujetos controles puntajes del Examen Mínimo del Estado Mental (MMSE) entre 24 y 30, y puntajes de la Tasa de Demencia Clínica (CDR) de cero y ausencia de depresión. Para los sujetos con deterioro cognitivo leve, se consideraron las puntuaciones MMSE entre 24 y 30, y CDR de 0,5; se manejaron, además, pérdida de memoria objetiva, niveles significativos de deterioro en otros dominios cognitivos y ausencia de demencia.4
Para seleccionar las dos poblaciones de la base del ADNI se incluyeron los sujetos que cumplían con los siguientes criterios:
Volúmenes de resonancia magnética adquiridos según el procedimiento reportado en adni.loni.usc.edu (imágenes ponderadas en T1, a 1,5 T, resolución de vóxel de 1,2 x 0,93 x 0,93 mm3).
Puntuaciones cognitivas evaluadas por MMSE y CDR para la confirmación del diagnóstico.
Grupos emparejados por edad.
Imágenes registradas en fechas cercanas al diagnóstico clínico.
Basados en estos criterios, se seleccionaron 98 sujetos. La tabla 1 muestra los datos sociodemográficos de la población de estudio.
Tabla 1 - Datos demográficos y pruebas cognitivas para las poblaciones seleccionadas
| Edad (años) ( |
75,7 ± 4,1 | 73,5 ± 5,6 |
| Género (F/M) | 25/24 | 20/29 |
| MMSE (rango/( |
28-30/29,5 ± 0,74 | 22-29/26,1 ± 1,5 |
| CDR (suma de cajas) (rango/ |
0 | 0,5-4(2,2 ± 0,8) |
Para el procesamiento y la segmentación del hipocampo se utilizó la herramienta FreeSurfer versión 6.0, que se descargó gratuitamente en el enlace https://surfer.nmr.mgh.harvard.edu/fswiki/DownloadAndInstall. Los pasos del preprocesamiento de imágenes cerebrales ponderadas en T1 incluyeron corrección de movimiento, transformación afín al espacio de imagen del mapa de Talairach, normalización de intensidades no uniformes para la corrección de homogeneidad y la extracción de tejidos no cerebrales. El etiquetado final de las regiones de interés se realizó sobre la base del Atlas de Desikan-Killiany y se obtuvo un atlas individual de cada sujeto, que constó de 82 estructuras cerebrales, entre ellas los hipocampos derecho e izquierdo (fig. 1).15,16
En la estructura del hipocampo segmentada se midieron los diferentes biomarcadores a evaluar. El proceso de extracción de los biomarcadores se describió en las siguientes secciones. El volumen del hipocampo (V) se calculó a partir del número de vóxeles (n) de esta región en la imagen de resonancia magnética y multiplicándolo por sus dimensiones reales (dvoxel), como se muestra en la ecuación:
La normalización de los volúmenes (VN) se hizo mediante la división del número de vóxeles de los hipocampos (derecho e izquierdo) entre el volumen intracraneal, que se calculó sumando los vóxeles totales correspondientes a la materia gris (Vmg), la materia blanca (Vmb) y el líquido cefalorraquídeo (Vlcr), según la ecuación:
La compacidad discreta resultó computacionalmente simple de calcular, varió en un rango de cero (compacidad nula) y uno (vóxeles totalmente compactos). Fue invariante a la rotación y el escalado, cualidades útiles para eliminar el sesgo en la medición. La expresión para calcular esta métrica fue la siguiente:
Donde: n es el número de vóxeles y A es el área de la superficie envolvente. El parámetro A se relacionó con el área de contacto (Ac):17
Donde: a es el área de la cara de un vóxel y el 6 indica el número de caras que componen un vóxel.17
La tortuosidad se determinó de la forma siguiente:18
Se obtuvo una malla del proceso de segmentación 3D, constituido por un conjunto de N puntos ordenados Pk, con coordenadas (xk, yk, zk).
Se definieron los vectores X, Y y Z, que contenían, respectivamente, el conjunto de coordenadas xk, yk y zk de la matriz de puntos.
A partir de la definición de los vectores anteriores se conformaron las matrices de dos columnas y k filas T1 = [Y X], T2 = [Z Y] y T3 = [Z X].
Finalmente se calcularon las ecuaciones:
Se procedió a un análisis estadístico preliminar para encontrar diferencias significativas entre los adultos mayores sanos, los sujetos con deterioro cognitivo leve y los biomarcadores propuestos. Se aplicó una prueba de normalidad de Shapiro-Wilk para determinar si los datos obtenidos seguían una distribución gaussiana; pero estos no tuvieron una distribución normal y se empleó un análisis no paramétrico para identificar cuáles biomarcadores contrastaban. Para ello se utilizó una prueba de Kruskal-Wallis.19 El valor de significancia estadística aceptada en esta investigación como distinción significativa entre las clases resultó de p < 0,01.
La clasificación automática entre sujetos controles y con deterioro cognitivo leve se hizo con un algoritmo de bosques aleatorios, ampliamente utilizado en aplicaciones médicas debido a su alta adaptabilidad a los datos biológicos. El bosque aleatorio se basó en la votación por mayoría de múltiples árboles de decisión con umbrales óptimos para separar clases contenidas en el conjunto de datos de entrenamiento;20) y se definió como una colección de clasificadores estructurados como un árbol, denotado por f(x, θk), donde x es el vector de la clase de entrada y θk el de datos aleatorios distribuidos independientemente.12 Para el vector de características de entrenamiento θk de longitud n, los nuevos subconjuntos se dividieron en m particiones de longitud n1 (n1 <n) mediante muestreo y reemplazo. Los modelos m se combinaron para el entrenamiento y la clasificación del bosque aleatorio.14
Las características y la asignación de importancia para cada variable se seleccionaron implícitamente durante la clasificación del bosque aleatorio con el índice de impureza de Gini, medida no paramétrica del poder de predicción de una característica. Para cada nodo binario n en el árbol de decisión, el índice de Gini se calculó de la siguiente manera:20
Donde: pj es la frecuencia relativa de la clase j en el nodo n.
El bosque aleatorio se diseñó con 150 árboles, profundidad máxima del árbol de ocho, y el número mínimo de muestras para dividir un nodo interno fue de dos. El clasificador generó dos salidas posibles: sujetos controles y sujetos con deterioro cognitivo leve.
Para evaluar el desempeño de la clasificación, se utilizó una validación cruzada de cinco vías con los conjuntos de datos de entrenamiento (78 sujetos, 39 de cada clase). También se realizó una prueba final con un conjunto de datos reservados (20 datos, 10 de cada clase) que no fueron parte del entrenamiento del clasificador. Esta prueba tenía el objetivo de evaluar el desempeño final del clasificador y el método en un contexto más cercano a la práctica clínica.
El vector de características empleado para el entrenamiento y la clasificación del algoritmo de bosques aleatorios fue de ocho rasgos: volumen, volumen normalizado, compacidad discreta y tortuosidad, medidos en los hipocampos derecho e izquierdo. Todos los rendimientos, tanto en el entrenamiento como en la etapa final, se determinaron en función del área bajo la curva ROC (AUC-ROC), la precisión y la matriz de confusión.
Resultados
Del procesamiento de las neuroimágenes con la herramienta FreeSurfer 6.0, se obtuvo un mapa de estructuras segmentadas y etiquetadas de los hipocampos derecho e izquierdo (fig. 2). La figura 3 muestra la reconstrucción 3D de los hipocampos a partir de los volúmenes segmentados.
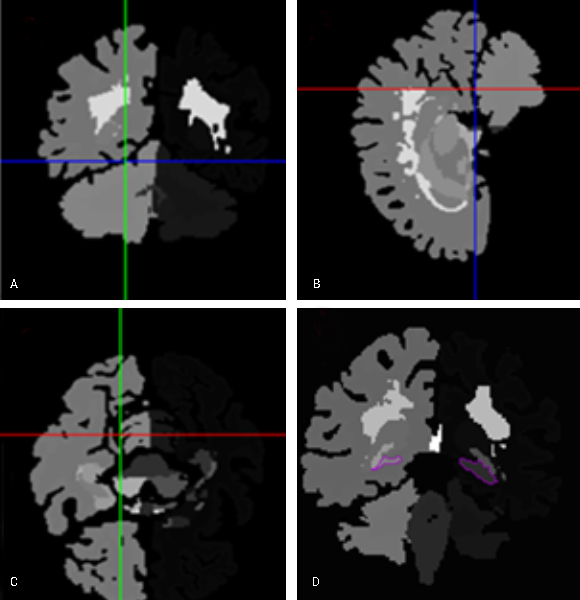
Fig. 2 - Mapa de las estructuras cerebrales segmentadas A) vista axial, B) vista sagital, C) vista coronal, D) vista axial con los hipocampos delineados en morado.
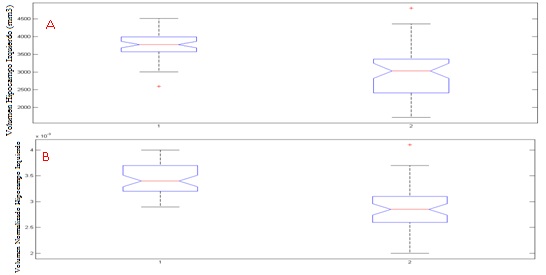
El volumen se redujo un 22,06 % (881 mm3) en el hipocampo izquierdo y un 18,46 % (697 mm3) en el derecho. La mediana para el hipocampo izquierdo del volumen normalizado fue de 0,0034 y 0,0029, respectivamente, para la población sana y la población con deterioro cognitivo leve (14,71 % menor); en el hipocampo derecho la mediana del grupo control resultó de 0,0035 y para los sujetos con deterioro cognitivo leve de 0,003 (14,29 % menor).
La figura 4 muestra el comportamiento del volumen y el volumen normalizado para el hipocampo izquierdo. Se obtuvo una disminución estadísticamente significativa con un valor p = 5.20e-11 entre los volúmenes de la población control y los sujetos con deterioro cognitivo leve (fig. 4A). Para el caso del volumen normalizado se estableció un valor p = 1.60e-09 como diferencia estadística entre las clases.
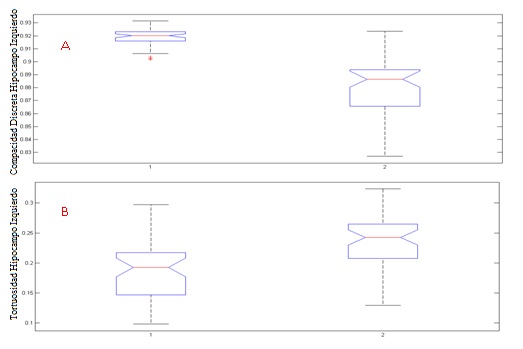
El hipocampo izquierdo contrastó más entre las dos poblaciones. En esta área la tortuosidad fue mayor un 24,91 % en la población con deterioro cognitivo leve, en comparación con los sujetos sanos, y en el hipocampo derecho un 8,47 % mayor. La compacidad discreta discriminó entre ambas poblaciones y tuvo menor variación entre el hipocampo izquierdo y el derecho (fig. 5), su valor de significancia estadística resultó p = 5.71e-15 entre ambas clases y el de la tortuosidad, p = 6.35e-07. Este análisis se aplicó a todas las métricas evaluadas para los hipocampos derecho e izquierdo (tabla 2).
Tabla 2 - Comparación estadística de los diferentes biomarcadores
| Hipocampo derecho | 2.69e-10 | 1.78e-07 | 1.28e-15 | 0.010 |
| Hipocampo izquierdo | 5.20e-11 | 1.60e-09 | 5.71e-15 | 6.35e-07 |
Nota: En todos los casos se observó un valor de p < 0,01.
El algoritmo de bosque aleatorio, en la etapa de entrenamiento (78 sujetos, 39 de cada clase), estableció una precisión final del 89,83 % ± 0,052 % de los sujetos clasificados de forma correcta. Luego de la etapa de entrenamiento, se realizó una prueba con un conjunto de datos reservados, cuya exactitud resultó del 85 %. La matriz de confusión final de la tabla 3 clasificó tres sujetos de forma incorrecta: un sujeto sano con deterioro cognitivo leve y dos pacientes con deterioro cognitivo leve se consideraron sanos.
Tabla 3 - Matriz de confusión resultante de la clasificación con datos reservados del algoritmo automático de bosques aleatorios
| Sujetos controles | 9 | 1 |
| Deterioro cognitivo leve | 2 | 8 |
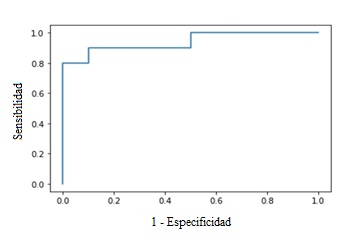
Se calculó, para la etapa final, la sensibilidad y la especificidad del algoritmo propuesto. La sensibilidad (90 %) y la especificidad (80 %) caracterizaron la capacidad del algoritmo para detectar, respectivamente, la patología en sujetos enfermos y la ausencia de la enfermedad en sujetos sanos. El área bajo la curva ROC tuvo un valor de 0,94 (fig. 6).
Discusión
Los resultados de esta investigación muestran que el volumen y el volumen normalizado del hipocampo tienen un buen valor discriminatorio entre los grupos estudiados. La disminución del volumen del hipocampo en sujetos controles y con deterioro cognitivo leve, probablemente, está asociada a la muerte neuronal que afecta al cerebro según avanza la enfermedad de Alzheimer.
Las variaciones de volumen entre ambos grupos eran esperadas, porque este indicador resulta el biomarcador de imágenes más aceptado en el análisis clínico. Los hallazgos de este trabajo coinciden con los reportados en estudios previos por Sorensen y otros21 y Achterberg y otros,9 quienes consideran el análisis volumétrico como la mejor característica para diferenciar estas dos poblaciones de estudio, comparadas con el grosor cortical, la textura y la forma del hipocampo; las cuales mostraron un rendimiento predictivo con un área bajo la curva característica operativa (AUC) de 0,700 para la textura, y de 0,788 para la combinación de volumen y textura.
Otros estudios plantean una reducción del volumen del 12 % (326 mm3) en el hipocampo izquierdo y del 11,5 % (330 mm3) en el hipocampo derecho en enfermos de Alzheimer y sujetos sin demencia.22
Hennman y otros5 reportan cambios atróficos significativos en el volumen del hipocampo para diferentes poblaciones y concluyen que estas medidas, especialmente la tasa de atrofia del hipocampo, discriminan mejor el deterioro cognitivo leve de los sujetos control y predicen la progresión del deterioro cognitivo leve a la enfermedad de Alzheimer.
Por su parte, Barnes y otros7 han utilizado los volúmenes de la amígdala y el hipocampo para separar la enfermedad de Alzheimer y la degeneración lobular frontotemporal. Distinguir entre estas dos patologías resulta difícil, particularmente en las primeras etapas de la enfermedad. El hipocampo y la amígdala se reducen en volumen en los casos confirmados patológicamente, en comparación con los sujetos controles. Sin embargo, se afirma que la atrofia del hipocampo no es específica de la enfermedad de Alzheimer, y la combinación de los patrones severos o asimétricos de la amígdala y la atrofia del hipocampo sugiere degeneración lobular frontotemporal.
En cuanto a la tortuosidad, Barbará y otros11 encontraron diferencias significativas entre sujetos controles y el deterioro cognitivo leve en el lóbulo temporal izquierdo. Pérez y otros10 observaron un mejor comportamiento de la compacidad discreta frente al volumen para discriminar entre controles, deterioro cognitivo leve y enfermedad de Alzheimer en los lóbulos frontal, temporal y occipital izquierdos. La compacidad discreta fue 3,54 % menor para casos con deterioro cognitivo leve en el hipocampo izquierdo y 3,16 % menor en el hipocampo derecho.
La compacidad discreta presenta un comportamiento decreciente similar al volumen y al volumen normalizado, probablemente porque se relaciona con el área y las superficies de contacto de las estructuras cerebrales. Estos parámetros se ven afectados durante el progreso hacia la enfermedad de Alzheimer. Dichos cambios morfológicos se asocian con la atrofia estructural y aparecen como resultado de la pérdida neuronal y tisular, típica de las enfermedades neurodegenerativas.8
Estudios recientes sugieren la compacidad discreta y la tortuosidad como posibles biomarcadores de apoyo al diagnóstico a la enfermedad de Alzheimer.10,11Pérez y otros10 describieron el índice de compacidad discreta junto con el volumen y el volumen normalizado. Analizaron la materia gris, la materia blanca y los lóbulos frontal, parietal, temporal y occipital. El poder de discriminación de estos índices mediante el área bajo la curva característica operativa (curva ROC) determinó un índice de compacidad con un valor promedio de 0,7 para la comparación de sujetos controles versus sujetos con deterioro cognitivo leve; 0,9 para la separación de controles versus enfermedad de Alzheimer; y 0,75 para deterioro cognitivo leve versus grupos de enfermos de Alzheimer. Estos resultados evidencian que la compacidad discreta constituye un indicador útil para la detección de los cambios asociados al deterioro cognitivo leve.
En el presente estudio los biomarcadores calculados en los hipocampos, derecho y izquierdo, presentaron diferencias estadísticamente significativas entre las poblaciones de sujetos controles versus sujetos con deterioro cognitivo leve; lo cual demuestra la relevancia clínica de estos últimos. Se debe tener en cuenta que los sujetos con deterioro cognitivo leve comienzan a presentar síntomas preliminares de la enfermedad, pero sin afectar su desempeño en las actividades cotidianas; por tanto, su diagnóstico temprano puede ofrecer ventajas significativas para el tratamiento posterior.
Otros autores indican la combinación de diferentes biomarcadores como el Examen Mínimo del Estado Mental, la edad, el grosor cortical, el área de la superficie cortical, la curvatura cortical, el volumen de estructuras corticales y subcorticales, y el volumen del hipocampo. Proponen una selección de rasgos a partir de un análisis de varianza simple (ANOVA) y emplean un ensamble de clasificadores de bosques aleatorios (uno versus el resto) para discriminar de forma automática entre las poblaciones de estudio. Se describe una exactitud final para la clasificación automática entre los grupos analizados del 56,25 %.14
Dimitriadis y otros13 señalan la eficacia de un nuevo esquema con múltiples selecciones de características que, basadas en imágenes de resonancia magnética, utilizan bosques aleatorios. Este método incluye subconjuntos de todo el conjunto de características por lóbulos y hemisferios. La decisión final utiliza un enfoque de fusión de diferentes métodos y la clasificación por conjuntos a través de la votación por mayoría. Los autores reportan una exactitud del 61,9 % en la clasificación de los cuatro grupos de estudio.
La compacidad discreta constituyó el indicador con mayor diferencia entre las dos clases analizadas; por tanto, junto con la tortuosidad y los volúmenes, puede caracterizar de manera significativa las variaciones morfológicas del hipocampo en la transición de los sujetos sanos al deterioro cognitivo leve.
La contribución principal de esta investigación fue la introducción de la compacidad discreta y la tortuosidad como parámetros para cuantificar los cambios morfológicos de la estructura del hipocampo en el avance de la enfermedad de Alzheimer. Se demostró que la compacidad discreta y la tortuosidad resultan sensibles a los cambios morfológicos de los hipocampos derecho e izquierdo; los cuales pueden detectarse en la etapa de deterioro cognitivo leve a partir de las métricas propuestas. Estos hallazgos se unieron a los cambios de volumen y volumen normalizado, que también presentaron cambios estadísticamente significativos y corroboraron los resultados de otros autores. En conclusión, la compacidad discreta y la tortuosidad se consideran biomarcadores de imágenes potencialmente útiles en la detección de sujetos con deterioro cognitivo leve, cuando estos comienzan a presentar los primeros síntomas clínicos de la enfermedad de Alzheimer.