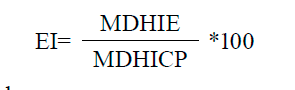Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión On-line ISSN 2078-8452
Pastos y Forrajes vol.39 no.2 Matanzas abr.-jun. 2016
ARTÍCULO DE INVESTIGACIÓN
Potencialidad antimicrobiana y caracterización de propóleos de Melipona beecheii provenientes de dos fincas agroenergéticas
Antimicrobial potential and characterization of Melipona beecheii propolis from two agroenergetic farms
Leydi Fonte-Carballo1, Yanio E. Milián-Rodríguez1 y Maykelis Díaz-Solares1
1Estación Experimental de Pastos y Forrajes Indio Hatuey, Universidad de Matanzas, Ministerio de Educación Superior
Central España Republicana, CP 44280, Matanzas, Cuba
Correo electrónico: leydis.fonte@ihatuey.cu
RESUMEN
La investigación se realizó en dos fincas agroenergéticas de la provincia de Matanzas (La Primavera e Indio Hatuey), con el objetivo de determinar la actividad antimicrobiana in vitro de los extractos metanólico y etanólico de propóleos recolectados en estas fincas, y caracterizarlos mediante espectroscopía infrarroja. Se determinó la concentración mínima inhibitoria (CMI) de dichos extractos antes de estudiar la actividad antimicrobiana (por el método de perforaciones en agar). Ambos ensayos biológicos se evaluaron frente a Staphylococcus aureus, Escherichia coli, Pseudomona aeruginosa y Candida albicans. Al no cumplirse los supuestos de homogeneidad de varianza y normalidad se utilizó la prueba no paramétrica de Kruskal Wallis, para determinar la existencia de diferencias entre los tratamientos en función del halo de inhibición. Los extractos de propóleos procedentes de las dos fincas mostraron bajos valores de CMI para los microorganismos evaluados (entre 0,07 y 0,15 mg/mL), con excepción de P. aeruginosa que fue el más susceptible (0,04 mg/mL). De las tres diluciones probadas: 100, 75 y 25 %, la primera (perteneciente al extracto metanólico de propóleo de la finca la Primavera) alcanzó el mayor efecto inhibitorio. La mayor diferencia en los espectros infrarrojos se encontró en el intervalo de la región de 2 000 a 500 cm-1 del propóleo perteneciente a la finca Indio Hatuey. Se concluye que las extracciones de propóleo con metanol y etanol permiten obtener productos naturales con elevada actividad antimicrobiana frente a los cuatro microorganismos evaluados.
Palabras clave: Espectroscopía infrarroja, microorganismos, miel.
ABSTRACT
The study was conducted in two agroenergetic farms of Matanzas province (La Primavera and Indio Hatuey), in order to determine the in vitro antimicrobial activity of the methanolic and ethanolic extracts of propolis collected in these farms, and characterize them through infrared spectroscopy. The minimum inhibitory concentration (MIC) of such extracts was determined before studying the antimicrobial activity (by the method of agar perforations). Both biological essays were evaluated against Staphylococcus aureus, Escherichia coli, Pseudomona aeruginosa and Candida albicans. As the variance homogeneity and normality assumptions were not fulfilled, the non-parametric Kruskal Wallis test was used, to determine the existence of differences among the treatments depending on the inhibition halo. The propolis extracts from the two farms showed low MIC values for the evaluated microorganisms (between 0,07 and 0,15 mg/mL), with the exception of P. aeruginosa which was the most susceptible one (0,04 mg/mL). From the three tested dilutions: 100, 75 and 25 %, the first (belonging to the methanolic propolis extract from La Primavera farm) reached the highest inhibitory effect. The highest difference in the infrared spectra was found in the region interval from 2 000 a 500 cm-1 of the propolis belonging to the Indio Hatuey farm. It is concluded that the propolis extractions with methanol and ethanol allow to obtain natural products with high antimicrobial activity against the four evaluated microorganisms.
Keywords: Infrared spectroscopy, microorganisms, honey.
INTRODUCCIÓN
La integración de la crianza de las abejas de la tierra (meliponicultura) en la agroforestería se considera como una opción económica. La meliponicultura en Centroamérica y México es una actividad muy común, pero se lleva a cabo a pequeña escala y en forma tradicional, sin una tecnología avanzada; este procedimiento no constituye una barrera, y es una práctica conveniente a nivel de grupos con pocos recursos económicos. Además, sus mieles son preferidas a nivel local porque poseen propiedades medicinales, sustentadas por sus bajos recuentos microbiológicos y alta capacidad antimicrobiana, en especial la de Melipona beecheii (Landaverde et al., 2006).
El interés de introducir las abejas de la tierra en los sistemas agroforestales y fincas agroenergéticas radica en los beneficios que inducen como polinizadoras. Ellas colectan el néctar y el polen de las flores como fuente de energía y proteína. Cerca de la mitad de las 1 000 especies de plantas que son cultivadas en los trópicos para la alimentación y la producción de especias y medicinas son polinizadas por las abejas. Entre estas se encuentran la macadamia, el chayote, el coco, el achiote, la cebolla, la guayaba, el pejibaye, el tamarindo, el aguacate y los cítricos (Heard, 1999).
En su acción polinizadora las abejas acopian otros productos de las plantas que son usados como materia prima para elaborar el propóleo, que es un material resinoso y aromático que ellas elaboran a partir de exudados de diversas plantas. Su coloración varía en dependencia de su origen y edad (Wilson et al., 2015). Este subproducto de la colmena, además de constituir un material de construcción, es un «arma química» que las abejas utilizan contra los microorganismos patógenos, ya que al cubrir las paredes de la colmena favorecen la desinfección (Bankova, 2005a).
Basado en el uso práctico que las abejas le dan a este producto, se ha utilizado extensivamente por muchos años en la medicina tradicional. Se estima que 150 compuestos, muchos de ellos flavonoides, se han identificado en propóleos europeos (Yang et al., 2014; Figueiredo et al., 2015).
Según Bracho (2000), se emplean varios métodos para la caracterización del propóleo. Entre ellos se encuentra la cromatografía de capa delgada (Tang et al., 2014) y la espectroscopía infrarroja (Adib et al., 2014; González-Martín et al., 2015). Esta última es una técnica muy empleada para discriminar entre los extractos de propóleos puros y los adulterados (Wu et al., 2008), y también se ha usado para medir la calidad y la estabilidad de los productos basados en propóleos que se incorporan en la preservación de los alimentos (Cattaneo et al., 2014).
Entre los principales componentes de los propóleos se han identificado diversos metabolitos secundarios, como flavonoides, ésteres del ácido cafeico, diterpenos, benzofenonas y constituyentes volátiles, como los sesquiterpenos; además de sustancias de naturaleza proteica, ácidos grasos no saturados y ésteres de ácidos aromáticos (Barbariæ et al., 2011; Socha et al., 2014; Cottica et al., 2015).
Se ha informado que los propóleos poseen propiedades farmacológicas, bactericidas, antivirales, hepatoprotectoras, antinflamatorias, inmunomoduladoras, antioxidativas y analgésicas (Bankova, 2005b; Shi et al., 2012; Chan et al., 2013; Shpychak et al., 2015).
Sin embargo, hasta el momento se desconoce la actividad antimicrobiana que pueden presentar los propóleos obtenidos de las colmenas de M. beecheii, como valor agregado de las producciones de las fincas agroenergéticas; por lo que el objetivo de esta investigación fue determinar, mediante estudios in vitro, la actividad antimicrobiana de los extractos metanólico y etanólico de propóleos recolectados en dos fincas agroenergéticas de la provincia de Matanzas y conocer sus especificidades químicas mediante espectroscopía infrarroja.
MATERIALES Y MÉTODOS
Para evaluar la actividad antimicrobiana de los extractos de propóleo en cada una de las fincas, se utilizó un diseño de clasificación simple. Se emplearon diferentes microorganismos patógenos para evaluar la efectividad de los extractos.
Obtención de los extractos de propóleos metanólico y etanólico
Los propóleos se colectaron en las colmenas ubicadas en dos fincas agroenergéticas de la provincia de Matanzas (La Primavera- finca P e Indio Hatuey-finca IH), pertenecientes al proyecto BIOMAS-CUBA.
Los extractos etanólico y metanólico de los propóleos se obtuvieron resuspendiendo 20 g de cada propóleo en 30 mL de etanol y metanol (96 % (v/v)). La suspensión se decantó después de 48 h a temperatura ambiente. Los extractos se conservaron a 4 oC hasta su utilización.
Ensayo de microdilución
Preparación de los extractos y controles. Los extractos se prepararon utilizando etanol y metanol a una concentración de 4 mg/mL en medio de cultivo Mueller Hinton, con diluciones seriadas para ambos solventes desde 1 000 a 0,95 mg/mL. Para el bioensayo antibacterial se utilizaron como controles (50 mg/mL): ciprofloxacino, kanamicina, nistatina, clotrimazol, amoxicillina y cefalexina, adicionando 5 mL de cada uno. Además, se utilizaron controles de crecimiento de los microorganismos, con los solventes siguientes: control negativo 1 (CN1, referente al metanol), control negativo 2 (CN 2, referente al etanol) y un control de esterilidad del medio de cultivo Mueller Hinton para bacterias.
Preparación de los inóculos. Para la preparación de los inóculos se obtuvieron cultivos jóvenes de las cepas de bacterias Staphylococcus aureus, Escherichia coli, Pseudomona aeruginosa y la levadura Candida albicans en el medio sólido de Mueller Hinton. Las bacterias se incubaron en placas durante 24 h a 37 oC y la levadura durante 48 h a 28 oC. Para las bacterias se preparó una suspensión con las cepas al 0,5 en la escala de McFarland y una dilución de 1:50 con medio Mueller Hinton para obtener una suspensión de trabajo.
Método de perforaciones en agar. Después de la solidificación del medio, se hicieron seis perforaciones de 0,8 cm de diámetro, donde se colocaron 100 µL del extracto a evaluar y de los controles negativo y positivo, con 10 réplicas por tratamiento para cada microorganismo, y los extractos se probaron usando tres diluciones (100, 75 y 25 %).
Incubación, crecimiento microbiano y efecto inhibitorio. Las placas se incubaron a 37 oC durante 24 h en el caso de las bacterias y a 28 oC durante 48 h en el caso de la levadura, y después se evaluaron los resultados mediante la lectura (en milímetros) del diámetro del halo de inhibición del crecimiento de los microorganismos. El cálculo del porcentaje del efecto inhibitorio relativo respecto al control positivo se realizó de la manera siguiente:
Donde:
EI (%): efecto inhibitorio del extracto con respecto al control positivo.
MDHIE: media del diámetro del halo de inhibición del extracto.
MDHICP: media del diámetro del halo de inhibición del control positivo.
Caracterización por espectroscopía infrarroja
Las muestras se trituraron y se obtuvieron los espectros infrarrojos en el intervalo de 4 000 a 500 cm-1, con el empleo de pastillas de bromuro de potasio, en un espectrómetro infrarrojo con transformación de Fourier Bruker-TENSOR 27.
Procesamiento estadístico
La variable diámetro del halo de inhibición no cumplió los supuestos de homogeneidad de varianza y normalidad, por lo que para determinar la existencia de diferencia entre los tratamientos se realizó la prueba no paramétrica de Kruskal Wallis y se utilizó InfoStat (Di Rienzo et al., 2014).
RESULTADOS Y DISCUSIÓN
La concentración mínima inhibitoria (CMI) es definida como la concentración más baja de extracto que es capaz de inhibir el crecimiento celular.
Los extractos de propóleos metanólico y etanólico de M. beecheii mostraron bajos valores de CMI para los diferentes microorganismos (tabla 1). En el caso de P. aeruginosa, la bacteria más susceptible dentro del grupo de las Gram negativas, estos valores llegaron hasta 0,04 mg/mL en el extracto etanólico de la finca Indio Hatuey.
Los resultados de la actividad antimicrobiana de los extractos vegetales dependen de las características específicas de los principios activos presentes en ellos y de su solubilidad en los solventes empleados para la extracción. Esto explica el hallazgo de extractos activos solamente frente a hongos o solo frente a bacterias, ya sean Gram positivas o Gram negativas; o frente a ambos grupos de bacterias, cuando el extracto fue capaz de extraer una mezcla de componentes activos presentes en la planta (Rojas y Rodríguez, 2008).
De forma general, el extracto metanólico de propóleo de la finca Primavera en la dilución del 100 % fue el mejor tratamiento frente a los cuatros microorganismos evaluados (tablas 2 y 3), al presentar los mayores valores en los halos de inhibición. Además, S. aureus fue la bacteria Gram positiva más susceptible a este extracto, al mostrar los mayores halos de inhibición. Estos resultados coinciden con lo planteado por Krolicka et al. (2008) y Chouna et al. (2009), acerca de que las bacterias Gram positivas son más susceptibles que las Gram negativas, ya que la pared celular de las primeras es menos compleja y carece de una filtración efectiva para grandes moléculas, debido al tamaño de los poros en su envoltura celular, por lo que son menos selectivas.
Se obtuvieron los espectros infrarrojos de cada propóleo, se compararon entre sí y se demostraron las diferencias que existían en su composición química (fig. 1). No se obtuvieron espectros con bandas muy intensas o bien definidas, como se esperaba en compuestos purificados o con alguna clase de tratamiento previo, debido a que la muestra es una matriz compleja formada por un gran número de compuestos de diferente composición química; sin embargo, se notaron marcadas diferencias entre las muestras de cada finca, lo que demostró que existía variación en su composición química. Además, aparecieron algunas bandas que brindan información de las especies químicas que conforman estos propóleos.
Las mayores diferencias en los espectros se encontraron en el intervalo de la región de 2 500 a 500 cm-1, principalmente las bandas que aparecen a 2 510,26; 1 034,77; 874,68 y 668,31 cm-1, en el propóleo proveniente de la finca Indio Hatuey (tabla 4), correspondientes a vibraciones de valencia entre los enlaces simples y dobles, muy fuertemente acopladas, como son íC-O o íC-F; además de vibraciones de doblajes fuera del plano y vibraciones de valencia de baja energía, como son ³ CH de olefinas y aromáticos, ³ OH presentes en alcoholes y ácidos asociados o ³ NH presentes en aminas y amidas asociadas, lo cual indica que este propóleo presenta mayor contenido de este tipo de compuesto que el de la finca La Primavera.
En 1 450 cm-1 se observó una banda de intensidad media asignada a la vibración de valencia del enlace C ≈ C (νC ≈ C) de anillos aromáticos, además de una banda en 1 034 cm-1 asignada a ½C-O; todos estos grupos están presentes en algunos de los compuestos responsables de la actividad biológica de los propóleos, como son los flavonoides y antraquinonas (Moþ et al., 2011; Figueiredo et al., 2015). Además, se observó otra banda a 1 709 cm-1, propia de la banda de estiramiento del enlace C = O (νC = O) correspondiente a grupos de cetonas o aldehídos, posibles sustituyentes de los terpenos, compuestos a los que se atribuyen también propiedades antimicrobianas (Silva Frozza et al., 2013); lo que explicaría los resultados referentes al diámetro de los halos de inhibición que mostraron los extractos metanólicos y etanólicos provenientes de las dos fincas (tablas 2 y 3), y sobre todo el resultado del primer extracto perteneciente a la finca La Primavera.
CONCLUSIONES
Las extracciones de los propóleos con metanol y etanol permitieron obtener productos naturales con elevada actividad antimicrobiana frente a los cuatro microorganismos evaluados.
El extracto con metanol del propóleo de la finca La Primavera presentó un mayor efecto inhibitorio, y Staphylococcus aureus fue la bacteria más susceptible a este tratamiento.
Los espectros infrarrojos de los propóleos permitieron identificar grupos funcionales presentes en algunos de los compuestos químicos, como flavonoides, antraquinonas y terpenos, responsables de la actividad antimicrobiana de este subproducto de la colmena de M. beecheii.
REFERENCIAS BIBLIOGRÁFICAS
1. Adib, A. M.; Jamaludin, F.; Kiong, L. S.; Hashim, N. & Abdullah, Z. Two-dimensional correlation infrared spectroscopy applied to analyzing and identifying the extracts of Baeckea frutescens medicinal materials. J. Pharmaceut. Biomed. 96:104-110, 2014.
2. Bankova, Vassya. Chemical diversity of propolis and the problem of standardization. J. Ethnopharmacol. 100 (1-2):114-117, 2005b.
3. Bankova, Vassya. Recent trends and important developments in propolis research. Evid. Based Complement. Alternat. Med. 2 (1):29-32, 2005a.
4. Barbariæ, Monika; Miškoviæ, Katarina; Bojiæ, M.; Lonèar, Mirela B.; Smolèiæ-Bubalo, Asja; Debeljak, Ž. et al. Chemical composition of the ethanolic propolis extracts and its effect on HeLa cells. J. Ethnopharmacol. 135 (3):772-778, 2011.
5. Bracho, J. C. Constituyentes volátiles de propóleo: realidad acerca de su rica composición química. Boletín de la Sociedad Química del Perú. 66 (4):198-209, 2000.
6. Cattaneo, Tiziana M. P.; Cremonesib, Katia & Barzaghib, Stefania. The applicability of near infrared spectroscopy for monitoring properties of food packaging materials. NIR news. 25 (1):7-10, 2014.
7. Cottica, Solange M.; Sabbik, H.; Antoine, Céline; Fortin, J.; Graveline, Nancy; Visentainer, J. V. et al. Characterization of Canadian propolis fractions obtained from two-step sequential extraction. LWT-Food Sci. Technol. 60 (1):609-614, 2015.
8. Chan, G. C. F.; Cheung, K. W. & Sze, D. M. Y. The immunomodulatory and anticancer properties of propolis. Clin. Rev. Allerg. Immu. 44 (3):262-273, 2013.
9. Chouna, J. R.; Nkeng-Efouet, P. A.; Lenta, B. N.; Devkota, K. P.; Neumann, B.; Stammler, H. G. et al. Antibacterial endiandric acid derivatives from Beilschmiedia anacardioides. Phytochemistry. 70 (5):684-688, 2009.
10. Di Rienzo, J. A.; Casanoves, F.; Balzarini, M. G.; González, L.; Tablada, M. & Robledo, C. W. InfoStat, versión 2014. Córdoba, Argentina: Grupo InfoStat, FCA. Universidad Nacional de Córdoba, 2014.
11. Figueiredo, F. J. B.; Dias-Souza, M. V.; Nascimento, E. A. & Lima, L. R. P. de. Physicochemical characterization and flavonoid contents of artisanal Brazilian green propolis. Int. J. Pharm. Pharm. Sci. 7 (3):64-68, 2015.
12. González-Martín, M. I.; Escuredo, O.; Revilla, I.; Vivar-Quintana, A. M.; Coello, M. C.; Riocerezo, C. P. et al. Determination of the mineral composition and toxic element contents of propolis by near infrared spectroscopy. Sensors (Basel). 15 (11):27854-27868, 2015.
13. Heard, T. A. The role of stingless bees in crop pollination. Annu. Rev. Entomol. 44:183-206, 1999.
14. Krolicka, A.; Szpitter, A.; Gilgenast, E.; Romanik, G.; Kaminski, M. & Lojkowska, E. Stimulation of antibacterial naphthoquinones and flavonoids accumulation in carnivorous plants grown in vitro by addition of elicitors. Enzyme Microb. Tech. 42 (3):216-221, 2008.
15. Landaverde, V.; Zamora, L. G. & Aguilar, I. Determinación de carga microbiológica y actividad antimicrobiana de mieles de Melipona beecheii, en Costa Rica. Notas Apícolas Costarricenses. 11:40-42, 2006.
16. Moþ, A. C.; Silaghi-Dumitrescu, R. & Sârbu, C. Rapid and effective evaluation of the antioxidant capacity of propolis extracts using DPPH bleaching kinetic profiles, FT-IR and UV-vis spectroscopic data. J. Food Comp. Anal. 24 (4-5):516-522, 2011.
17. Rojas, Nidia M. & Rodríguez, Mónica. Actividad antimicrobiana de Tectona grandis L. f., Bursera simaruba (L.) Sarg. y Cedrela odorata L. Rev. Cubana Plant. Med. 13 (4). http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028 -47962008000400005&lng=en&nrm= iso&tlng=es, 2008.
18. Shi, H.; Yang, H.; Zhang, X. & Yu, L. Identification and quantification of phytochemical composition and anti-inflammatory and radical scavenging properties of methanolic extracts of Chinese propolis. J. Agr. Food Chem. 60 (50):12403-12410, 2012.
19. Shpychak, S.; Tikhonov, O. I.; Zupanets, I. A. & Shebeko, S. K. The experimental study of the anti-inflammatory properties of combined aerosols with the propolis phenolic hydrophobic drug. Pharma. Innovation. 4 (3, Part A):78-81, 2015.
20. Silva Frozza, Caroline O. da; Garcia, Charlene S. C.; Gambato, Gabriela; Souza, Marcia D. O. de; Salvador, Mirian; Moura, Sidnei et al. Chemical characterization, antioxidant and cytotoxic activities of Brazilian red propolis. Food Chem. Toxicol. 52:137-142, 2013.
21. Socha, R.; Ga³kowska, Dorota; Bugaj, Ma³gorzata & Juszczak, L. Phenolic composition and antioxidant activity of propolis from various regions of Poland. Nat. Prod. Res. 29 (5):416-422, 2014.
22. Tang, T. X.; Guo, W. Y.; Xu, Y.; Zhang, S. M.; Xu, X. J.; Wang, D. M. et al. Thin layer chromatographic identification of chinese propolis using chemometric fingerprinting. Phytochem. Analysis. 25 (3):266-272, 2014.
23. Wilson, M. B.; Brinkman, D.; Spivak, M.; Gardner, G. & Cohen, J. D. Regional variation in composition and antimicrobial activity of US propolis against Paenibacillus larvae and Ascosphaera apis. J. Invertebr. Pathol. 124:44-50, 2015.
24. Wu, Y. W.; Sun, S. Q.; Zhao, J.; Li, Y. & Zhou, Q. Rapid discrimination of extracts of Chinese propolis and poplar buds by FT-IR and 2D IR correlation spectroscopy. J. Mol. Struct. 883:48-54, 2008.
25. Yang, S. J.; Wu, J. J.; Wang, Y. C.; Huang, C. F.; Wu, T. M.; Shieh, C. J. et al. Encapsulation of propolis flavonoids in a water soluble polymer using pressurized carbon dioxide anti-solvent crystallization. J. Supercrit. Fluids. 94:138-146, 2014.
Recibido el 5 de marzo de 2015
Aceptado el 14 de marzo de 2016