Introducción
Elaeagnus angustifolia L. es miembro de la familia Elaeagnaceae. Su nombre común es olivo ruso, olivo de Bohemia u olivillo. Esta especie es un arbusto naturalizado en el Valle Medio, Río Negro, Argentina, que se encuentra con frecuencia en hábitats ribereños. Estudios anatómicos y morfológicos detallados revelaron heteromorfología de la hoja entre los diferentes niveles de la canopea (Klich, 2000).
La literatura describe la composición y las aplicaciones de los extractos de E. angustifolia. Específicamente, esta especie es muy valorada por sus aplicaciones terapéuticas médicas (Amiri Tehranizadeh et al., 2016). Los estudios científicos acerca de sus usos farmacológicos están documentados (Farzaei et al., 2015, Hamidpour et al., 2017). Además, E. angustifolia es parte de la dieta de los animales rumiantes en los campos de pastizales, y es muy apreciada como recurso forrajero, debido al alto contenido de proteínas. Las observaciones de herbivoría en la canopea de E. angustifolia revelaron gran variabilidad a escala espacial en individuos en etapa reproductiva (Klich et al., 2018).
Los bovinos exhibieron preferencia por los tirsos proliferantes de la canopea externa (ramas fructificantes pendulares), que son muy ramoneadas, en comparación con las hojas desarrolladas en las ramas de la canopea interior, que los animales no consumen.
Como se indicó anteriormente, hay varias características de las hojas que se podrían relacionar con el patrón de consumo observado en la canopea de los árboles (Klich, 2000), aunque también se conoce el efecto, beneficioso o perjudical, que tienen algunos compuestos secundarios de las plantas, como son los polifenoles y taninos, en la salud y nutrición de los animales (Frutos et al., 2004). Este es un tema complejo, que depende principalmente de la tasa de consumo y de la naturaleza química de estos compuestos. Junto con otros metabolitos secundarios de las plantas, como alcaloides, saponinas y esteroides, estos compuestos desempeñan una función importante en la protección de las plantas de la herbivoría.
Los atributos nutricionales de E. angustifolia se han referido en investigaciones anteriores (Klich et al., 2018). Sin embargo, se dispone de poca o ninguna información en la literatura acerca de la presencia y los efectos de sus compuestos secundarios, ya descritos en la nutrición de los rumiantes.
La palatabilidad diferencial y la preferencia bovina con respecto a la distribución espacial de la oferta de forraje de E. angustifolia pueden estar relacionadas con la presencia de estos compuestos secundarios.
Si bien se ha descrito que los compuestos bioactivos presentes en E. angustifolia tienen posibles efectos beneficiosos para los humanos, merecen ser estudiados en mayor detalle por sus propiedades sobre la nutrición animal, al considerar la importancia de este recurso forrajero en los pastizales semiáridos. Los ganaderos en regiones con sequías recurrentes de verano, que perjudican el crecimiento de la vegetación nativa, pueden aprovechar la presencia de recursos como E. angustifolia, como reserva forrajera en calidad y cantidad.
Se han realizado varios ensayos con el objetivo de caracterizar las variaciones en el contenido de fenoles en las diferentes porciones comestibles y no comestibles de E. angustifolia durante el ciclo de crecimiento de la planta.
Materiales y Métodos
Área de estudio. Este estudio se realizó en la Escuela de Veterinaria de la Universidad Nacional de Río Negro (UNRN), Argentina. Esta región fitogeográfica se llama monte (Cabrera, 1976), con matorral estepario dominado por arbustos xerófilos micrófilos como vegetación predominante.
Clima. La región es semiárida, sujeta a un amplio rango de temperatura diaria y estacional. Sus valores promedio fluctúan de 6,83 ºC en el mes más frío (julio) a 23,0 ºC en el más caluroso (enero). La precipitación media anual es de 303 mm.
Colección y procesamiento de las muestras de E. angustifolia. La recolección de material vegetal se llevó a cabo entre septiembre de 2017, etapa vegetativa, hasta finales de marzo de 2018. Se realizaron cinco muestreos (septiembre, noviembre, enero, febrero y marzo). Para ello se tomaron manualmente muestras de hojas, flores y frutos de la canopea externa, expuesta al sol. Se recolectó material hasta los 2,5 m, considerada la altura máxima que puede alcanzar el animal de los tirsos o ramas fructificantes. La parte rechazada, en cambio, se recolectó de la canopea interior sombreada (<1 m de altura). En todos los momentos de recolección se reunió material de diez árboles maduros, bien desarrollados y seleccionados al azar (8-9 m de altura) para obtener un mínimo de 5 kg de peso fresco de material.
Todas las muestras se secaron a temperaturas entre 40 y 45 °C hasta alcanzar peso constante, y contenido de humedad en torno al 3 y 4 %. Posteriormente, se guardaron en recipientes herméticos para su análisis. Para evitar durante el proceso de deshidratación la degradación de los compuestos biológicamente activos, que también pueden exhibir propiedades antioxidantes, se utilizaron bajas temperaturas (Wojdyło et al., 2019).
Antes de la preparación del extracto acuoso, el material seco se pulverizó en un molinillo (con un tamiz de abertura de 1 mm).
Extracción. Los extractos de plantas se obtuvieron mediante agitación magnética de 1 g de materia seca pulverizada con 60 mL de disolvente (agua destilada) durante 30 minutos a 60 °C en un matraz Erlenmeyer. Las soluciones obtenidas se filtraron a través de papel Whatman número 1 y se almacenaron a 4 °C hasta su análisis.
Análisis cualitativo. Se evaluó la presencia de polifenoles en las diferentes muestras recolectadas mediante un ensayo colorimétrico sobre la base de la formación de un complejo coloreado en presencia del reactivo FeCl3. A 5 mL del extracto acuoso se añadieron cinco gotas de cloruro férrico al 1 % para evaluar la formación de una coloración verde parduzco o azul-violácea, indicadora de la presencia de taninos (Edeoga, 2005).
Contenido de fenoles totales. El contenido fenólico total (CFT) de los extractos de cada órgano se determinó con el reactivo de Folin-Ciocalteau (Singleton y Rossi 1965, Makkar, 2000) con algunas modificaciones. Se mezclaron alícuotas de 20 μl de la muestra con 1,58 mL de agua, 100 μl de reactivo de fenol de Folin-Ciocalteau diluido 10 veces y, finalmente, con 300 μl de Na2CO3 al 20 %. La mezcla de reacción se mezcló completamente y se dejó que permaneciera a 40 ºC en baño María durante 30 minutos en oscuridad. Después de la incubación, se midió la absorbancia de todas las soluciones de muestra a una longitud de onda de 765 nm. Se utilizó para ello un espectrofotómetro (“Biotraza” 722 Visible), y se comparó con la curva de calibración de equivalentes de ácido gálico (r2 = 0,9913). El contenido fenólico total se expresó en mg equivalentes de ácido gálico por gramo de materia seca (mg EAG g-1 de MS). Todas las muestras se analizaron por triplicado.
Análisis estadístico. Los datos se analizaron mediante el análisis de varianza, con previa comprobación de los supuestos de normalidad y homogeneidad de varianza. Las diferencias significativas entre el contenido fenólico de las porciones comestibles y no comestibles se compararon con la prueba de Tukey para p < 0,05. Los datos se procesaron con el software estadístico Infostat® (Di Rienzo et al., 2017). Los valores se expresaron como medias ± errores estándar.
Resultados y Discusión
Los datos mostraron que las hojas, las flores y los frutos contenían fenoles. La prueba colorimétrica empleada reveló que los taninos más abundantes en todas las muestras y momentos evaluados se corresponden con los del tipo taninos condensados (color pardo verdoso, figura 1 a, b y d). Se detectaron taninos de tipo hidrolizable en las flores y los frutos en el muestreo de enero (pulpa y hueso de la semilla, figura 1 c). En este período, los frutos desarrollados en los tirsos no están completamente maduros y las semillas en su interior son blandas y digestibles por las vacas. En este muestreo se observó coloración azul-violácea. En las flores y semillas, el color que se desarrolló al adicionar el cloruro férrico fue azul grisáceo. La pulpa del fruto, obtenido en febrero y marzo, mostró un ligero color azul grisáceo (figura 1 c).
En cambio, la composición de taninos en las hojas (ya sea del tirso soleado u hojas sombreadas) durante todas las etapas fue de tipo condensado (color verde parduzco, figura 1 a y b).
La tabla 1 muestra el contenido fenólico de las partes comestibles y no comestibles de E. angustifolia durante sus etapas de desarrollo. Se encontraron diferencias significativas (p < 0,05) en el contenido de polifenoles entre las hojas externas soleadas y las interiores sombreadas en el muestreo de septiembre. Desde la floración hasta la etapa de fructificación, el contenido fenólico entre el tirso completo y las hojas internas sombreadas no mostró diferencias significativas.
Tabla 1 Variación del contenido fenólico durante los momentos de muestreo de E. angustifolia (mg EAG g-1 de MS).
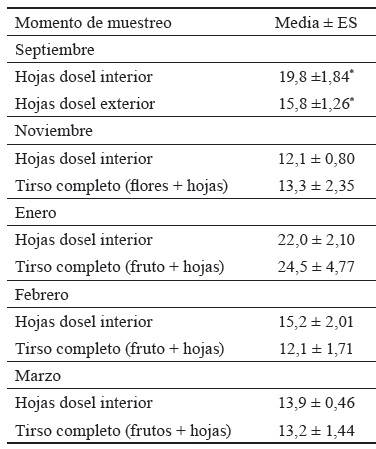
*p < 0,05
EAG: equivalentes de ácido gálico
Otra fuente de variación en el contenido de polifenoles son los cambios temporales en la acumulación de compuestos secundarios de plantas, que comprenden dos tipos: ontogenéticos y estacionales. Las etapas ontogénicas en E. angustifolia incluyen plántulas y plantas juveniles (ambas no comestibles para rumiantes), y las plantas reproductivas maduras, caracterizadas por el desarrollo de tirsos proliferantes en las ramas superiores. Cada etapa se caracterizó por atributos anatómicos, morfológicos y bioquímicos distintivos (Koricheva y Barton, 2012). Factores ambientales como la temperatura, humedad, luz y el suministro de agua, minerales y CO2, también influyen en el crecimiento de las plantas y tienen efecto directo en las vías bioquímicas que afectan el metabolismo de sus compuestos secundarios.
En general, los taninos son más abundantes en las partes de la planta susceptibles de ser consumidas, por ejemplo, nuevas hojas y flores (Terril, 1992), y se consideran un factor de defensa de la herbivoría. Este podría no ser el caso de E. angustifolia, porque sus partes más apetecibles para los rumiantes no mostraron diferencias significativas en el contenido de fenoles con respecto a las partes rechazadas.
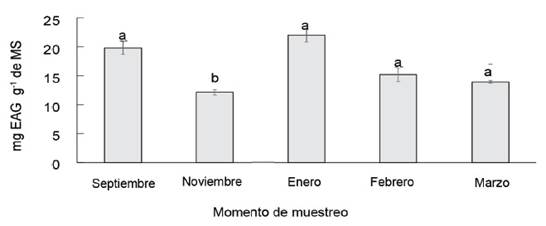
Las fluctuaciones estacionales en el contenido de taninos en las hojas vegetativas de E. angustifolia (plantas juveniles) se han abordado antes en la literatura (Zeng et al., 2009). Se encontró un ciclo estacional del contenido polifenólico en las hojas sombreadas de E. angustifolia desarrollado en la canopea inferior (figura 2). El promedio fue alto en la etapa vegetativa (septiembre) y de formación inicial de frutos (enero), con valores medios de 19,75 y 21,97 mg·EAG g-1 de MS, respectivamente, con diferencias significativas en los muestreos de noviembre, febrero y marzo.
Los resultados mostraron que los cambios en el contenido de fenoles entre las hojas internas sombreadas de E. angustifolia tuvieron una característica de doble pico, lo que estuvo en concordancia con el momento de la acumulación de metabolitos secundarios en la planta (Koricheva y Barton, 2012). Este patrón no se encontró en el follaje externo soleado durante las etapas de desarrollo (figura 3).

Figura 3 Variaciones estacionales del contenido fenólico en los tirsos sombreados de E. angustifolia.
Cuando el fruto está próximo a la madurez completa, no se encontraron diferencias significativas en el contenido de taninos de tipo hidrolizable en febrero y marzo (10,85 y 12,77 mg EAG g-1 de MS, respectivamente), ni en los taninos presentes en la semilla (14,19 y 14,36 mg EAG g-1 de MS, respectivamente). El desarrollo de la intensidad del color con el reactivo de cloruro férrico mostró correlación positiva con respecto a los resultados obtenidos en el ensayo cuantitativo.
Conclusiones
Se determinó variación estacional y espacial en la concentración de fenoles totales en la biomasa comestible y no comestible de E. angustifolia durante su ciclo de crecimiento.
No se encontraron cantidades limitantes de polifenoles (> 55 g kg-1 de MS) en las hojas sombreadas, que pudieran reducir el consumo voluntario de alimento y su digestibilidad. Además, la variación estacional en el contenido de fenol estuvo en el rango beneficioso (20-45 g kg-1 de MS).