INTRODUCCIÓN
Morus alba L. es una planta forrajera, perteneciente a la familia Moraceae, introducida en Cuba por sus excelentes cualidades nutricionales en la alimentación de diferentes especies de animales (Noda-Leyva y Martín-Martín, 2017). Se destaca por sus altos rendimientos. En diferentes condiciones edafoclimáticas produce entre 10 y 12 t de MS/ha al año, contiene de 20 a 25 % de proteína bruta y la digestibilidad de MS es superior a 80 % (Martín et al., 2014).
Se trata de un cultivo que contribuye al control de la erosión del suelo. Se ha informado acerca de las potencialidades de M. alba como planta comestible y se recomienda el consumo de sus hojas tiernas (Pentón et al., 2007). Se destacan también sus posibilidades de empleo en la industria vinatera y como colorante de productos alimenticios y confituras. Se reconoce por su valor comercial en la industria cosmética. Por sus propiedades fitoquímicas antioxidantes e hipoglucemiantes ha sido utilizada ampliamente en la producción de medicamentos (Huh et al., 2017).
El interés creciente por el cultivo de M. alba exige la búsqueda de alternativas para la conservación del germoplasma de esta especie en Cuba. Se sabe que la conservación de los recursos fitogenéticos garantiza su posible utilización como fuente de variación genética potencialmente útil, a la vez que evita la pérdida de diversidad genética en la agricultura, con la consiguiente reducción del material vegetal disponible para las generaciones presentes y futuras. Al respecto, Arrigoni-Blank et al. (2014) plantean que la conservación de la diversidad contenida en un germoplasma es la base de todo programa de mejoramiento genético, lo que se refleja en la creación de plantas con resistencia o tolerancia a diversos factores bióticos y abióticos, para asegurar una mayor productividad.
La conservación del germoplasma de M. alba se realiza de diferentes maneras. Puede ser in situ, es decir, en los lugares donde crece de forma natural, y se puede realizar ex situ mediante los bancos de germoplasma, ubicados en el campo, en macetas o en invernaderos (Zhang et al., 2019). También se han utilizado los métodos in vitro (Arias-Padró et al., 2012; Vijayan y Sangannavar, 2020).
La conservación in vitro se ha perfilado como una alternativa valiosa para la preservación del germoplasma vegetal. Esta forma de preservar el material vegetal libera las plantas de los riesgos que se producen en el campo, reduce los costos, asegura el mantenimiento de la fidelidad genética y facilita el intercambio de germoplasma (Arrigoni-Blank et al., 2014).
Existen dos formas principales para realizar la conservación in vitro: la conservación por mínimo crecimiento y la crioconservación. La primera de ellas tiene como objetivo disminuir el crecimiento de las plantas in vitro mediante la disminución del metabolismo y la división celular, para lo que se alteran las condiciones óptimas de cultivo y la composición del medio del cultivo (González-Arnao et al., 2017). Entre las alteraciones en la composición de los medios de cultivo son más frecuentes la reducción de los nutrientes minerales y la adición de reguladores del crecimiento y reguladores osmóticos (Jiménez-Mariña et al., 2016; Kovalchuk et al., 2018).
El germoplasma de M. alba disponible en Cuba comprende, aproximadamente, 22 variedades, que se conservan en la Estación Experimental de Pastos y Forrajes Indio Hatuey, introducidas desde Costa Rica, Etiopía, Brasil, Corea del Sur, China y España (Reino-Molina et al., 2017). Se preserva en bancos de germoplasma en el campo, con el riesgo de pérdida por desastres naturales y por el ataque de plagas y enfermedades, situación que exige la búsqueda de alternativas para garantizar su conservación.
La revisión bibliográfica dejó ver que el método más utilizado para la conservación por mínimo crecimiento del género Morus es la disminución de la temperatura. No se encontraron resultados relacionados con el uso de osmorreguladores, la reducción del contenido de nutrientes u otros cambios en la composición del medio de cultivo o en las condiciones ambientales de conservación. Es por ello que para justificar los resultados obtenidos en el presente trabajo se utilizaron investigaciones realizadas en otros cultivos, y que tienen que ver con el uso del manitol y el manejo de las sales minerales para la conservación in vitro.
Este estudio se realizó con el propósito de evaluar el efecto de las sales minerales y el uso de manitol en la conservación in vitro de M. alba, variedad Acorazonada.
MATERIALES Y MÉTODOS
Localización. La investigación se desarrolló en el Centro de Estudios de Biotecnología Vegetal de la Universidad de Granma, en el período comprendido entre enero 2020 y septiembre 2020. Se utilizó la variedad Acorazonada, proveniente del banco de germoplasma del Centro de Estudios de Biotecnología Vegetal de la Universidad de Granma.
Material vegetal y medios de cultivo. Para el establecimiento in vitro se utilizaron como explantes segmentos nodales de 1,5-2,0 cm de longitud, que proceden de brotes obtenidos de estacas brotadas en condiciones semicontroladas. Se desinfectaron superficialmente con hipoclorito de sodio al 1 % de cloro activo durante 20 min. y posteriormente se enjuagaron cuatro veces con agua destilada estéril en condiciones asépticas. En todos los experimentos se utilizó como medio de cultivo basal (MB) las sales y vitaminas MS (Murashige y Skoog, 1962), 6-BAP (6-bencilaminopurina) 0,5 mg L-1, ANA (ácido naftalenacético) 0,5 mg L-1 y 30,0 g L-1 de sacarosa, solidificado con 6,0 g L-1 de agar E (Biocen) y pH de 5,7 (Salas et al., 2011). Los explantes se incubaron a 25 ± 2 ° C, con un régimen de 16 horas de luz y densidad de flujo de fotones fotosintéticos (DFFF) de 62-68 µmol m-2s-1) y ocho horas de oscuridad, durante 30 días.
La multiplicación del material vegetal se realizó en un medio de cultivo similar al descrito para la etapa de establecimiento in vitro. Se llevaron a cabo tres subcultivos hasta disponer de la cantidad de material vegetal necesario para realizar los experimentos de conservación que se describen seguidamente.
Experimento 1. Efecto de las sales minerales en el cultivo in vitro de M. alba. Se distribuyó el contenido de sales minerales (sales macros) del medio de cultivo MS (Murashige y Skoog, 1962) y se conformaron los tratamientos siguientes: T1) sales MS al 25 %, T2) sales MS al 50 %, T3) sales MS al 75 % y T4) sales MS al 100 %. Se estableció como control el T4, que contenía el medio de cultivo basal con las sales al 100 % de su concentración.
Experimento 2. Efecto del manitol en la conservación in vitro de M. alba. Se evaluaron diferentes concentraciones de manitol en el medio de cultivo y se conformaron los tratamientos siguientes: T1) medio basal, T2) medio basal + manitol (5,0 g L-1), T3) medio basal + manitol (10,0 g L-1) y T4) medio basal + manitol (15,0 g L-1). Se estableció como control el T1, que contenía el medio de cultivo basal sin manitol.
Diseño experimental. En los dos experimentos se aplicó un diseño completamente aleatorizado y se utilizaron cinco tubos por tratamiento, para un total de 30 tubos por ensayo (150 x 25 mm), con 10 mL de medio de cultivo y un explante por tubo.
Mediciones. A los seis meses se evaluó la supervivencia de los explantes (cálculo de porcentaje a partir del número de explantes vivos) por observación visual. Se midió la longitud de los brotes (cm) mediante una regla graduada y se cuantificó el número de hojas activas (hojas verdes).
Análisis estadístico. La normalidad de los datos se comprobó por la prueba de Kolmogorov-Smirnov y la homogeneidad de las varianzas, por el test de Levene. Como hubo normalidad y homogeneidad de varianza, se realizó un análisis de varianza simple. En los casos donde existieron diferencias significativas entre las medias, se aplicó la prueba de comparación múltiple de rango de Tukey (p = 0,05). Las variables, expresadas en por ciento, se procesaron mediante un análisis de diferencias de proporciones. Se utilizó el paquete estadístico Infostat 2017 (Di Rienzo et al., 2017).
RESULTADOS Y DISCUSIÓN
Durante los tres primeros meses de conservación, los explantes mostraron en todos los tratamientos muy buenas condiciones físicas: hojas de color verde, totalmente extendidas, prácticamente todas en estado activo y sin síntomas de hiperhidricidad. Sin embargo, una vez que transcurrieron seis meses, las condiciones físicas de los explantes estaban muy deterioradas en todos los tratamientos. La supervivencia se afectó en todos (tabla 1), con valores significativamente inferiores al utilizar las sales al 25 %. Los tratamientos donde se utilizaron las sales minerales al 50 % de su concentración o más, no mostraron diferencias significativas entre sí.
Tabla 1 Efecto de la concentración de las sales minerales en el medio de cultivo en la conservación in vitro de M. alba, variedad Acorazonada.
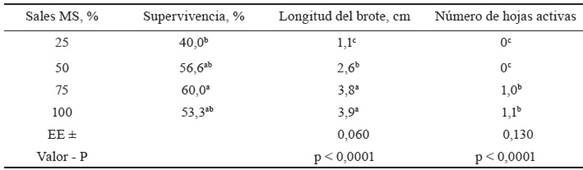
Medias con letras diferentes por columna difieren significativamente, según prueba de Tukey (p < 0,05)
EE: error estándar
La longitud del brote fue significativamente superior en los tratamientos con mayor concentración de sales minerales (75 y 100 %). En el tratamiento con las sales al 25 %, la longitud de los brotes fue significativamente menor al resto de los tratamientos. El número de hojas activas a los seis meses de cultivo disminuyó drásticamente en todos los tratamientos, y llegó a cero en los que tuvieron menores concentraciones de sales (25 y 50 %). Los brotes mostraron un color verde, pero prácticamente sin hojas, resultado que permite suponer que la concentración de nutrientes es muy baja para abastecer los brotes.
Los resultados de este experimento muestran una marcada influencia de la concentración de las sales inorgánicas del medio de cultivo en la supervivencia y desarrollo de las plantas in vitro de M. alba, variedad Acorazonada. Hubo una tendencia general a disminuir el valor de las variables morfológicas, a medida que se redujo la concentración de sales inorgánicas. Al respecto, Kovalchuk et al. (2018) reconocen que los nutrientes minerales se encuentran entre los principales componentes de los medios de cultivo utilizados en el cultivo de tejidos vegetales.
Martínez-Villegas et al. (2015) plantean que el efecto de la concentración de sales inorgánicas en el crecimiento de los explantes está muy relacionado con el potencial osmótico del medio de cultivo. Señalan que a medida que dicho potencial se reduce es menor la absorción de agua y nutrientes, lo que dificulta el crecimiento y multiplicación de los brotes. No obstante, se considera que en esta investigación las concentraciones de sales minerales utilizadas no generan un potencial hídrico que afecte la absorción de agua y nutrientes, y atribuyen las diferencias en el crecimiento de los explantes a la disponibilidad de nutrientes en los medios de cultivos evaluados.
Estos resultados coinciden con los de Castilla-Valdés et al. (2020), quienes obtuvieron a los seis meses de conservación in vitro de Coffea arabica L valores significativamente menores, en cuanto a supervivencia y número de pares de hojas en los medios de cultivo. Los autores citados utilizaron las sales nutrientes al 25 y 50 %, a diferencia de otros tratamientos con mayor concentración de sales. Concuerdan también con los resultados del presente estudio los trabajos de Jiménez-Mariña et al. (2016) durante la conservación in vitro de clavel español (Dianthus caryophyllus L.), al obtener diferencias significativas en la supervivencia de las plantas cultivadas en medio de cultivo con las sales MS, reducidas al 25 % de su concentración en comparación con el resto de los tratamientos, después de tres meses de cultivo.
Efecto del manitol en la conservación in vitro de M. alba. La inclusión de manitol en el medio de cultivo no influyó en la supervivencia de los explantes. En la tabla 2 se muestra que no existieron diferencias estadísticas con respecto al tratamiento control ni entre las diferentes concentraciones de manitol evaluadas.
Tabla 2 Efecto del uso de manitol en la conservación in vitro de M. alba, variedad Acorazonada.
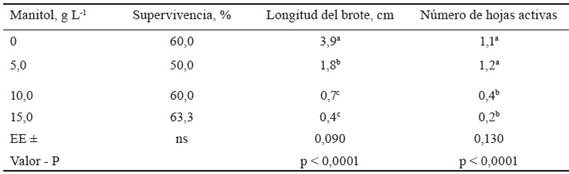
Medias con letras diferentes por columna difieren significativamente, según prueba de Tukey para p < 0,05
ns: No hay diferencias significativas.
Las concentraciones de manitol empleadas redujeron significativamente la longitud de los brotes y el número de hojas activas, con diferencias significativas entre ellas y con respecto al tratamiento control. Lo anterior se debe al efecto que provoca el manitol en la disminución del potencial osmótico e hídrico del medio de cultivo, lo cual dificulta la absorción de agua y nutrientes y ocasiona reducción en el crecimiento de la planta. Con relación a lo anteriormente expuesto, García-Águila et al. (2007) plantean que el manitol es un agente osmótico que ejerce su efecto limitante en el crecimiento de los explantes por reducción de la absorción de agua y nutrientes del medio de cultivo.
Las plantas in vitro en el momento de la evaluación mostraron tallos verdes, prácticamente sin hojas activas y con pérdidas de la yema apical en algunos casos. Los medios de cultivo en todos los tratamientos dejaron ver síntomas de fenolización.
Los resultados coinciden parcialmente con informes de otros autores que han referido el uso de manitol para la conservación in vitro de plantas. Rayas-Cabrera et al. (2019) encontraron que el uso de manitol a concentraciones de 1,0, 1,5 y 2,0 % en la conservación in vitro de dos cultivares de Ipomoea batatas (L.) Lam., redujo el crecimiento, sin afectar la supervivencia de las plantas conservadas durante ocho meses. Alvim et al. (2020) informaron la reducción del crecimiento de la parte aérea de la planta, al conservar in vitro Amburana cearensis (Allemão) A.C.Smith. (Fabaceae), especie nativa de Brasil, y la disminución de la supervivencia y el número de hojas activas a partir de los 120 días de cultivo en los medios con mayores concentraciones de manitol (1,6 y 2,4 %)
Rayas-Cabrera et al. (2020) al conservar in vitro cultivares de Dioscorea alata L. determinaron que el empleo de manitol a 1,5 % en el medio de cultivo favoreció la supervivencia y el número de brotes por explante. Estos autores reconocen que su uso incrementó la supervivencia del material conservado durante el proceso de la recuperación, efecto que se favorece también por la presencia de carbón activado en el medio de cultivo de conservación.
Los resultados obtenidos en la presente investigación indican que la inclusión de manitol en el medio de cultivo a las concentraciones evaluadas, aunque redujo el crecimiento, no mejoró la supervivencia y la condición física de los explantes. Esto sugiere la necesidad de evaluar la efectividad de este regulador osmótico con nuevas concentraciones, su combinación con otras sustancias y condiciones ambientales.
CONCLUSIONES
El medio de cultivo con las sales minerales al 50 %, 6-bencilaminopurina 0,5 mg L-1, ácido naftalenacético 0,5 mg L-1 y 30,0 g L-1 de sacarosa favorece la conservación in vitro de M. alba, variedad Acorazonada, durante seis meses. El empleo de manitol redujo el crecimiento, pero no mejoró la supervivencia y la condición física de los explantes durante su conservación in vitro.














