INTRODUCCIÓN
Rhipicephalus (Boophilus) microplus (Canestrini, 1887) (Acari: Ixodidae) se considera el ectoparásito de mayor importancia para la bovinocultura. Tiene una amplia distribución geográfica y se encuentra, principalmente, en los trópicos y subtrópicos. Afecta hasta 80 % de la población bovina en el mundo, debido a su capacidad para adaptarse a las más variadas condiciones ecológicas (Aguilar-Tipacamú et al., 2016; Ali et al., 2016).
La presencia de altas infestaciones de la garrapata R. (B.) microplus en los bovinos puede causar cambios en el equilibrio de la epidemiología de los patógenos y en sus respectivas enfermedades, Un ejemplo de ello lo constituye el cuadro conocido como tristeza parasitaria bovina (Santos et al., 2019).
La resistencia de las garrapatas a los antiparasitarios es uno de los mayores problemas que enfrenta el sector pecuario, debido a que la disponibilidad de estos productos es cada vez más escasa. El uso intensivo de estos productos químicos ha provocado la contaminación del suelo y el agua, la exposición de los trabajadores rurales y la presencia de residuos químicos en la leche y la carne, lo que causa preocupación en la sociedad y en las agencias gubernamentales (Torres-Acosta et al., 2015).
El uso de productos derivados de las plantas constituye una vía alternativa a los productos sintéticos que se utilizan para el control de insectos y ácaros. Esto se debe a la presencia de metabolitos secundarios, producidos como un mecanismo de defensa ante el estrés biótico y abiótico (Arceo-Medina et al., 2016; 2017).
Los compuestos bioactivos de origen botánico poseen ventajas como una alternativa a los productos de síntesis química, ya que tienen baja toxicidad, son solubles en agua y se degradan mejor en el ambiente, debido al efecto de la radiación solar y la humedad. Para su preparación se utilizan diferentes partes de las plantas (tallos, hojas, raíz, corteza, frutos, flores y semillas). Los aceites presentes en las especies vegetales se usan ampliamente por su actividad terapéutica, bactericida, fungicida e insecticida. Su eficacia puede variar en función de la época del año, la concentración de los metabolitos y las condiciones ambientales en las que se desarrollen las plantas (Adenubi et al., 2016; Barros et al., 2019).
Entre ellos se encuentran los provenientes de las semillas de Jatropha curcas L., que es una especie multipropósito, de origen tropical, perteneciente a la familia Euphorbiaceae (Toral-Pérez et al., 2016). J. curcas se considera una planta oleaginosa por el gran contenido de aceite que tienen sus semillas. Sin embargo, no se comercializa por los efectos tóxicos que se atribuyen a la presencia de ésteres de forbol y a una proteína tóxica llamada curcina (Lopera-Vélez et al., 2017).
La utilización de J. curcas en la medicina tradicional y su uso veterinario se han documentado en Asia, África y América Latina. Todas las partes de la planta tienen usos medicinales y son ampliamente utilizadas en el control de enfermedades, por sus propiedades como insecticida y fungicida (Valdés-Izaguirre et al., 2018). Sin embargo, la mayor cantidad de estudios acerca de esta planta se hallan vinculados a la salud humana y, en menor cuantía, a sus usos en la medicina veterinaria. De ahí la importancia de continuar las investigaciones acerca de las potencialidades de esta especie para la salud animal en condiciones tropicales.
El objetivo del trabajo fue evaluar la actividad repelente del aceite de las semillas de J. curcas, con diferentes períodos de almacenamiento en larvas de R. (B.) microplus.
MATERIALES Y MÉTODOS
Localización. La investigación se desarrolló en los laboratorios de parasitología y biotecnología de la Estación Experimental de Pastos y Forrajes Indio Hatuey (EEPFIH), que está ubicada en los 20o 50´ de latitud Norte y 79 32´ de longitud Oeste, en el municipio Perico, provincia de Matanzas, Cuba, a una altitud de 19 msnm. Se utilizaron larvas de la cepa Cayo Coco de R. (B.) microplus, obtenidas por el Laboratorio Nacional de Parasitología Veterinaria, perteneciente al municipio de San Antonio de los Baños, provincia Artemisa, Cuba.
Procedencia, obtención y caracterización del aceite de J. curcas. Para la extracción del aceite se colectaron frutos de J. curcas, procedentes de Cabo Verde, en la Granja Paraguay, Guantánamo, Cuba. Los frutos maduros se secaron al sol y se eliminó la corteza para obtener las semillas, según la metodología descrita por Sotolongo-Pérez et al. (2007). Se utilizaron aceites con dos períodos de almacenamiento: tres años (extracción en 2014) y un año (extracción en 2017). Los aceites se conservaron en envases plásticos, herméticamente cerrados, a temperatura ambiente y en un lugar oscuro hasta el inicio de las investigaciones.
Tratamiento y diseño experimental. Para la evaluación de la actividad repelente del aceite de semilla del fruto de J. curcas se utilizó un diseño experimental totalmente aleatorizado, con cuatro tratamientos, tres réplicas por tratamiento y 100 larvas por cada réplica. El ensayo tuvo una duración de 48 h. Los tratamientos evaluados fueron: T1) control negativo (agua destilada); T2) aceite de J. curcas, extracción en 2014, período de almacenamiento de tres años; T3) aceite de J. curcas, extracción en 2017, período de almacenamiento de un año y un control positivo Deltametrina (Butox®) en una dosis de 10 mg mL-1. Las concentraciones del aceite fueron de 0,5; 1,75; 2,5; 5 y 10 mg mL-1.
Procedimiento experimental. Para la obtención de las larvas se utilizaron animales donadores, infestados artificialmente y ubicados en condiciones de aislamiento sobre tableros de madera. A partir de los 28 días, las garrapatas repletas se colectaron, una vez que se desprendieron por sí solas. Se trasladaron al laboratorio, se lavaron con agua destilada clorada al 1 % y se secaron con toallas de papel. Posteriormente, se ubicaron en la incubadora para realizar la postura, eclosión de los huevos y obtención de las larvas. Se emplearon larvas de 21 días de edad y para la selección se tuvieron en cuenta las características descritas por Farias et al. (2012): presencia de un cuerpo íntegro, apariencia y motilidad normal. Para este experimento se usó la prueba de detección de sustancias con actividad repelente en larvas, descrita por Chagas y Rabelo (2012).
Se utilizaron palillos de madera de 25 cm de longitud, previamente ranurados a 5 cm, para determinar el área de mediciones. Los palillos se embebieron durante 15 min. en los 10 cm superiores de cada sustancia evaluada, que se encontraba almacenada en Erlenmeyer. Después de la inmersión, cada palillo de madera se insertó en vasos plásticos de 50 mL, previamente fundidos con parafina. Luego, se fijó sobre la base del vaso un círculo de papel filtro cuantitativo, de 12 cm de diámetro. El conjunto se colocó sobre placas Petri con 5 mL de agua en el fondo para evitar la fuga de las larvas. Con la ayuda de un asa de siembra, se ubicaron sobre el papel de filtro 100 larvas, aproximadamente (Chagas y Rabelo, 2012).
En función de la volatilización de los compuestos bioactivos, los tratamientos quedaron separados por una distancia mínima de 2 m. Mientras que los controles negativos y positivos se ubicaron en otras salas, para evitar interferencia de los resultados, a temperatura y humedad constante de 21 °C y 70 %, respectivamente. Además, se limitó el acceso de las personas al laboratorio para evitar la mezcla de olores externos con los de las sustancias evaluadas.
Mediciones experimentales. Las mediciones se realizaron en el Laboratorio de Biotecnología de la EEPFIH. Se consideraron las características organolépticas olor y color. Asimismo, se evaluaron las propiedades físico-químicas de los aceites (tabla 1): pH, densidad (kg m-3), humedad (%), índice de acidez (%) y viscosidad (mm2s-1). Para la determinación de las propiedades físico-químicas del aceite se consideraron las Normas ASTM/AOCS, según lo recomendado por Lafargue-Pérez et al. (2012).
Actividad repelente de los aceites. La actividad repelente se evaluó a las 2, 4, 8, 16 y 32 h. El conteo de larvas se realizó mediante cinta adhesiva doble, colectando las larvas para cada área de manera independiente. La lectura se realizó de la siguiente forma:
Área 1. Larvas que se encontraban en los primeros 5 cm del extremo de los palillos impregnados con la sustancia.
Área 2. Larvas que se encontraban en los siguientes 5 cm (entre 5 y 10 cm) del extremo de los palillos.
Área 3. Larvas que se encontraban en los 15 cm no impregnados de los palillos, en el papel de filtro y en la parafina.
Se determinó el porcentaje de distribución de las larvas para cada una de las áreas. A partir de la cantidad de larvas en el área 3, se calculó el porcentaje de repelencia en cada tratamiento, según la fórmula:
% de repelencia = [(larvas del área 3/total de larvas) x 100].
Análisis estadístico. Para el análisis del porcentaje de repelencia y de distribución de las larvas, al no cumplir con los supuestos del análisis de varianza, se utilizó la prueba no paramétrica de Kruskal-Wallis, con nivel de significación de 5 %. En el análisis estadístico se utilizó el paquete IBM® SPSS® Statistics versión 22.
RESULTADOS Y DISCUSIÓN
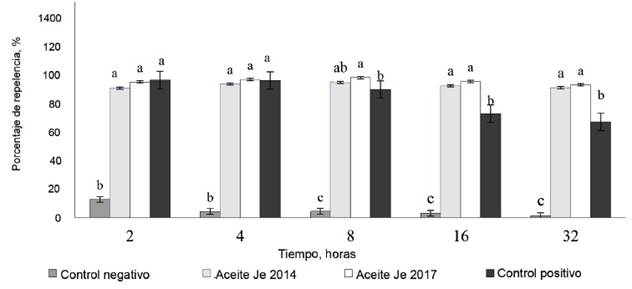
Actividad repelente del aceite de J. curcas ante larvas de R. (B.) microplus. La figura 1 muestra los porcentajes de repelencia para las sustancias evaluadas a las 2, 4, 8, 16 y 32 h, respectivamente. El análisis mostró diferencias significativas (p < 0,05) entre los tratamientos experimentales con respecto al control negativo (agua destilada).
La actividad repelente en los aceites fue elevada y el intervalo de 4-8 h fue el de mejores resultados, con valores de 93,9 y 97,3 % para el aceite 2014 y 2017 respectivamente, sin diferencias significativas entre ellos.
Según Chagas y Dias (2012), los trabajos que abordan los efectos repelentes ante larvas de R. (B.) microplus no son muy comunes, ya que la mayoría de las pruebas in vitro tienen por objetivo detectar la acción acaricida del producto en las diferentes fases del ciclo biológico de las garrapatas (larvas y teleoginas). Sin embargo, la acción repelente puede ser una respuesta interesante, que complementa el efecto letal de algunos garrapaticidas comerciales disponibles en el mercado. De ahí la importancia del presente estudio.
Pasadas las 8 h, el control positivo (Butox®) disminuyó su actividad repelente hasta alcanzar valores del 66,5 % a las 32 h y difirió significativamente (p < 0,05) de los tratamientos experimentales (aceites de J. curcas) que mantuvieron una actividad similar a la inicial durante todo el experimento. Esto pudiera estar relacionado con la volatilización de los principios activos presentes en el aceite, ya que sus mayores efectos no son por la actividad repelente, sino por el contacto directo y la penetración en los parásitos, lo que provoca afectaciones en el sistema nervioso, muscular, reproductor y digestivo (Roque-López, 2015).
El agua destilada no mostró actividad repelente, como se esperaba, ya que sus valores se mantuvieron en un intervalo entre 3 y 7 % durante la etapa experimental.
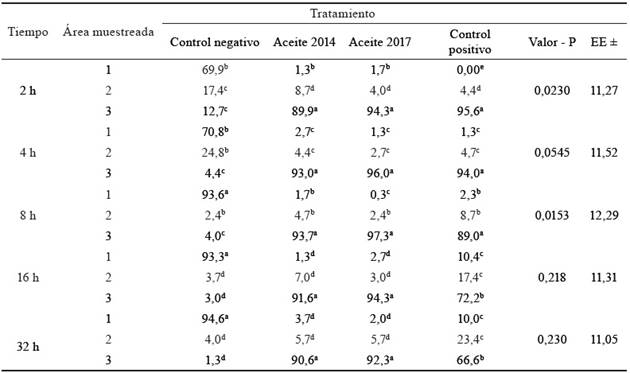
En la tabla 2 se muestra la distribución del porcentaje de las larvas de R. (B.) microplus para cada momento de evaluación (2, 4, 8, 16 y 32 h, respectivamente).
Tabla 2 Distribución del porcentaje de larvas de R. (B.) microplus.
a, b, c y d: Letras distintas en una misma columna indican diferencias significativas entre tratamientos (p ≤ 0,05)
Por lo general, se observó que las larvas subieron totalmente al área 1 (0-5 cm), como fue el caso del control negativo (sin actividad repelente). También se dio un proceso a la inversa (área 3), cuando se correspondió con los aceites de J. curcas y el control químico. En tanto, la cantidad de larvas encontradas en el área 2 fue variable y respondió al propio proceso migratorio (geotropismo negativo) que realizan las larvas en su ciclo biológico, característica que permite definir la actividad repelente de las sustancias.
El control negativo presentó los valores más bajos de larvas en el área 3: 12,7; 4,4; 4,0; 3,0 y 1,3 % a las 2, 4, 8, 16 y 32 h, respectivamente. Esto confirma que el agua destilada es una sustancia de baja repelencia.
A las 2 y 4 h (tabla 1), la cantidad de larvas recuperadas en el control negativo mostró diferencias significativas (p < 0,05) entre las áreas, con el porcentaje más alto para el área 1 (69,9 y 70,8 %, respectivamente). Sin embargo, en los tratamientos experimentales (aceite Jc 2014 y 2017) y en el producto químico, no se encontraron diferencias entre las áreas 1 y 2, pero sí con respecto a la 3.
De acuerdo con Jaenson et al. (2005), una sustancia repelente hace que el organismo realice movimientos en dirección opuesta a la fuente de estímulo. Este comportamiento se pudo ver a las 8, 16 y 32 h, momentos en que las larvas migraron hacia el área 3, con excepción del control negativo.
En condiciones naturales, las larvas migran hacia los bordes de las hojas y procuran el encuentro con el huésped. Este comportamiento se observó en el control negativo (agua destilada), lo que demuestra que esta sustancia no tiene actividad repelente, ya que las larvas en más de 94 % se agruparon en el área 1. Según García et al. (2019), esta característica de agrupamiento de las larvas es un mecanismo que les permite la supervivencia en condiciones ambientales.
Furlong et al. (2002a, 2002b) plantearon que las larvas tienden a migrar verticalmente, justo debajo del extremo de las hojas de los pastos para escapar de las condiciones adversas, evitan así el gasto de energía y la desecación. Debido a este comportamiento, se puede inferir que estas sustancias tienen potencial para limitar la actividad biológica de las larvas en condiciones naturales.
Los tratamientos experimentales no mostraron diferencias significativas. El aceite que se extrajo en el 2014, transcurrido un tiempo de almacenamiento de tres años, mantiene las propiedades de repelencia y eficiencia.
Según Joshi et al. (2013), la calidad del aceite y la concentración de sus principios activos está directamente relacionada con las condiciones de almacenamiento y la pérdida de algunos de sus compuestos por volatilización, ya que la temperatura y la humedad relativa son de las variables que más influyen en este comportamiento.
El efecto repelente de J. curcas puede estar determinado por su contenido en ácidos grasos, como el palmítico, esteárico y linoleico, y por la presencia de metabolitos secundarios como alcaloides, esteroides, taninos, flavonoides, fenol y cumarinas (Rampadarath et al., 2016), que le confieren un olor característico. Estos olores contribuyen a interrumpir la actividad de búsqueda que desarrollan las larvas, y con ello obstaculizan su ciclo biológico y el acceso a los huéspedes en condiciones de pastoreo. Camacho y Peralta (2019) han informado efectos repelentes similares a los de este estudio, para las especies orégano (Origanum vulgare L.) y romero (Rosmarinus officinalis L.).