Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.2 Ciudad de la Habana abr.-jun. 2012
ARTÍCULO ORIGINAL
Actividad biológica de los aceites esenciales de Acmella ciliata (Kunth) Cass.
Biological activity of essential oils from Acmella ciliata (Kunth) Cass.
Quim. Carlos Andrés Rincón Mejía, Dr. C. Jhon Carlos Castaño Osorio, MSc. Eunice Ríos Vázquez
Universidad del Quindío. Colombia.
RESUMEN
Introducción: Acmella ciliata (Kunth) Cass. es una arvense nativa del norte de Suramérica conocida por su contenido de alcamidas alifáticas, se usa popularmente como anestésico y analgésico contra los dolores de muelas y de garganta.
Objetivos: obtener, analizar y evaluar la actividad biológica de los aceites esenciales de las flores y hojas de Acmella ciliata (Kunth) Cass.
Métodos: se obtuvieron los aceites esenciales de Acmella ciliata por hidrodestilación e hidrodestilación asistida por microondas, y se analizaron por cromatografía de gases acoplados a un espectrómetro de masas. La actividad biológica de los aceites esenciales se determinó mediante el método modificado de pozos de agar, se evaluaron sus actividades antimicrobianas frente a 5 bacterias y 1 hongo, junto con pruebas de toxicidad en Artemia salina.
Resultados: la hidrodestilación asistida por microondas fue la técnica con mejores rendimientos en la extracción de los aceites esenciales de Acmella ciliata. Sus fracciones volátiles contienen una alta proporción de sesquiterpenos como el trans-β-cariofileno, su componente mayoritario. Los aceites esenciales a 2 concentraciones diferentes (25 y 15 mg/mL) presentaron una marcada actividad antimicrobiana frente a las bacterias grampositivas Staphylococcus aureus y Staphylococcus epidermidis; además exhibieron una baja toxicidad contra Artemia salina, con dosificaciones letales medianas de 176,156 ppm y 100,104 ppm para el aceite esencial de las hojas y flores, respectivamente.
Conclusiones: los aceites esenciales de Acmella ciliata son productos que presentan un alto contenido de terpenoides, con marcada acción antimicrobiana frente bacterias grampositivas (Staphylococcus aureus y Staphylococcus epidermidis) y baja toxicidad en Artemia salina.
Palabras clave: Acmella ciliata, trans-β-cariofileno, Staphylococcus aureus, Staphylococcus epidermidis, dosificación letal mediana, productos con acción antimicrobiana.
ABSTRACT
Introduction: Acmella ciliata (Kunth) Cass. is a native weed of northern South America known by its aliphatic alkamide content and used as an anesthetic and analgesic for toothache and sore throat.
Objective: to obtain, to analyze and to evaluate the biological activities of essential oils from Acmella ciliata (Kunth) Cass flowers and leaves.
Methods: Acmella ciliata essential oils were obtained by hydrodistillation and microwave-assisted hydrodistillation and analyzed by gas chromatography coupled to mass spectrometry. The biological activity of both essential oils was determined by using the modified agar-well diffusion assay, evaluating their activities against five bacteria and one fungus, along with tests of toxicity in Artemia salina (Lethal Dose 50).
Results: microwave-assisted hydrodistillation was the technique with the best performances in the extraction of Acmella ciliata. essential oils. Their volatile fractions contain a high proportion of sesquiterpenes such as β-trans-caryophyllene, the major component. Essential oils at two different concentrations (25 mg/mL and 15 mg/mL) showed a strong antimicrobial activity against gram-positive bacteria Staphylococcus aureus and Staphylococcus epidermidis, in addition they exhibited low toxicity against Artemia salina, presenting mean lethal doses of 176, 156 and 100,104 ppm for the essential oils from leaves and flowers, respectively.
Conclusions: Acmella ciliata essential oils are products with high content of terpenoids and marked antimicrobial activity against gram-positive bacteria (Staphylococcus aureus and Staphylococcus epidermidis) and low toxicity against Artemia salina.
Key words: Acmella ciliata, β-trans-caryophyllene, Staphylococcus aureus, Staphylococcus epidermidis, lethal dose 50, products with antimicrobial action.
INTRODUCCIÓN
Acmella ciliata (Kunth) Cass es nativa del norte de Suramérica y se ha naturalizado en las islas Célebes, India, Sumatra y Tailandia. En la más antigua documentación de esta especie se alude erróneamente como Spilanthes ciliata.1 Esta especie Arvense o mal llamada "maleza" es un famoso remedio popular para el dolor de muelas y garganta, así como para las infecciones de las encías. Se ha sabido que la masticación de sus hojas y flores tienden a adormecer la boca y así aliviar temporalmente el dolor dental y oral.2 Los compuestos bioactivos a los que se le atribuyen estos efectos son las alcamidas alifáticas, que han demostrado su eficacia como compuestos medicinales, saborizantes e incluso en control biológico, por lo que son un grupo de metabolitos de gran interés actual.3
El análisis por cromatografía de gases de los aceites esenciales de tallos, hojas e inflorescencias de Acmella ciliata ha mostrado la especificidad de sus órganos en el desarrollo de su fracciones volátiles.4 También se ha reportado su acción insecticida y antibacteriana, aun así, no existen muchos detalles acerca de investigaciones farmacológicas llevadas a cabo para A. ciliata.5
En esta investigación, por ende, se buscó realizar un paralelo entre la composición química de los aceites esenciales de las flores y hojas de A. cilliata obtenidos y su respectiva actividad biológica, así como la viabilidad en su extracción.
MÉTODOS
Recolección y secado del material vegetal
Las flores y hojas de Acmella ciliata se recolectaron a las 6:00 a.m. en la Universidad del Quindío, municipio de Armenia, Colombia, a una altitud de 1 483 m sobre el nivel del mar y una temperatura entre 20 y 24 ºC. El espécimen vegetal que sirvió de material de referencia entró al herbario de la Universidad del Quindío (HUQ) con el número 32750. Ambos órganos se secaron por separado en una estufa con circulación de aire a 35 ºC durante 24 h. Es de aclarar que el estudio se efectuó conforme a las reglamentaciones y los principios éticos existentes para la investigación en animales, los estudios clínicos y los derechos de biodiversidad.
Obtención de los aceites esenciales por hidrodestilación (HD) e hidrodestilación asistida por microondas (MWHD)
Se utilizaron 50 g de material vegetal seco. Las destilaciones se realizaron en un equipo de hidrodestilación del tipo Clevenger y en un equipo de destilación simple adaptado a un horno microondas convencional marca Samsumg modelo MW1260WA, con una potencia de 1,55 kw. Los aceites esenciales obtenidos se extrajeron del hidrolato por separación líquido-líquido con diclorometano y secado sobre sulfato de sodio anhidro; se almacenaron en viales ámbar a 4 ºC hasta la realización de los respectivos análisis. Los rendimientos en la extracción se evaluaron por triplicado a tiempos de 30, 45, 60, 75 y 90 min, operando siempre bajo las mismas condiciones,6 según la ecuación siguiente:
![]()
Análisis fisicoquímicos del aceite esencial
Se determinó el peso específico, índice de refracción y pH.
Análisis cromatográficos del aceite esencial
Se disolvieron 50 µL del aceite esencial (AE) en 1 mL de diclorometano, se inyectaron en un cromatógrafo de gases acoplado a espectrómetro de masas marca Shimadzu GC-MS QP-2010; sistema equipado con autoinyector AOC-20i, automuestreador AOC-20s, inyección split-splitless, modo de ionización EI/SCI/NCI, sistema de inserción directa controlado por el software GCMS solution, columna Rtx-CLPesteicides Restek (30 m´0,25 mm DI, 0,25 µm espesor de película) y base de datos de fragmentogramas Wiley, 7ma. Edición, 2003. La temperatura del horno se programó de 40 ºC (15 min) hasta 250 ºC a 5 ºC/min. Se utilizó como gas helio (99,9995 %) de grado 5,0 UAP, con una velocidad lineal de 35 cm/s; las temperaturas de la cámara de ionización y de la línea de transferencia se mantuvieron a 230 y 285 ºC, respectivamente. Se empleó n-tetradecano como patrón interno.
Actividad biológica
Actividad antimicrobiana
Se usaron Escherichia coli, Proteus mirabilis, Klebsiella ozaenae, Staphylococcus aureus, Staphylococus epidermidis y Candida albicans (ATCC 9808). Las bacterias se obtuvieron de aislados clínicos provenientes de la Clínica Central del Quindío, los cuales se identificaron en el Centro de Investigaciones Biomédicas de la Universidad del Quindío.
Preparación del inóculo
Las bacterias y levaduras congeladas en medio más glicerina, se activaron agregando 20 µL de los microorganismos en 5 mL de caldo nutritivo (tioglicolato para bacterias y PYG para levaduras) e incubando a 37 ºC (bacterias) y 30 ºC (levaduras) hasta alcanzar la fase logarítmica de crecimiento. El inóculo se preparó tomando la cantidad necesaria del microorganismo en estudio (previamente activado) y disolviéndolo en caldo o solución salina hasta lograr una turbidez comparable al patrón de turbidez 0,5 McFarland; esta comparación se llevó a cabo visualmente utilizando un fondo blanco con líneas negras contrastantes y fuente de luz adecuada.7
Determinación de la actividad antimicrobiana de los aceite esencial mediante el método modificado de pozos de agar
Se prepararon diferentes emulsiones del aceite esencial, a 2 concentraciones: 25 mg/mL y 15 mg/mL en Tween 20 a 5 %. Se hizo el frotis del inóculo sobre cada una de los agares selectivos estipulados para los microorganismos. Posteriormente, se hicieron los pozos sobre la superficie de los agares con ayuda de un sacabocados estéril de 3 mm de diámetro, y en cada uno de ellos se vertieron 25 µL de la solución de aceite esencial, blancos y controles positivos. Se dejó reposar por 15 min; las cajas se incubaron a 37 ºC y al cabo de 24 h se leyeron los resultados. El diámetro de la zona de inhibición del crecimiento microbiano se expresó en milímetros.8
Dosis letal media (DL50)
La determinación de toxicidad en Artemia salina se realizó por exposición de los crustáceos a concentraciones decrecientes (1 000, 750, 500, 250, 125, 50, 25, 12,5 ppm) de los aceites esenciales de A. ciliata. A cada pozo de una placa de 24 pozos, se le adicionó 1 mL de la solución salina que contenía 10 A. salina. Luego se transfirieron 1 mL de cada disolución (por triplicado). Se hizo un control por muestra. Finalmente se agregó solución salina hasta completar 3 mL. Se adicionó una gota de suspensión de levadura (3 mg de levadura seca disuelta en 5 mL de agua de mar) como alimento. Se hizo la lectura de artemias muertas por cada dilución a diferentes tiempos. Los resultados se procesaron por el programa STATGRAPHICS Plus Versión 5.1 transformando los porcentajes de mortalidad en probits, los cuales se utilizaron para calcular la DL50 del aceite esencial.
RESULTADOS
Obtención de los aceites esenciales por hidrodestilación e hidrodestilación asistida por microondas
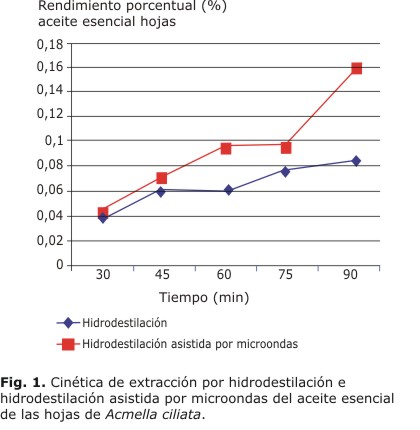
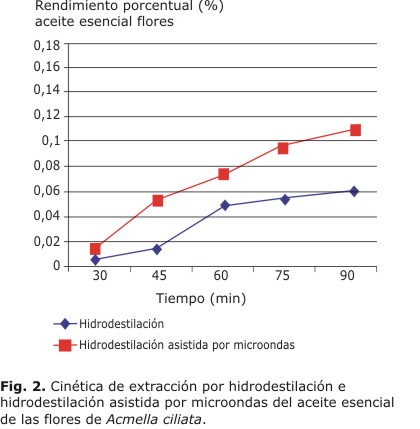
Las cinéticas presentadas en las figuras 1 y 2 muestran la eficacia de la hidrodestilación asistida por microondas sobre la hidrodestilación en la extracción del aceite esencial de los órganos utilizados. Por ambos métodos, el tiempo con un mayor rendimiento es 90 min, con un rendimiento porcentual para el aceite esencial de las hojas de 0,163 % y para el aceite esencial de las flores de 0,11 %.
Análisis fisicoquímicos del aceite esencial
Tanto el aceite esencial de las hojas como el de las flores presentan una coloración amarilla tenue. Las propiedades fisicoquímicas de estos aceites son descritas en la tabla 1. Ambos aceites presentaron un pH ácido, que constituye un factor clave para su actividad bactericida.
Análisis cromatográfico de los aceites esenciales
La identificación de los componentes, los tiempos de retención y porcentajes de abundancia son reportados en las tablas 2 y 3. Los sesquiterpenos, así como los terpenoides oxigenados son los metabolitos volátiles con mayor abundancia en el aceite esencial de las hojas. Los compuestos mayoritarios encontrados son trans-β-cariofileno (26,813 %), D-germacreno (23,412 %) y óxido de cariofileno (9,271 %). El aceite esencial de las flores contiene monoterpenos cíclicos y acíclicos, sesquiterpenos y terpenoides oxidados (tabla 3). Sus componentes mayoritarios son trans-β-cariofileno (24,040 %), β-felandreno (17,143 %) y óxido de cariofileno (11,907 %).
Tabla 2. Composición química del aceite esencial de las hojas de Acmella ciliata
| No. Pico | Tiempo de retención (min) | Componente | Abundancia (%) |
| 1 | 13,273 | β-felandreno | 0,497 |
| 2 | 13,587 | α-pineno | 0,960 |
| 3 | 23,793 | β-bourboneno | 0,702 |
| 4 | 24,669 | trans-β-cariofileno | 26,813 |
| 5 | 25,564 | α-humuleno | 2,121 |
| 6 | 26,251 | D-germacreno | 23,412 |
| 7 | 26,633 | 3-trideceno | 3,463 |
| 8 | 26,697 | trans- α-bisaboleno | 3,303 |
| 9 | 26,680 | 1-metil-(5-metil-1-metileno-4- hexenil) ciclohexano | 3,424 |
| 10 | 27,249 | δ-cadineno | 1,240 |
| 11 | 27,435 | 2,2,7,7,tetrametiltriciclo[6.2.1.0(1,6)]undec-4-en-3-ona | 0,820 |
| 12 | 27,671 | α-humuleno | 1,378 |
| 13 | 27,990 | óxido de cariofileno | 0,904 |
| 14 | 28,139 | β -farneseno | 1,673 |
| 15 | 28,574 | espatulenol | 4,994 |
| 16 | 28,728 | óxido de cariofileno | 9,271 |
| 17 | 30,342 | triétil citrato | 4,601 |
| 18 | 30,492 | ar-tumerona | 3,517 |
| 19 | 31,049 | androstan-17-ona, 3-etil-3-hidroxi | 1,121 |
| 20 | 31,331 | curlona | 1,068 |
| 21 | 34,270 | 2-Butenal, 2-metil-4-(2,6,6-trimetil-1-ciclohexen-1-ilo) | 0,691 |
| 22 | 39,502 | fitol | 1,175 |
Tabla 3. Composición química aceite esencial de las flores de Acmella ciliata
| No. Pico | Tiempo de | Componente | Abundancia (%) |
| 1 | 10,131 | α-pineno | 0,543 |
| 2 | 11,442 | sabineno | 6,610 |
| 3 | 12,069 | β-mirceno | 1,236 |
| 4 | 12,438 | ciclohexano, 1-metileno-4-(1-metiletenil) | 1,605 |
| 5 | 13,246 | β-felandreno | 17,143 |
| 6 | 13,566 | ocimeno | 12,465 |
| 7 | 17,935 | 1-terpinen-4-ol | 0,380 |
| 8 | 18,203 | 2-ciclohexen-1-ona, 4-(1-metiletil) | 1,387 |
| 9 | 23,944 | β-elemeno | 0,334 |
| 10 | 24,201 | α-gurjuneno | 0,642 |
| 11 | 24,699 | trans-β-cariofileno | 24,040 |
| 12 | 26,249 | D-germacreno | 5,406 |
| 13 | 26,637 | 5,9,9-trimetil-spiro[3.5]non-5-en-1-ona | 0,457 |
| 14 | 26,694 | α-muuroleno | 1,084 |
| 15 | 26,861 | ciclohexano, 1-metil-4-(5-metil-1-metileno-4-hexenil) | 7,772 |
| 16 | 27,247 | cis-α-bisaboleno | 0,649 |
| 17 | 27,992 | óxido de cariofileno | 0,931 |
| 18 | 28,167 | 3-isopropil-6,7-dimetiltriciclo[4.4.0.0(2,8)]decano-9,10 | 1,046 |
| 19 | 28,728 | óxido de cariofileno | 11,907 |
| 20 | 29,333 | óxido de cariofileno | 1,095 |
| 21 | 35,171 | N-isobutil-2(E),6(Z),8(E)-decatrienamida (espilantol) | 1,309 |
| 22 | 42,785 | eicosano | 0,921 |
| 23 | 46,107 | eicosano | 1,040 |
Determinación de la actividad antimicrobiana de los aceites esenciales mediante el método modificado de pozos de agar
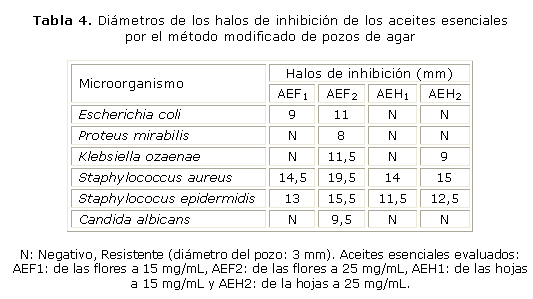
Los halos producto de la acción antimicrobiana de los aceites esenciales a 2 concentraciones diferentes (25 mg/mL y 15 mg/mL), son reportados en la tabla 4; los blancos (Tween 20 a 5 %) no presentaron halos de inhibición, y sus controles positivos funcionaron según lo establecido: E. coli, 24,5 mm; K. ozaenae, 10.5; P. mirabilis, 10 mm; S. aureus, 23,5 y S. epidermidis, 23,5 mm.
Las bacterias gramnegativas presentaron una mayor resistencia a los aceites esenciales utilizados. A pesar de ello, el aceite esencial de la flores de Acmella ciliata (a su más alta concentración) mostró actividad antimicrobiana frente a 3 bacterias gramnegativas, E. coli (11 mm), K. ozaenae (11,5 mm), P. mirabilis (8 mm). Se presentó inhibición del crecimiento bacteriano de S. aureus y S. epidermidis alrededor de los pozos en los que se aplicaron las emulsiones de los aceites esenciales a las 2 concentraciones. A mayor concentración del aceite esencial mayor fue la inhibición del crecimiento bacteriano. C. albicans se mostró resistente a la acción de gran parte de los aceites esenciales, sin embargo, se presentó un pequeño halo de inhibición para el aceite esencial de las flores a una concentración de 25 mg/mL (AEF2).
Dosis letal media (DL50)
La lectura del análisis en un tiempo de 24 h, permitió deducir un modelo de regresión Probit con relación entre el porcentaje de mortalidad de A. salinas y la concentración del aceite esencial empleado. El aceite esencial de las hojas presentó una DL50 de 176,156 ppm y el aceite esencial de las flores una DL50 de 100,104 ppm.
DISCUSIÓN
Obtención de los aceites esenciales por hidrodestilación y hidrodestilación asistida por microondas
La hidrodestilación asistida por microondas mostró ser el método más efectivo en la extracción de los aceites esenciales de A. cilliata. Esto es debido a la acción de las microondas sobre las paredes glandulares que contiene el aceite esencial, lo cual hace que el material vegetal se rompa más rápido y eficientemente. La hidrodestilación asistida por microondas utiliza 3 formas de transferencia de calor dentro de la muestra: la irradiación, conducción y convección. Como resultado, produce calor con mayor rapidez dentro y fuera de las glándulas. Con hidrodestilación esta transferencia de calor solo puede ocurrir por conducción y convección, lo que la hace menos efectiva.9
Análisis cromatográfico del aceite esencial
Sarnaglia y otros encontraron como compuestos mayoritarios del aceite esencial de las hojas al D-germacreno (37,51 %), β-farneseno (36,04 %) y 3-trideceno (2,97 %).4 Los 3 compuestos están presentes en el perfil cromatográfico mostrado en la tabla 2, pero es visible una variación en el porcentaje de abundancia, ocasionada por el efecto de diferentes factores ambientales sobre el contenido de compuestos en plantas medicinales. La intensidad de la luz y el fotoperíodo, que varían de región en región, afectan la composición del aceite esencial.10 Rajalakashmi analizó el aceite esencial de la planta entera estimando al β-cariofileno (14 %) como compuesto mayoritario;11 este último coincide con el determinado en el perfil aromático de las hojas.
Algunos de los compuestos encontrados en el perfil cromatográfico del aceite esencial de las flores concuerda con los reportados por algunos autores. Sarnaglia y otros al evaluar la fracción volátil de las flores de Acmella ciliata identificaron como componentes mayoritarios el ocimeno (15,38 %), espilantol (15,16 %) y β-farneseno (15,02 %).4 Martin y Becker encontraron espilantol (N-isobutil-2[E],6[Z],8[E] decatrienamida) en la fracción volátil de las flores, una alcamida característica en las especies del género Acmella y que es su componente activo.12
Determinación de la actividad antimicrobiana de los aceites esenciales mediante el método modificado de pozos de agar
Gran parte de los aceites esenciales utilizados no mostraron actividad antimicrobiana frente a bacterias gramnegativas. Tal como lo describen Ahmad y otros, las bacterias gramnegativas muestran una resistencia intrínseca a una gran variedad de aceites esenciales, que se relaciona con la superficie hidrófila de su membrana externa, rica en moléculas de lipopolisacárido.13 Una barrera permeable en contra de los agentes tóxicos es formada. Para pequeñas moléculas hidrofílicas no se impide el paso a través de la membrana externa debido a la acción de las proteínas porinas. Sin embargo, las macromoléculas hidrofóbicas como la de los componentes de los aceites esenciales, son incapaces de penetrar la barrera. Esto lleva a pensar que el pequeño halo de inhibición producido por el aceite esencial de las flores puede estar con su contenido de terpenoides (monoterpenos y sesquiterpenos), que fueron identificados como los componentes mayoritarios en las fracciones volátiles de las hojas y flores. El mecanismo de acción de los terpenos no se entiende completamente, pero se especula que participan en la disrupción de la membrana por los compuestos lipofílicos.14 Maguna y otros describen 3 posibles vías de acción para este particular grupo de metabolitos volátiles: aumentando la permeabilidad de la membrana a iones pequeños, afectando la estabilidad estructural de la membrana y desestabilizando el empaquetamiento de la bicapa lipídica.15
Como era de esperarse las bacterias grampositivas fueron las más susceptibles al efecto antimicrobiano. Burt especifica que los aceites esenciales son más activos frente a bacterias grampositivas que a las bacterias gramnegativas, debido a que en estas no existe una cubierta de lipopolisacáridos que evite la difusión de los compuestos hidrofóbicos presentes en los aceites esenciales.16 El pequeño halo de inhibición generado por el aceite esencial de las flores en Candida albicans puede estar relacionado con su contenido de alcamidas. Rany y Murt encontraron que los extractos de las flores de Spilanthes cilliata, una especie estrechamente relacionada con A. cilliata, presentan una marcada actividad antifúngica frente diferentes patógenos, la cual atribuyen a la presencia del espilantol y otras alcamidas alifáticas.17
Dosis letal media (DL50)
Algunos aceites esenciales como los de Ruda graveolens (Ruda, DL50= 2,7 ppm), Wakataya saiko (Wakataya, DL50= 3,9 ppm), Cariophyllus aromaticus (Clavo, DL50=33,9 ppm), Juniperus communis (Pino, DL50= 38,5 ppm), Piper sp. (Matico, DL50= 41,3 ppm) y Eucaliptus globulus (Eucalipto, DL50= 85,6 ppm) presentan DL50 por debajo de 100 ppm, indicativo de una alta toxicidad;18 al comparar estos valores con el de los aceites esenciales obtenidos se evidencia una baja toxicidad que podría facilitar sus posibles usos en farmacología.
La hidrodestilación asistida por microondas demostró ser la técnica más efectiva en la extracción de los aceites esenciales de las flores y hojas de A. cilliata. Ambos aceites presentan una marcada actividad antimicrobiana frente a las bacterias grampositivas (S. aureus y S. epidermidis), esta es atribuida a su alto contenido de terpenoides los cuales participan en la disrupción de la membrana, lo cual ocasiona la lisis y muerte celular de las bacterias. Pese a su eficaz acción antimicrobiana, los aceites esenciales extraídos presentaron baja toxicidad, esto incentiva la realización de nuevas investigaciones en las que se encuentre un uso apropiado a esta especie vegetal en el campo terapéutico.
REFERENCIAS BIBLIOGRÁFICAS
1. Chung K, Kono Y, Wang C, Peng C. Notes on Acmella (Asteraceae: Heliantheae) in Taiwan. Bot Stud. 2008;49:73-82.
2. Vélez MC, Agudelo CA, Pinto DM. Monografías de la flora andina: Flora arvense de la región cafetera centro-Andina de Colombia tomo I. Armenia (Colombia): Universidad del Quindío; 1998.
3. Molina J, García A. Alcamidas en plantas: distribución e importancia. Avance Perspectiva. 2001;20:377-87.
4. Sarnaglia T, Moret C, Felix AP, Holanda MC, Salazar O, Kaplan M. Análise do Óleo Essencial dos Diferentes Órgãos de Acmella ciliata Kunth (Asteraceae). Rev Bras Bioci. 2007;5(2):1128-30.
5. Keipert R. Acmella ciliata (H.B.K.) Cassini. Phytochemische und enzymatische Untersuchungen, galenische Präformulierungen [Tesis para Doctor en Ciencias]. Universidad Libre de Berlín; 2009.
6. Ríos E, Giraldo GA, Leon DF, Moreno A. Evaluación del perfil de compuestos volátiles de los rizomas de Curcuma longa l. cultivada en el departamento del Quindío-Colombia. Rev Invest Universidad Quindío. 2008;18:32-7.
7. Henao J, Muñoz LJ. Evaluación de la actividad antimicrobiana de los extractos y del aceite esencial obtenidos de Lippia origanoides H.B.K. cultivada en el Quindío [Trabajo para optar por el título de Químico]. Universidad del Quindío; 2009.
8. Rojas J, García A, López A. Evaluación de dos metodologías para determinar la actividad antimicrobiana de plantas medicinales. Boletín Latinoamericano y del Caribe de plantas medicinales y aromáticas. 2005;4(2):28-32.
9. Golmakani MT, Rezei K. Comparison of microwave-assisted hydrodistillation with the traditional hydrodistillation method in the extraction of essential oils from Thymus vulgaris L. Food Chem. 2008;109(84):925-30.
10. Muñoz D, Voguel H, Razmilic I. Variación de compuestos químicos en hojas de poblaciones de Drimys spp. (Magnoliophyta: Winteraceae) en Chile. Rev Chil Hist Nat. 2004;77:43-50.
11. Rajalakashmi R. Cytological and phytochemical investigations in some medicinal plants of asteraceae [Trabajo para optar por el título de Doctor of Philosophy en Botánica]. Universidad Mahatma Gandhi; 2001.
12. Martin R, Becker H. Amides and other constituents from Acmella ciliata. Phytochemistry. 1985;24(10):295-300.
13. Ahmad I, Aqil F, Owais M. Modern Phytomedicine: turning medicinal plants into drugs. Weinheim: WILEY-VCH Verlag GmbH & Co. KgaA; 2006.
14. Murphy M. Plant Products as antimicrobial agents. Clin Microbiol Rev. 1999;12:564-82.
15. Maguna F, Romero A, Garro O, Okulik N. Actividad antimicrobiana de un grupo de terpenoides. Facultad de Agroindustrias, UNNE, Argentina[Comunicaciones Científicas Tecnológicas en internet]. 2006[citado 23 Sep 2011];E(57). Disponible en: http://www.unne.edu.ar/Web/cyt/cyt2006/08-Exactas/2006-E-057.pdf
16. Burt S. Essential oils: their antibacterial properties and potential applications in foods-a review. Int J Food Microbiol. 2004;94:223-53.
17. Rany S, Murty S. Antifungal potential of flower head extract of Spilanthes acmella Linn. Afr J Biomed Res. 2006,9:67-9.
18. Flores E, Velasco A, Irahola P, Gimenez A. Aceites esenciales con actividad citotóxica como indicador de propiedades insecticidas. Biofarbo.1999;7(35):35-7.
Recibido: 26 de agosto de 2011.
Aprobado: 30 de enero de 2012.
Carlos Andrés Rincón Mejía. Dirección: B/ La Clarita cll 37 # 27-40 Universidad del Quindío. Colombia. Teléfono: +037 7402798. Correo electrónico: carlosandres0415@gmail.com