INTRODUCCIÓN
Los trastornos neurocognitivos se refieren al deterioro de las funciones ejecutivas (planificación, iniciativa, monitorización, flexibilidad, organización, organización de materiales, entre otras) y las cognitivas (atención, memoria de trabajo y memoria prospectiva).1 Se presentan principalmente en adultos mayores.2
Existen dos tipos de clasificación: primarios -enfermedad de Alzheimer (EA), demencia con cuerpos de Lewy (DCLw), demencia frontotemporal (DFT) u otras enfermedades que cursan con demencia- y secundarios -enfermedad vascular, traumatismo cerebral por consumo de sustancias o medicamentos, déficits vitamínicos, infección por Virus de Inmunodeficiencia Humana (VIH) o priones-. Estos trastornos son causa de discapacidades y, a su vez, llevan una gran carga de dependencia económica y estrés. Su diagnóstico temprano juega un papel primordial en la intervención clínica del paciente y en la práctica médica.3,4
Es importante una evaluación inicial de dichos trastornos, y las pruebas cognitivas breves (PCB) son de utilidad en este medio. Se debe obtener un historial médico completo de los pacientes.5 También se realizará un examen físico exhaustivo y pruebas auxiliares disponibles en tiempo limitado. Esto no requerirá de entrenamiento especializado.5,6
En la actualidad, existen variadas PCB, pero no todas son elegibles para cada población. La selección de una prueba constituye un desafío para que sea sensible y específica en el diagnóstico diferencial. Las PCB no pretenden sustituir a una evaluación neuropsicológica formal; cada una tiene su función complementaria, pero diferente. Debería ser posible obtener índices de dominios cognitivos necesarios en una consulta médica.5,7 La validez y confiabilidad de los instrumentos internacionales disponibles son relevantes de estimar; es fundamental contar con evidencia de sus propiedades psicométricas, para luego estimar su valor diagnóstico.8,9
La validez de una prueba cognitiva dependerá de su capacidad para detectar adecuadamente la presencia o no de la enfermedad en estudio. Esta información es expresada en índices como la sensibilidad y especificidad.10,11 Su utilidad estará en la medida que permita diferenciar dos o más condiciones, las cuales podrían ser confundidas.3
Una prueba cognitiva debe ser integral, sensible y conveniente de administrar.12-14 Son muchas pruebas las que gozan de popularidad en el ámbito médico, entre las que se encuentra el Addenbrooke's Cognitive Examination-Revised (ACE-R, versión de la batería original Addenbrooke's Cognitive Examination, ACE).15,16 Es una breve evaluación de detección cognitiva que es sensible a las primeras etapas de la demencia y capaz de diferenciar entre sus subtipos.7,8
El ACE es un instrumento de tamizaje de la función cognitiva y es utilizado en varios países, con una alta confiabilidad y validez.17 Agregó a su estructura el Mini-Mental Statement Examination (MMSE), pero profundizando en la memoria, el lenguaje, los componentes visuoespaciales y de fluidez verbal.18 Es muy conocida su capacidad de diferenciar la enfermedad de Alzheimer de la demencia frontotemporal.19,20
Según cita Cao et al.,21 su evolución ha pasado por tres etapas: ACE, ACER y ACE III. Fue desarrollada por el profesor John R. Hodges en el 2000. En este tiempo, constituyó un novedoso diseño para detectar la demencia leve o distinguir entre la EA y la DFT. Además, se utilizó para detectar deterioro cognitivo en la enfermedad de Parkinson, ictus, enfermedades neuropsiquiátricas, etc.
En 2006 se creó una versión mejorada, el ACE-R, con el objetivo de mitigar las deficiencias del ACE, como el componente visuoespacial limitado y los efectos de techo. También se ampliaron sus aplicaciones transculturales a diversos países.21
Es una prueba objetiva y confiable de 100 puntos que evalúa múltiples dominios cognitivos: orientación/atención (18 puntos), memoria (26 puntos), fluidez verbal (14 puntos), lenguaje (26 puntos) y capacidad visuoespacial (16 puntos).22 La subescala de memoria comprende elementos de contenido semántico y episódico (p. ej., recuerdo, anterógrado, reconocimiento). La subescala visuoespacial incluye la copia de pentágonos superpuestos, de un cubo de alambre y el dibujo libre de un reloj. La prueba tarda aproximadamente de 15 a 20 minutos en completarse.23
El ACER hace que los estímulos interpretados sean reconocibles. Son de uso común en muchas culturas como la coreana, la alemana, la española, la griega, la italiana y la japonesa.5 En las Américas, ha sido validado en Colombia, Argentina, Brasil y Chile.24 Ha sido criticado por su extensión, lo que podría dificultar su uso en atención primaria o en el control de salud del adulto mayor. Sin embargo, sigue siendo una prueba de gran aceptación.9
Este estudio tiene como objetivo analizar la evidencia actualizada de la validez diagnóstica y la utilidad clínica del ACER en los trastornos neurocognitivos.
MÉTODOS
Se realizó una revisión sistemática sobre la validez diagnóstica del Examen Cognitivo de Addenbroke. Se identificaron referencias bibliográficas relacionadas y publicadas sobre la utilidad de la prueba para detectar diversos trastornos neurocognitivos. La confección del estudio se basó en las directrices de la declaración Prisma.25
La búsqueda fue realizada en PubMed, SciELO y Google Académico, específicamente las publicaciones realizadas desde 2018 hasta 2023. Se combinaron términos de búsqueda sobre el tema y los de mejores resultados fueron los siguientes: Addenbrooke's Cognitive Examination-Revised AND validation OR utility; ACE-R AND validation OR utility; ACE-R AND precision. Se obtuvieron 733 artículos en PubMed, 202 en SciELO y 3210 en Google Académico. Se definieron criterios de inclusión y exclusión para la selección de los artículos a revisar.
Criterios de inclusión: artículos publicados entre 2018 y 2023; documentos indexados en bases de datos científicas; artículos de texto completo en inglés o español; artículos que evidenciaran alto contenido científico; artículos que hicieran referencia a elementos relacionados con la validez o utilidad del Examen Cognitivo de Addenbroke para diferentes trastornos.
Asimismo, fueron utilizados los siguientes criterios de exclusión: artículos con más de diez años de publicación; resúmenes, blogs o cartas al editor; artículos publicados en bases de datos no indexadas; páginas web de fuentes no arbitradas como Wikipedia, documentos sin autor y fecha de publicación; muestra menor de 80 pacientes y artículos que solo se basaran en un solo trastorno neurocognitivo.
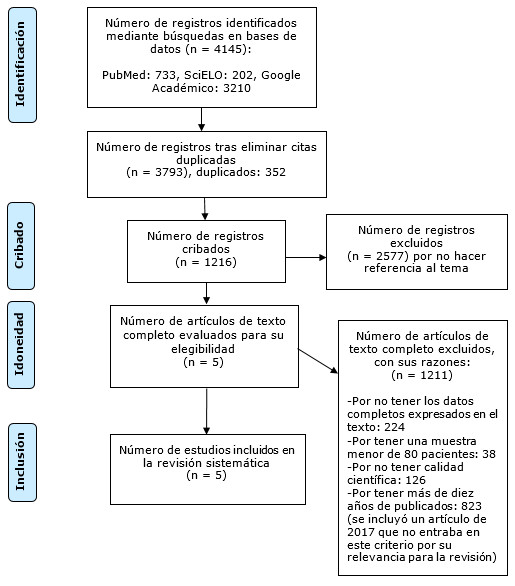
Primeramente, de los 4145 artículos obtenidos en las búsquedas se eliminaron los duplicados, quedando así 3793. De estos, por no hacer referencia al tema, se excluyeron 2577; se obtuvo un total de 1216. Después de una exhaustiva lectura por parte de los autores, quedaron cinco artículos incluidos en la revisión sistemática. Se hizo una excepción con un artículo fuera del rango de tiempo (2017) por su considerable aporte al tema. Este proceso fue recogido en el flujograma. (Fig.)
El estudio tuvo riesgos de sesgo como el espectro, debido a que la prueba varió entre subgrupos de poblaciones. También se encontró sesgo de revisión porque no siempre la prueba fue administrada por la misma persona.
DISCUSIÓN
El ACE-R ha sido motivo de investigación desde hace algunos años. Desde el surgimiento del ACE III, ha sido un poco desplazado y han sido ignoradas sus cualidades diagnósticas y transculturales. Cinco artículos actuales brindaron información sobre la validez de esta prueba diagnóstica, específicamente en los trastornos neurocognitivos. La tabla resume sus principales características.23,24,26-28
Tabla Características de los estudios revisados
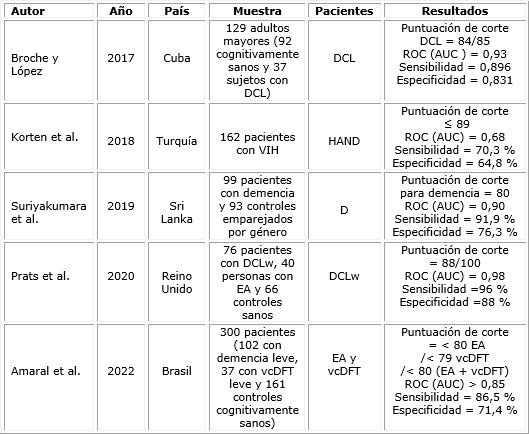
DCL: deterioro cognitivo leve; HAND: diagnóstico de deterioro neurocognitivo asintomático, trastorno neurocognitivo leve y demencia asociada al virus; D: demencia; DCLw: demencia con cuerpos de Lewy; EA: enfermedad de Alzheimer; vcDFT: variante conductual de la demencia frontotemporal; VIH: virus de inmunodeficiencia humana.
En el estudio cubano de Broche y López,24 se investigó la precisión diagnóstica del Addenbrooke-Revisado para identificar el deterioro cognitivo leve (DCL). Se administró en un grupo de 129 adultos mayores (92 cognitivamente sanos y 37 sujetos con DCL). La puntuación de corte óptima para ACER fue de 84/85. La sensibilidad (0,896) y especificidad (0,831) fueron superior a la de MMSE. En este estudio se encontró un área bajo la curva (AUC) de 0,93. Estos resultados sugieren que ACER es excelente para detectar DCL. El estudio facilitó la detección y el tratamiento temprano de los pacientes. A pesar de esto, no ha sido validado aún en síndromes demenciales. La versión cubana del ACER es una batería neuropsicológica precisa. Constituye un instrumento de tamizaje válido para discriminar sujetos cognitivamente sanos de pacientes con DCL.
Korten et al.26 analizaron 162 pacientes con VIH y HAND. El ACE-R mostró un área bajo la curva de 0,68, con una puntuación de corte de 89. La sensibilidad, especificidad y tasa de clasificación correcta fueron las siguientes: ACE-R (62,2 %, 67 %, 64,8 %) y 3Qs (10,8 %, 88,6 %, 53 %). El diagnóstico preciso de HAND generalmente requiere pruebas neuropsicológicas integrales y la exclusión de otras causas potenciales. Las herramientas de detección breve existentes tienen poca precisión diagnóstica para ser utilizadas en la práctica clínica. La sensibilidad, la especificidad y la tasa de clasificación correcta (CCR) de las pruebas de cribado para el diagnóstico de HAND fueron los siguientes: para el ACE-R (utilizando un de ≤ 89), 70,3 %, 64,8 % y 67,3 %, respectivamente. El ACE-R puede ser administrado por un especialista en VIH, después de un breve período de capacitación.
El siguiente estudio de Suriyakumara et al.27 evaluó la confiabilidad, validez y precisión diagnóstica de esta prueba traducida al cingalés. Se administró en una cohorte urbana de 99 pacientes con demencia y 93 controles sanos. La puntuación de corte del ACER para la demencia fue de 80, la sensibilidad del 91,9 % y especificidad del 76,3 %. Las áreas bajo la curva fueron de 0,90. El ACE-R demostró ser sensible, específico y fiable para detectar demencia en personas ≥ 50 años en dicha población. Su precisión diagnóstica fue superior a herramientas previamente validadas como el MMSE y el Montreal Cognitive Assessment. Se puede administrar en un período de tiempo relativamente corto. Además, no se diferencia en sus resultados de otras versiones.
Prats et al.,23 en el Reino Unido, compararon el rendimiento inicial de ACE‐R. Se estudiaron 76 personas con DCLw, 40 personas con EA y 66 controles sanos. La puntuación total de ACE‐R podía diferenciar los casos de demencia con una precisión del 98 % (AUC = 0,98). Una proporción de memoria/visuoespacial ≥ 1,1 diferenció la DCLw de la EA, con una sensibilidad del 82 %, una especificidad del 68 % y una precisión media del 77 %. Se realizaron modificaciones a la versión original para facilitar la administración y eliminar elementos insensibles. Una puntuación de corte de 88/100 mostró una sensibilidad (96 %) y una especificidad (88 %). Este estudio demostró la confiabilidad del ACE‐R para detectar demencia en una muestra clínica agrupada, pero además tuvo una buena discriminación entre DCLw y EA. Sin embargo, no pudo discriminar entre los tipos de demencia.
Amaral et al.28 investigaron la precisión diagnóstica del ACE-R. La vcDFT se caracteriza por una progresión gradual en la conducta social y personal. Se analizó una muestra de 102 pacientes con demencia leve, 37 con vcDFT leve y 161 controles cognitivamente sanos. Las puntuaciones de corte óptimas fueron < 80 para EA, < 79 para vcDFT y < 80 para demencia (EA + vcDFT). El área bajo las curvas características operativas del receptor (ROC) (AUC) fue > 0,85. Para el diagnóstico diferencial entre EA y vcDFT se mostró un AUC de 0,816, con una sensibilidad del 86,5 % y especificidad del 71,4 %. El ACE-R brasileño logró una buena precisión diagnóstica para diferenciar la EA de los pacientes con vcDFT. También ha demostrado tener precisión para el diagnóstico de demencia, incluso entre adultos mayores con bajo nivel educativo.
Identificar a las personas con demencia en una etapa temprana es una prioridad médica en su prevención. El uso de herramientas de detección cognitiva económicas, rápidas y sensibles es fundamental en este sentido.27
El ACER ha sido validado en muchos idiomas. Aún puede tener utilidad para evaluar a las personas con demencia que no hablan inglés con fluidez, a pesar de los posibles problemas de licencia que haya tenido. Se deberían realizar investigaciones futuras sobre las características del idioma, los años de educación y la edad que afectan sus puntuaciones.10
Además, el ACER cubre una gama más amplia de dominios cognitivos, como la memoria, la fluidez verbal, las funciones visuoperceptivas y ejecutivas, contiene más elementos de memoria y lenguaje. Además, las cinco subpuntuaciones extienden su uso a gran variedad de condiciones neurológicas. El subdominio de fluidez del ACER parece ser tan eficaz como la puntuación total en la detección de TP/deterioro cognitivo leve. Se ha demostrado que el subdominio de lenguaje de esta prueba es una herramienta de detección satisfactoria para la afasia en el accidente cerebrovascular. La accesibilidad de estas subpuntuaciones evalúan tempranamente la capacidad cognitiva.27
Según el estudio de Broche y López,24 se ha demostrado que ACER tiene una mayor sensibilidad y especificidad diagnósticas que otras PCB, fundamentalmente en enfermedades como la enfermedad de Parkinson, la vcDFT, demencia vascular y DCLw.
Para Suriyakumara et al.27 la prueba puede diferir entre subtipos de demencia y ayudar en el diagnóstico diferencial. Se requieren más estudios con el fin de explorar la posibilidad de ACER para diferenciar entre causas de demencia.
Este examen también distingue la EP de los síndromes parkinsonianos atípicos (parálisis supranuclear progresiva y la degeneración corticobasal). La utilidad de ACE-R se ha demostrado en la diferenciación entre demencias y depresión en etapas tempranas. También detecta las disfunciones cognitivas en el síndrome corticobasal.24
En la presente revisión sistemática se analizó la correcta validez del ACE-R. Se demostró su extenso uso en la atención primaria de salud, por ser práctica y económica. Además de su gran sensibilidad y especificidad para el diagnóstico temprano de los trastornos neurocognitivos, como las demencias y el deterioro cognitivo leve. En el estudio se presentaron algunas limitaciones, como la escasa literatura actualizada de la utilidad del ACE-R. Además, pueden ocurrir riesgos de sesgos por la heterogeneidad de las muestras.