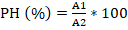INTRODUCCIÓN
El suplemento nutricional LECISAN resulta demandado por sus supuestos efectos antioxidantes. En su composición predominan los fosfolípidos que cumplen funciones estructurales de la membrana celular y proporcionan permeabilidad y carga eléctrica necesarias para que las enzimas y otras proteínas transportadoras de membrana, realicen sus funciones.1,2 Según refieren Suárez-Carmona y col. participan como segundos mensajeros en la transmisión de señales al interior de la célula y activan enzimas que participan en la síntesis de sustancias de señalización celular.3
La lecitina experimenta hidrólisis en el tracto gastrointestinal y origina la formación de N-óxido de trimetilamina (TMAO), que induce mutaciones genéticas y aberraciones cromosómicas estructurales. La colina liberada se desalquila a dimetilamina. La nitrosación puede ocurrir en condiciones fisiológicas y se ha demostrado que 85 % de las nitrosamidas producen cáncer en animales de laboratorio.4 TMAO tiene efecto proinflamatorio, perturba la función endotelial mediante generación de estrés oxidativo (EO).5,6,7
La obesidad se asocia con elevados niveles de marcadores de daño oxidativo debido posiblemente a alteraciones metabólicas en la mitocondria,8 baja defensa antioxidante, inflamación crónica y la generación posprandial de especies reactivas de oxígeno (ROS). La malonildialdehído (MDA) alterada se asocia con un aumento de los triglicéridos.9 Las glutatión transferasas (GST) son cruciales en el proceso de desintoxicación celular al catalizar el ataque nucleofílico del glutatión reducido (GSH) en sustratos electrofílicos tóxicos, y producen un compuesto menos peligroso. Las actividades elevadas de las enzimas catalasa (CAT) y superóxido dismutasa (SOD) pueden ser manifestación de una mayor producción de ROS, especies reactivas del nitrógeno (RNS) y especies reactivas del azufre (RSS) en eritrocitos humanos.10
La eritropoyesis presenta un problema particular para la regulación redox, ya que la presencia de hierro, hemo y cadenas de globina desapareadas conducen a altos niveles de EO mediado por radicales libre.11 El EO tiene un papel importante en la alteración de la integridad de la membrana y la fragilidad de células rojas de la sangre (Red Blood Cells, RBC de sus siglas en inglés), por lo que existen estudios in vitro que los emplean como biomodelos para evaluar efecto redox de la exposición a determinados productos en estudio.12 No existen evidencias mediante estudios no clínicos y clínicos en el contexto cubano que demuestren el efecto antioxidante de este suplemento nutricional desarrollado en el país. El estudio de sus efectos pudiera facilitar el reposicionamiento del mismo como medicamento natural, aspecto que permitiría su uso racional.
Se propone un estudio experimental de farmacología no clínica con el objetivo de determinar el efecto de la lecitina de soya, materia prima empleada para la producción del suplemento nutricional registrado LECISAN®, sobre el estado oxidativo en ratas Wistar y en eritrocitos humanos como biomodelo farmacológico in vitro.
MATERIAL Y MÉTODOS
Se realizaron dos estudios no clínicos. Uno, in vivo en ratas Wistar y otro, in vitro en eritrocitos humanos como biomodelo farmacológico, según test de hemólisis. La investigación se desarrolló durante 2022, en el Centro de Toxicología y Biomedicina (TOXIMED) y el Laboratorio de Ciencias Básicas de la Universidad de Ciencias Médicas de Santiago de Cuba.
Procedimientos de tenencia y manejo de los animales de experimentación
Se utilizaron 18 ratas Wistar de sexo femenino, peso 200 ± 70 gramos y 10 semanas, suministradas por el Centro de Producción de Animales de Laboratorio (CENPALAB), pertenecientes a la categoría sanitaria convencional, con sus correspondientes certificados de calidad higiénico-sanitaria y genética. La manipulación de los animales se realizó según las recomendaciones orientadas al respecto, cumpliendo los procedimientos de cuarentena.13 Se seleccionaron al azar y se albergaron en cajas plásticas traslúcidas (cajas T2), con tapas de rejilla de acero inoxidable, recambiable y encamado previamente esterilizado. El alimento comercial para la especie, suministrado por el CENPALAB (pellet), y el agua, fueron suministrados ad libitum. La habitación contó con régimen de iluminación de 12 h luz y 12 h de oscuridad, temperatura ambiental de 22 ± 2 °C y la humedad relativa de 60 ± 5 %.
Técnicas y procedimientos para determinar estrés oxidativo in vivo
Se dividieron en tres grupos (n= 6). Los grupos experimentales recibieron lecitina de soya por vía oral mediante cánula intragástrica 16 G durante 30 días, a dosis equivalentes a 600 (8,57 mg/kg para el peso de la rata) y 300 (4,29 mg/kg) milígramos/día1 en un humano de peso promedio 70 kg. El grupo control para comparación, sólo recibió la alimentación habitual y el mismo volumen de agua destilada en el momento de la administración. Se determinó el perfil oxidativo en suero, según valores descritos para GSH14, CAT15) y MDA.16
Técnicas y procedimientos para evaluar efecto redox in vitro
Se realizó el ensayo de RBC o test de hemólisis y se desarrolló según el Protocolo No. 37 de Invittox.12
Preparación de las disoluciones y muestras a evaluar
Se emplearon eritrocitos aislados de sangre fresca de voluntarios sanos. Se colectaron muestras de 10 ml y se añadieron en tubos de ensayo con ácido etilendiaminotetraacético (EDTA) (1:10) y el plasma fue separado por centrifugación (2500 r.p.m ( 15 minutos, eppendorf, 5702 R, Alemania) y luego fue descartado. La suspensión de eritrocitos fue lavada con una solución estéril de búfer fosfato (PBS) (PBS: 0,2 g de K2HPO4, 1,8 g de glucosa y 9 g de NaCl, pH 7,4) cuatro veces hasta que el sobrenadante se observó incoloro y el sedimento fue reconstituido (1:40 v/v, 8 ( 10-9 células/ml). La suspensión de RBC, se preparó antes del ensayo.17
La lecitina de soya fue solubilizada en dimetilsulfóxido (DMSO) puro para análisis, y se prepararon tres concentraciones al 0,0625, 0,125 y 0,250 µg/mL, a partir de una disolución preparada con contenido de sólidos totales de 7 mg/ml. Todas las muestras se prepararon por triplicado.
Procedimientos para determinar porcentaje de hemólisis inducido por lecitina de soya en eritrocitos humanos
Las suspensiones de eritrocitos fueron tratadas con PBS (control negativo) y H2O2 (control positivo). Una parte fue dividida en 3 grupos experimentales:
Control negativo (contiene 250 μl de suspensión de eritrocitos, 1250 μl de PBS).
Control positivo (contiene 250 μl de suspensión de eritrocitos, 955 μl de PBS y 300 μl de peróxido de hidrógeno (H2O2) (10 mM)).
Actividad hemolítica de las sustancias de ensayo (contiene 250 μl de suspensión de eritrocitos, 250 μl de las diluciones a diferentes concentraciones de lecitina de soya (L1-0,0625, L2-0,125 y L3-0,250 µg/mL) y 700 μl de PBS).
Todos los grupos experimentales se incubaron durante una hora a 37 °C en baño termostatado (Precisterm Selecta, S-140, España) con agitación cada 10 min en vortex (Heidolph REAX 2000). Finalizada la incubación, los tubos fueron centrifugados con el fin de separar las células intactas y el detritus. Se midió la absorbancia del sobrenadante obtenido a 530 nm en espectrofotómetro UV/VIS (PG Instruments T60, Reino Unido) contra una solución blanco (control negativo) a cada una de las diluciones correspondientes, con el objetivo de determinar el contenido de hemoglobina (hemólisis) mediante el logaritmo del tiempo y la concentración con un enfoque de regresión lineal. El porcentaje de hemólisis se calculó con el empleo de la siguiente ecuación:
Procedimientos para determinar cambios morfológicos de los eritrocitos
Un volumen de 50 µL del sedimento de RBC de cada experimento fue añadido en láminas de vidrio para la realización de un frotis sanguíneo, teñido con Giemsa. Posteriormente las muestras fueron visualizadas en un microscopio de trasmisión de luz (Leica DM 1000, Alemania) acoplado con cámara digital (Leica MC 170 HD, 400(, 2592 ( 1944 pixeles, Alemania). Se consideraron cambios morfológicos observados los inducidos lecitina de soya y por el H2O2 como agente oxidante en los RBC tales como cambio de forma de eritrocitos e integridad de la membrana; presencia/ausencia de deformaciones, y se consideraron otras alteraciones morfológicas.18
Procesamiento estadístico de los datos
Los registros sobre la base de datos permitieron el procesamiento estadístico-matemático de los resultados con el sistema SS©® versión 23.0 (SPSS, Inc., Philadelphia) para WINDOWS©® (Microsoft, Redmond, Virginia). Las diferencias entre los grupos experimentales se evidenciaron mediante test ANOVA de Kruskal Wallis y test post hoc de Dunn con un nivel de significación menor del 5 % para ambos.
Aspectos éticos
Todos los protocolos en el estudio estuvieron sometidos a la consideración, análisis y aprobación del Comité Institucional para el Uso y Cuidado del Animal de Laboratorio.19 Este trabajo forma parte del proyecto “Efectos nutricionales, farmacología y toxicología preclínica del LECISAN®” que tiene el propósito de aportar elementos que avalen el producto, registrado actualmente como suplemento nutricional.
RESULTADOS
Los biomodelos que recibieron lecitina de soya a dosis mínima mostraron valores significativos para CAT y MDA respecto al control, no así GSH, que resultó no significativo. En el grupo que recibió lecitina de soya a dosis máxima todos los marcadores de EO resultaron significativos respecto al control. En el análisis entre los grupos que recibieron la administración, solo se encontró significación para CAT.
Se observó en la CAT tendencia a estabilidad de sus valores en los tres grupos, con variaciones discretas intragrupos. Puede apreciarse la reducción de forma general de las variables estimadas como marcadores de EO en los grupos de administración, que resultó más evidente en el grupo de los animales que recibieron lecitina de soya a dosis máxima (Figura 1).
Se utilizó la prueba de Levene para analizar el porcentaje de hemólisis como prueba estadística inferencial que permitió evaluar la igualdad de las varianzas para los grupos experimentales, lo que posibilitó suponer varianzas distintas y rechazar el supuesto de homogeneidad, al realizar mediciones a diferentes concentraciones, que resultó no significativo en todos los casos.
Los niveles de absorbancia a 530 nm, 540 nm y 575 nm determinados por espectrofotometría aparecen en la Tabla 1. Para las diferentes concentraciones de lecitina de soya, resultaron significativos con valor p < 0.005 en todos los grupos. El test ANOVA de un factor para Kruskal Wallis reveló diferencias significativas en los grupos experimentales a A 540 nm (p= 0,003) y A 575 nm (p= 0,023) y reveló también un comportamiento similar en la comparación de grupos experimentales contra el grupo control.
Tabla 1 Valores de absorbancia determinados para las diferentes concentraciones de lecitina de soya
| A 530 | -0,153±0,26 | 0,284±0,58 | 0,255±0,10 | 0,163±0,001 | 0,128 |
| A 540 | -0,078±0,25c | 0,118±0,24b | 0,331±0,1a | 0,161±0,00 | 0,003* |
| A 575 | -0,064±0,25c | 0,134±0,24b | 0,064±0,44a | 0,166±0,001 | 0,026* |
|
|
|
|
Control + (X±S) | ||
| A 530 | 0,341±0,000 | 0,176±0,000 | 0,334±0,001a | 0,574±0,061 | 0,052 |
| A 540 | 0,242±0,057c | 0,340±0,001b | 0,372±0,001a | 0,769±0,077 | 0,019* |
| A 575 | 0,282±0,000c | 0,363±0,001b | 0,381±0,001a | 0,808±0,080 | 0,041* |
Leyenda: A-absorbancia, L1-0,0625 µg/mL, L2-0,125 µg/mL y L3-0,250 µg/mL, H2O2-peróxido de hidrógeno.
X- media; S- desviación estándar para las series experimentales; *p < 0,05, prueba ANOVA de Kruskal Wallis; letras distintas identifican diferencias en las comparaciones entre grupos, (prueba de Dunn).
Al analizar el porciento de hemólisis inducida por el LECISAN®, comparada con la hemólisis oxidativa inducida el H2O2 en eritrocitos humanos (Tabla 2), resultó significativa en el test ANOVA de un factor, la diferencia para los valores de absorbancia a A 575 nm (p= 0,000). En el resultado de la prueba post hoc de comparaciones múltiples la diferencia de medias fue también significativa para una concentración de 0,125 µg/mL con 24,43 % (p= 0,000) y para una concentración de 0,250 µg/mL con un 44,17 % (p= 0,002).
Tabla 2 Porciento de hemólisis inducida por diferentes concentraciones de lecitina de soya en eritrocitos humanos
| % H A 530 | 44,90±18,45 | 82,82±81,47 | 46,39±21,36 | 0,346 |
| % H A 540 | 29,18±6,43 | 29,73±9,32 | 44,30±19,90 | 0,291 |
| % H A 575 | 27,13±6,44 | 24,43±9,90b | 44,17±19,87a | 0,000* |
| L1-H2O2(X±S) | L2-H2O2 (X±S) | L3-H2O2 (X±S) | ||
| % H A 530 | 57,98±17,39c | 92,97±0,31 b | 48,99±0,16a | 0,002* |
| % H A 540 | 69,38±19,17c | 47,29±0,07b | 43,28±0,01a | 0,001* |
| % H A 575 | 58,86±0,005c | 46,40±1,14b | 43,56±0,02a | 0,019* |
Leyenda: H %-porciento de hemólisis, A-absorbancia (nm), L1-0,0625 µg/mL, L2-0,12 µg/mL, 5 y L3-0,250 µg/mL, H2O2-peróxido de hidrógeno.
X- media; S- desviación estándar para las series experimentales; *p < 0,05, prueba ANOVA de Kruskal Wallis; letras distintas identifican diferencias en las comparaciones entre grupos, prueba de Dunn.
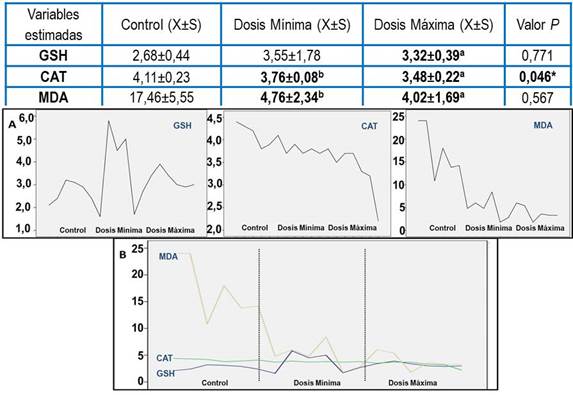
De este modo, el factor concentración influye en la hemólisis, lo que demuestra mayor daño al eritrocito conforme se incrementa la concentración del producto ensayado (Figura 2). Este estudio mostró significación estadística para los valores de absorbancia en todos los grupos experimentales cuando se adicionó H2O2 a las diferentes concentraciones del producto ensayado, lo que evidenció el posible efecto pro-oxidante del mismo.
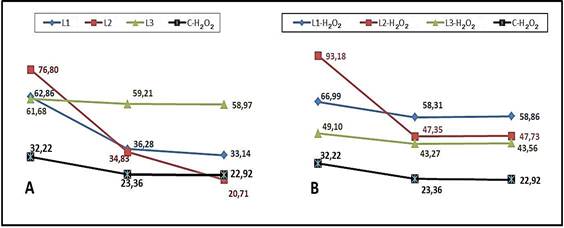
Figura 2 Representación gráfica de medias del porcentaje de hemólisis en eritrocitos humanos. A: exposición a lecitina de soya; B: exposición a lecitina de soya + H2O2.
Las células fantasmas como eritrocitos esféricos degenerados que pierden parcialmente su contenido de hemoglobina, son resultado directo del proceso de hemólisis,20,21 aspecto que se observó en gran medida durante el ensayo, junto a variaciones del color y la forma de los eritrocitos (Figura 3).
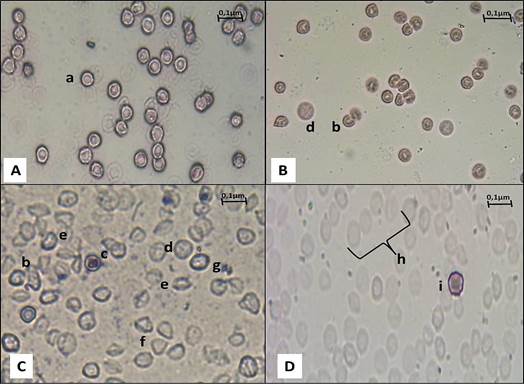
Figura 3 Microfotografías ópticas (400 X) de hematíes para determinación de cambios morfológicos (Giemsa). A: control negativo, B: control positivo, CyD: actividad hemolítica de las sustancias de ensayo (C: diluciones de lecitina, D: lecitina y H2O2). a: hematíe normal, b: hematíe en herradura (queratocito), c: leptocito/dianocito, d: esferocito con punteado basófilo, e: estomatocito, f: dacriocito, g: hematíe macrocítico, h: hematíes fantasmas, i: acantocito.
DISCUSIÓN
La comparación y el análisis tendencial respecto al grupo control, no suplementado, sugiere menor actividad antioxidante del producto según aumenta la dosis o incremento del efecto negativo sobre los procesos que generan radicales libres, que refuerza la hipótesis de que a mayor generación de ROS, estos se acumulan en los tejidos, se hacen más ineficientes los sistemas de defensa antioxidantes y, por ende, se genera mayor daño.9,10) La reducción marcada de MDA, y el muy discreto incremento de GSH, como primera línea de defensa antioxidante en el organismo, encontrados en este estudio, lo sugieren.
La vida útil de los eritrocitos de diferentes mamíferos está correlacionada con los niveles de SOD, glutatión peroxidasa (GSH-Px), y GSH. Es decir, la formación de ERO y la eficiencia de los sistemas antioxidantes intrínsecos, deben estar equilibrados. La CAT es la principal enzima responsable de proteger los RBC del H2O2 extracelular, mientras que la capacidad de GSH-Px para proteger las células, está limitada por la disponibilidad de glutatión, y protege mejor del efecto del H2O2 generado endógenamente, muy cerca de la membrana junto con la autooxidación de la Hb.9,10
En el grupo que recibió dosis mínima, se apreció discreta inversión en estos parámetros, reforzando la hipótesis de que, a menor dosis administrada, solo se modularon funciones fisiológicas que permitieron al animal una ganancia de peso alta. Sin embargo, a mayor dosis administrada, es probable que la reducción de peso esté relacionada con inducción de fenómenos inflamatorios en los tejidos dianas, como consecuencia del estrés oxidativo generado.11,14
Algunos autores consideran que los fosfolípidos de la lecitina activan el sistema de la fosfolipasa A2 y la producción de citocinas inflamatorias como el Factor de Necrosis Tumoral-α (FNT-α) y la Interleucina-1β (IL-1β), que generan una cascada compleja de eventos entre la vasculatura de los tejidos y las células inflamatorias, con producción de selectinas y moléculas de adhesión intracelulares.2,3 Los RBC tienen una potente protección antioxidante que consiste en vías enzimáticas y no enzimáticas que contrarrestan ERO, lo que mantiene así la regulación redox en el cuerpo, ya que durante la respiración aeróbica se producen ROS y RNS a partir de la cadena de transporte de electrones presente en las mitocondrias.11
Estudios recientes sobre RBC nos han proporcionado información detallada de la membrana celular y su organización estructural. La membrana plasmática es una red bidimensional de proteínas llamada esqueleto de membrana de espectrina, que ayuda en el mantenimiento de la estructura de los RBC. El EO, que disminuye la capacidad antioxidante, los daña irreversiblemente, resultando en hemólisis y su eliminación por la circulación. Los mecanismos de la muerte de RBC inducida por el EO se relacionan con la entrada de Ca2+ y la activación de la caspasa, junto con un aumento en los marcadores apoptóticos lo que lleva a la exposición a la fosfatidilserina y la oxidación de la hemoglobina (Hb).11
La proteína de banda 3 (B3p) es un intercambiador de aniones esencial para la homeostasis de los RBC, cuya función se afecta tras EO a nivel de membrana.22,23 Las células eucariotas muestran un sistema redox de membrana plasmática que transfiere electrones desde sustratos intracelulares a aceptores de electrones extracelulares. La eriptosis es provocada por una amplia variedad de xenobióticos y otras lesiones como el EO. La estimulación de la fosfolipasa A2 con liberación del factor activador de plaquetas, activación de la esfingomielinasa, y formación de ceramidas también contribuyen a la eriptosis y puede implicar la estimulación de caspasas con la subsiguiente degradación del citoesqueleto.11
Al superarse el sistema de defensa antioxidante, la Hb dentro y fuera de los RBC sufre una transformación constante a una forma oxidada en un proceso conocido como autooxidación.10 El hierro hemoferroso (Fe2+) se transforma espontáneamente en una forma férrica oxidada (Fe3+), pero en condiciones de EO también se forma un hemo de ferrilo de mayor oxidación (Fe4+). Aunque Fe3+ es una forma no funcional de Hb, el Fe4+ también es extremadamente reactivo con otras moléculas biológicas, debido a su alto potencial redox.22,23
El O2 se une reversiblemente al hierro activo redox, un metal de transición en la Hb humana, que posteriormente se oxida en el aire. Este proceso es similar a la oxidación del hierro en sistemas no biológicos y da como resultado la formación de Metahemoglobina, que no transporta O2 (férrico) (Fe3+) y ROS. En los sistemas biológicos, la Hb se considera un reactivo de Fenton en el que la toxicidad oxidativa se atribuye a la formación de un radical hidroxilo altamente reactivo (OH-) generado por la reacción entre el hierro de la Hb (Fe2+) y el H2O2.24
Las alteraciones morfológicas o dismorfias de los eritrocitos pueden estar relacionadas con variaciones en el tamaño, forma y hemoglobinización y con la presencia de inclusiones citoplasmáticas.20,25 Las células fantasmas se definen como eritrocitos esféricos degenerados que pierden parcialmente su contenido de hemoglobina resultado directo del proceso de hemólisis.21
Las características morfofuncionales de los RBC cambian en respuesta al aumento de la peroxidación lipídica y activación de las enzimas antioxidantes. Los principales factores que regulan la velocidad de tales procesos son la formación de ROS así como la cantidad de compuestos antioxidantes y la actividad de las enzimas que aseguran su descomposición.18
Al tener en cuenta las limitaciones éticas relacionadas con la reducción y refinamiento en la investigación no clínica in vivo, el estudio se realizó con la muestra seleccionada (n= 18) y la investigación se limitó a realizar de manera complementaria un estudio in vitro con eritrocitos humanos tras evaluar la influencia del producto en el estado oxidativo de las ratas con solo tres marcadores de EO, pero se requieren evaluaciones en otros marcadores y en animales machos, en aras de excluir el posible efecto del sexo sobre los resultados obtenidos que permitan profundizar en el entendimiento de estos resultados.