Introducción
La obesidad constituye un problema principal de salud al nivel mundial. En Cuba la prevalencia de sobrepeso y obesidad en la población total tiene un valor de 29,8 % y 13,7 %, respectivamente. La epidemia es especialmente pronunciada en mujeres en edad fértil. Se estima que dos o tres de cada cinco mujeres en edad reproductora están sobrepeso u obesas.1,2
La obesidad pregestacional debe ser considerada como de alto riesgo para la madre y su descendencia. Se asocia a infertilidad, abortos espontáneos, hipertensión inducida por la gestación, diabetes gestacional, nacimiento por cesárea y parto pretérmino.3,4
También trae consecuencias sobre el producto de la concepción: muerte fetal intrauterina sin causas aparentes, patrones de crecimiento alterados y anomalías congénitas. Por otra parte, los hijos de madres obesas tienen mayor riesgo de desarrollar en la adultez obesidad, Diabetes Mellitus tipo 2 y enfermedades cardiovasculares.4
Sin embargo, en la actualidad no se encuentran referencias de estudios que ilustren la proporción de obesidad pregestacional en embarazadas en Cuba.
La obesidad visceral es tan o más importante que la grasa corporal total para la predicción de las complicaciones que tradicionalmente han sido asociadas a la obesidad.5
El análisis de la placenta es clave para entender el desarrollo de estas complicaciones, pues es considerado el órgano regulador del ambiente intrauterino. La adecuada función placentaria representa un punto clave para el embarazo.6 Se hace necesario fomentar las investigaciones con modelos animales, en las que se realice un análisis de la estructura y función placentaria en la obesidad.
La obesidad inducida por glutamato monosódico (GMS) constituye un modelo animal de obesidad visceral con las principales alteraciones metabólicas que se describen en la obesidad humana.7 Se ha empleado muy poco en estudios sobre obesidad y preñez.
Por lo que el objetivo de este trabajo es evaluar la influencia de la obesidad visceral pregestacional sobre el desarrollo placentario y fetal en ratas.
Material y métodos
Tipo de investigación, lugar y período: Se llevó a cabo una investigación longitudinal, prospectiva, explicativa, con diseño experimental, en el ICBP “Victoria de Girón”, desde enero de 2019 hasta diciembre de 2020.
Inducción de Obesidad: Ratas Wistar hembras recién nacidas fueron divididas en dos grupos: ratas a las que se les administró glutamato monosódico (Sigma-Aldrich, 4 mg/g de peso corporal), vía subcutánea (sc), los días 2, 4, 6, 8 y 10 de vida (OBESAS, n=10) y ratas que recibieron NaCl 0,9 %, sc, en los mismos días (CONTROLES, n=10).7
Los animales se mantuvieron bajo condiciones controladas de temperatura (22 ± 3°C), luz (ciclos de 12h luz/oscuridad) y humedad relativa (60± 5 %). A los 21 días fueron destetados y colocados 4 ó 5 animales por caja hasta los 90 días en que fueron ubicados en cajas independientes. Se les suministró agua y alimento (pienso granulado, Fórmula CMC 1000 producida por CENPALAB) a libre demanda durante todo el experimento.8
A los 90 días de vida, a los animales del grupo inyectado con GMS se les determino el índice de Lee, mediante la raíz cúbica del peso corporal (g) dividido entre la longitud corporal (LC) (cm) como indicador de obesidad. Se consideraron obesas las ratas con IL> 0,300.9
Inducción de la preñez: a los 120 días de vida las ratas obesas y controles fueron apareadas durante la noche con machos sanos de la misma cepa, en las fases pro-estro y estro del ciclo estral. La mañana en que se confirmó la cópula por la presencia de espermatozoides en el lavado vaginal se consideró el día 0 (cero) de la gestación.7
Eutanasia y recogida de muestras: A los 20 días de gestación, se les realizó eutanasia por punción de la vena cava inferior y desangrado bajo anestesia con tiopental sódico (50-60 mg/kg). Seguidamente, se llevó a cabo perfusión transcardíaca con PBS 0,1 M, pH 7,4 para la eliminación de restos de la sangre de los tejidos.10
Se realizó la disección de los cuernos uterinos y se colocaron en una placa Petri (100 mm) a temperatura ambiente. Bajo estereoscopio (Motic SMZ-143), se eliminó el tejido periuterino, la pared del útero se abrió en toda su longitud y se retiraron cuidadosamente todas las membranas. Cada feto se colocó de forma independiente en una placa Petri con NaCl 0,9 % para la determinación de variables de crecimiento. A la placenta del feto más cercano al cérvix de cada cuerno uterino se les realizó un corte transversal por delante del cordón umbilical. El fragmento que contiene el cordón fue fijado en formalina tamponada a 10 % para estudios histológicos. Las placentas restantes fueron almacenadas a -80 °C para determinaciones bioquímicas.
Criterios de exclusión: ratas que no se preñaron a los 30 días de iniciar el apareamiento (150 días de vida). Durante 30 días, se producen entre 5 y 6 ciclos estrales, lo cual es suficiente para que una rata fértil quede gestada.8
Variables que se determinaron en placenta
Conteo de los sitios de osificación (esternales, falángicos anteriores, metacarpianos, falángicos posteriores, metatarsianos y vertebras caudales): se llevó a cabo con la tinción rojo de alizarina de los tejidos óseos. El rojo de alizarina se fija en las zonas donde hubo deposición de calcio. La realización del conteo de los sitios de osificación se hizo bajo estereoscopio (Motic SMZ- 143).
Procesamiento estadístico
Se utilizaron el programa INFOSTAT y el paquete STATISTICA (versión 10.0). Los datos se reportan como valores de la media ± la desviación estándar. Se empleó la prueba no paramétrica U de Mann-Withney para la comparación entre los grupos, debido a la no distribución normal de las variables. Las diferencias se consideraron significativas con valores de p<0,05. Para realizar el análisis de las láminas se utilizó el software imagen J.
Consideraciones éticas
Los animales fueron obtenidos del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). El Comité de Ética para la investigación de nuestra institución aprobó los protocolos usados en este estudio. El trabajo con los animales tuvo en cuenta las regulaciones o pautas establecidas para el cuidado y uso de los mismos.
Resultados
En relación con los indicadores de crecimiento somático (Tabla 1), los descendientes (n=88) de las ratas obesas presentaron una disminución significativa del peso corporal, del diámetro craneano anteroposterior y biparietal, así como de la longitud de la cola que los del grupo control (n=102). No se observaron diferencias estadísticamente significativas entre la longitud corporal de los fetos de las ratas obesas y controles.
Tabla 1 Indicadores de crecimiento somático y desarrollo fetal
| Variables | Controles | Obesas |
|---|---|---|
| Crecimiento fetal | ||
| Peso corporal (g) | 3,85 ± 0,4 | 3,65 ± 0,4 |
| Longitud corporal (mm) | 22,9 ± 1,7 | 23,3 ± 2,6 |
| Longitud de la cola (mm) | 13,4 ± 0,8 | 12,8 ± 0,7 |
| DAP (mm) | 0,75 ± 0,1 | 0,72 ± 0,2 |
| DBP(mm) | 0,52 ± 0.1 | 0,44 ± 0,1 |
| Desarrollo fetal (Sitios de osificación) | ||
| Esternales | 5,61 ± 0,77 | 5,24 ± 1,21 |
| Falángicos anteriores | 4,00 ± 0,00 | 0,86 ± 1,66 |
| Falángicos posteriores | 5,00 ± 0,00 | 1,21 ± 2,17 |
| Metacarpianos | 4,00 ± 0,00 | 3,05 ± 0,62 |
| Metatarsianos | 5,00 ±0,00 | 3,54 ± 0,83 |
Se presenta el valor promedio ± la desviación estándar de cada variable. DBP: diámetro craneano biparietal; DAP: diámetro craneano anteroposterior.
* Diferencia significativa comparado con grupo control; p < 0,05 (Prueba U de Mann-Whitney).
El porciento de fetos clasificados como pequeños para la edad gestacional del grupo de las ratas obesas fue significativamente superior respecto al control. (Tabla 2).
Tabla 2 Clasificación de los fetos según su peso corporal
| Variables | Controles (n=10) | Obesas (n=11) |
| PEG (%) | 4,95 | 16,09 |
| AEG (%) | 73,27 | 77,01 |
| GEG (%) | 21,78 | 14,94 |
PEG: Pequeños para su edad gestacional, AEG: Adecuado para su edad gestacional y GEG: Grande para su edad gestacional
* Diferencia significativa comparado con grupo control; p < 0,05
El conteo de los centros de osificación, que permite evaluar el desarrollo fetal, mostró que los fetos de las ratas obesas presentaron significativamente menor cantidad de sitios de osificación a nivel metatarsiano, metacarpiano y falángico. (Tabla 1).
No hubo diferencias significativas en el peso de las placentas. (Tabla 3). Sin embargo, cuando se calculó la relación entre el peso placentario y fetal para estimar la eficiencia de la placenta en el aporte nutricional al feto, el grupo de ratas obesas mostró mayor índice placentario con respecto al control.
Tabla 3 Variables determinadas en placentas de ratas controles y obesas
| Variables | Controles (n=10) | Obesas (n=11) |
| Peso (g) | 0,56 ± 0,1 | 0,57 ± 0,1 |
| Índice placentario | 0,15 ± 0,03 | 0,16 ± 0,03* |
| Colesterol (mmol/mg de proteína) | 0,12 ± 0,05 | 0,18 ± 0,09 |
| Triacilgliceroles (mmol/mg de proteína) | 0,10 ± 0,08 | 0,18 ± 0,09* |
| PDF(nmol/mg de proteína) | 3,8 ± 1,8 | 3,6 ± 2,9 |
| MDA(umol/mg de proteína) | 5,0 ± 2,3 | 5,9 ± 2,8 |
| PAOP(umol/mg de proteína) | 0,04 ±0,03 | 0,08 ±0,03 |
| GSH (mmol/mg de proteína) | 0,32 ± 0,2 | 0,40 ± 0,2 |
Se presenta el valor promedio ± la desviación estándar de cada variable. PDF: productos de la fragmentación de la 2-desoxirribosa, MDA: malonildialdehído, PAOP: productos avanzados de la oxidación de proteínas, GSH: glutatión reducido. * Diferencia significativa comparado con grupo control; p < 0,05 (Prueba U de Mann-Whitney).
Desde el punto de vista microscópico en la fotomicrografía (Figura 1 A) se observa la disposición de las zonas placentarias en el grupo control.
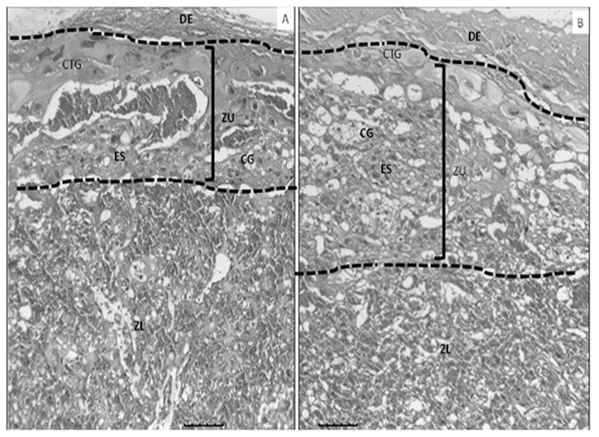
Figura 1 Fotomicrografía de placenta de rata (H/E) grupo control (A) y obesa (B). Ubicación y componentes celulares de las zonas de la placenta en el 20E
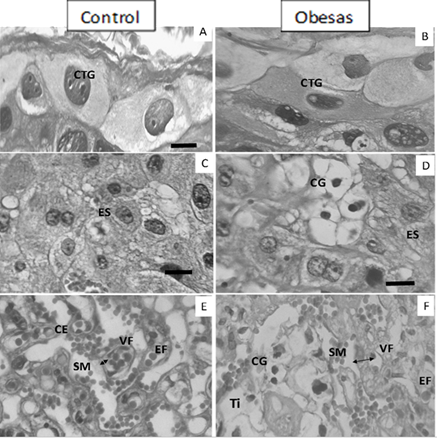
Externamente, adyacentes a la decidua materna, se encuentran las células gigantes del trofoblasto, dispuestas en una capa de 1 a 2 células de espesor (Figura 2 A). Son de gran tamaño (aproximadamente de 30-50 μm de ancho y 50-100 μm de largo). Tienen citoplasma eosinófilo, un núcleo central, redondo, grande y basófilo que posee de 1 a 3 nucléolos. Además, se pueden observar núcleos hipo o hipercromáticos con presencia o no de vacuolas.
La zona de unión, espongiotrofoblasto o trofoespongio (Figura 2 C) es la zona intermedia rodeada por las células gigantes. Donde se encuentran abundantes células pequeñas con citoplasma claro, eosinófilo, un núcleo redondo, central y basófilo con un nucléolo prominente. También se observan algunos vasos sanguíneos maternos. Hay escasas células ricas en glucógeno dispersas en la zona.
El laberinto (Figura 2 E) estructuralmente está muy organizado formando amplios lúmenes correspondientes a los sinusoides maternos y los capilares fetales, rodeados por capas de células trofoblásticas que conforman la delgada membrana placentaria.
En la fotomicrografía 1 B se observa la disposición de las zonas placentarias en el grupo obesas. Las células gigantes (Figura 2 B) se alinearon en monocapa y raramente en 2 células de grosor. Los núcleos de estas células presentan forma redondeada haciéndose alargados, hipo o hipercromáticos y con abundantes vacuolas. El citoplasma se mostró más alargado y angosto.
En la región del espongiotrofoblasto (Figura 2 D) se observa aumento de las células de reserva de glucógeno, lo cual no se corresponde para el día 20 de edad gestacional en la placenta de rata, estas células presentan un aspecto vacío en su citoplasma y se agrupan en forma de quistes. Las células del espongiotrofoblasto mantienen su estructura y la forma de sus núcleos, aunque se observa cierto aumento de esta zona con respecto al control.
En el laberinto (Figura 2 F) se visualiza desorganización en su arquitectura. En él se observan los sinosoides maternos (amplios espacios que contienen sangre materna) y un aumento de los espacios intersticiales. El espacio entre el vaso fetal y el sinosoide materno se encuentra engrosado; respecto al control óseo hay mayor número de células trofoblásticas (membrana placentaria) entre el vaso fetal y el sinosoide materno y se puede encontrar incremento de células de reserva de glucógeno formando también quistes en esta zona.
Al realizar la comparación entre el área de sangre materna en el laberinto de ambos grupos, encontramos que esta se encuentra incrementada en el grupo control con disminución en el grupo obesa. Mientras que el área correspondiente al trofoblasto se incrementó en el grupo obesa con respecto al control. (Figura 3).
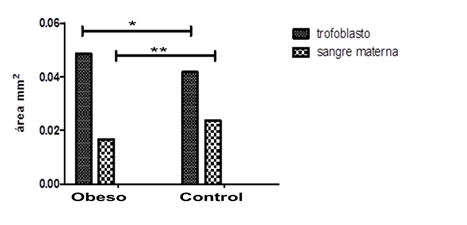
Figura 3 Áreas de trofoblasto y de sangre materna en la zona del laberinto de placentas de ratas obesas y controles.
En el análisis estadístico, como se observa en dicha figura, gráficodeterminación de dichas áreas en ambos grupos mostró diferencias significativas para las dos variables.
El contenido placentario de TAG fue significativamente superior en las ratas obesas con respecto a los controles. En cuanto al contenido placentario de colesterol no se observaron diferencias estadísticamente significativas. Tampoco se observaron diferencias significativas en la capacidad antioxidante y en los marcadores de daño oxidativo a biomoléculas en las placentas entre ambos grupos. (Tabla 3).
Discusión
Los fetos de las ratas obesas mostraron menor crecimiento y desarrollo con respecto a los fetos de las ratas controles. (Tabla 2). En la descendencia de las obesas se vio afectado un número mayor de variables de crecimiento (Tabla 2), comparado con un estudio previo realizado por nuestro grupo de investigación con el mismo modelo pero con menor tiempo de evolución de la obesidad.7,12 Esto indica que con mayor tiempo de evolución de la obesidad se desarrolla un fenotipo de crecimiento intrauterino retardado más severo. La restricción del crecimiento fetal también ha sido constatada por otros investigadores tanto en la obesidad humana como en otros modelos de obesidad en roedores.13,14
El crecimiento fetal es un proceso dinámico y complejo controlado por un amplio rango de factores maternos, placentarios y fetales.15 Son varios los mecanismos fisiopatogénicos que pudieran estar involucrados en la disminución del crecimiento fetal en la obesidad inducida por GMS. En mamíferos, el crecimiento intrauterino depende del suministro de nutrientes desde la madre hacia el producto de la concepción, por lo cual la disminución en el crecimiento de la descendencia en las ratas obesas podría deberse, en parte a la disminución de la ingesta alimenticia y energética que experimentan estos animales. Lo anterior lleva a reducción en la ganancia de peso durante la gestación y menor peso fetal.7
El suministro placentario de nutrientes al feto, es un proceso que ocurre por mecanismos de difusión simple y de transporte pasivo. El exceso de glucocorticoides maternos, característico de este modelo7 reduce el suministro de aminoácidos y glucosa hacia el embrión o feto. Los glucocorticoides incrementan la expresión de la proteína 1, regulada por el desarrollo y la respuesta al daño al ADN (Redd1) al nivel placentario, la cual disminuye la expresión de transportadores de nutrientes (glucosa o aminoácidos) o pudiera bloquear la translocación de transportadores de nutrientes hacia la membrana plasmática.16 También la exposición a exceso de glucocorticoides conduce a desarrollo anormal del tejido trofoblástico.17
La regulación del transporte de nutrientes está estrechamente ligada al concepto de eficiencia placentaria. Otro de los resultados constatados en este trabajo es el aumento significativo del índice placentario en el grupo de las obesas, lo que indica falta de capacidad del órgano para garantizar el crecimiento y desarrollo adecuado del feto, ya que por gramos de placenta no se suministra la cantidad de nutrientes necesarios para un peso adecuado del feto. Este fenotipo se corresponde con un área de superficie de intercambio reducida con aumento del espesor asociado a restricción del crecimiento fetal.18
En las placentas estudiadas desde el punto de vista histológico se observó una completa definición estructural de las tres zonas: zona del laberinto, zona de unión y zona de decidua. Sin embargo, al nivel del laberinto se incrementó el espacio intersticial (Figura 1 B3) y el área ocupada por células trofoblásticas, así como disminuyó el área correspondiente a los sinusoides maternos en el grupo de las obesas. ( Figura 2). Esto pudiera justificar el incremento del índice placentario encontrado.
La zona del laberinto es la de mayor grosor, ocupando las tres cuartas partes de la placenta y en ella ocurre el intercambio materno-fetal de nutrientes y sustancias de desecho. Por lo cual, estas alteraciones pudieran provocar el aumento del grosor de la membrana vasculosincitial que separa las circulaciones materna y fetal disminuyendo el traspaso de nutrientes de la madre al feto.19
También se observó en las placentas obesas mayor cantidad de células de reserva de glucógeno con citoplasmas de aspecto vacío, organizadas en forma quistes en el espongiotrofoblasto y presencia de estas con similar organización en la zona del laberinto. (Figura 1). El contenido de glucógeno (por consiguiente las células de reserva de glucógeno) en la gestación normal disminuye al finalizar la preñez al mismo tiempo que se adelgazan las células gigantes y se expande el compartimento laberíntico.19 El aumento de las células de reserva de glucógeno en ambas zonas placentarias, así como el incremento del espacio intersticial pudiera ser consecuencia de la acumulación de lípidos, específicamente triacilgliceroles en la placenta de las ratas obesas. (Tabla 1).
La obesidad inducida por GMS se caracteriza por hiperlipemia y acumulación ectópica de lípidos.20,21 En este estudio se constató un incremento significativo de los TAG en homogeneizado de placentas de las ratas obesas. (Tabla 1). El depósito de estos lípidos al nivel de la placenta pudiera estar relacionado con el aumento del espesor del área de intercambio, lo cual afecta el crecimiento del producto de la concepción.
La acumulación de TAG al nivel placentario pudiera estar relacionado con cambios asociados a la obesidad materna en la transcripción de genes en la placenta. Por ejemplo, la activación de genes STARD7. Los cuales se expresan en el tejido trofoblástico y están relacionados con proteínas que transportan lípidos hacia la placenta como la SLC27A1 (proteína 1 transportadora de ácidos grasos).22,23 La obesidad también se asocia con una disminución de ANGPTL4 (angiopoietin-like protein 4),24,25) potente inhibidor de la lipasa de lipoproteína (LPL), por lo que en gestantes obesas se incrementa la actividad de dicha enzima.26
La LPL degrada los TAG contenidos en las VLDL y quilomicrones en ácidos grasos y glicerol. Los ácidos grasos son captados por la placenta y reesterificados al glicerol, formando los TAG dentro de estas células. Lo anterior favorece el aumento de las reservas grasas.24
El acúmulo de lípidos en la placenta también está relacionado con el incremento de CIDE-A (cell death-inducing DFF45-like effector) observado en placentas de gestantes obesas. CIDE-A regula negativamente los niveles de la proteína kinasa dependiente de AMP (AMPK) mediante la ubiquitinación y degradación de la misma. La AMPK fosforila a la enzima reguladora de la biosíntesis de ácidos grasos, la acetil CoA carboxilasa, bloqueando su polimerización e inactivándola54. La inhibición de AMPK favorece entonces la síntesis de ácidos grasos, precursores de los TAG.24
Otro mecanismo pudiera ser la incorrecta morfogénesis de los vasos placentarios, la que induce alteraciones en el paso de sustancias al feto en desarrollo con efectos nocivos en su crecimiento. La obesidad materna está asociada a inflamación placentaria, la cual se caracteriza por un incremento en la infiltración y actividad de macrófagos, así como elevación de citokinas proinflamatorias.27,28 En la literatura se reporta que la lipotoxicidad al nivel de la placenta aumenta la actividad de la vía de señalización JNK/NF-kB (proteína kinasa del dominio N-terminal de la proteína c-Jun /factor nuclear- kappa B). Ante esta respuesta proinflamatoria se activa la transcripción de factores Foxo4 (proteína O4 forkhead box). Indirectamente FOXO4 inhibe HIF1 (factor 1 inducible por hipoxia), el cual media la transcripción de genes relacionados con la angiogénesis en la placenta, dentro de los que se incluye el VEGF (factor de crecimiento endotelial vascular). Por tanto, la obesidad genera alteraciones en la angiogénesis placentaria.29
También pudiera incidir en el menor crecimiento de la descendencia de las madres obesas la ocurrencia de apoptosis de un número limitado de células del blastocisto. La hiperlipemia materna pudiera inducir la apoptosis.7
El ambiente lipotóxico de la placenta también induce estrés oxidativo.24 En el presente estudio se observó que no hay diferencias significativas en los marcadores de daño oxidativo a biomoléculas al nivel placentario al comparar las obesas con los controles. (Tabla 1). En la literatura se han reportado estudios donde se ha demostrado que la expresión de catalasa y superóxido dismutasa están considerablemente elevados en la zona del laberinto de placentas de ratas. Sugiriendo que el incremento de la capacidad antioxidante de la placenta puede enfrentar la alta actividad metabólica de esta zona en la gestación. También en la placenta a término de mujeres obesas se incrementa la actividad de enzimas antioxidantes como superóxido dismutasa, catalasa y glutatión peroxidasa al comparar con mujeres normopeso.30 Estos datos sugieren un mecanismo de adaptación protector que minimiza el daño oxidativo al nivel placentario.
Por otro lado, la obesidad inducida por GMS constituye un modelo de obesidad visceral, por lo que la acumulación de grasa intra-abdominal pudiera ser un factor mecánico que afecta el crecimiento intrauterino.7
Limitación del estudio: No se pudo realizar la tinción con aceite rojo para la identificación de lípidos al nivel placentario por falta de disponibilidad de recursos, con lo cual se enriquecerían los resultados de este estudio.
Conclusiones
La obesidad pregestacional ejerció un efecto perjudicial sobre el desarrollo placentario, lo cual ocasionó restricción del crecimiento fetal, probablemente mediado por la disminución de intercambio materno-fetal de nutrientes y oxígeno. Lo anterior pudiera deberse a la acumulación ectópica de lípidos en la zona del laberinto.