Introducción
Han transcurrido 115 años, desde que el eminente neurólogo Alois Alzheimer identificara la enfermedad que lleva su nombre.1 La enfermedad de Alzheimer (EA) representa dos tercios del total de los casos con demencia, con una estimación global de más de 50 millones de personas afectadas; cifra que para 2050 pudieran sobrepasar los 130 millones.2,3,4
Por definición, la EA es una enfermedad neurodegenerativa cerebral primaria, progresiva e irreversible, de etiología orgánica multicausal, que conlleva a un deterioro global de la personalidad y las funciones cognitivas, con pérdida de la capacidad funcional sin alteración de la conciencia.5 Los procesos cognitivos mediados por el hipocampo y la corteza prefrontal son los más vulnerables en esta enfermedad.6 Por consiguiente, el diagnóstico clínico de la EA puede alcanzar hasta 90 % de certeza, mediante la aplicación de pruebas neuropsicológicas específicas.7
En la última década, el diagnóstico de la EA presenta modificaciones significativas.8 Dubois y colaboradores, señalan tres etapas de la enfermedad: la preclínica; la prodrómica y la de demencia.9 Por otra parte, el Instituto Nacional de Envejecimiento y la Asociación de Alzheimer, (NIA-AA, siglas del inglés National Institute of Aging and Alzheimer’s Association) define la EA mediante el uso de los biomarcadores; que permiten detectar daños cerebrales décadas antes de la aparición de los síntomas.10,11
El factor neurotrófico derivado del cerebro (BDNF, siglas del inglés Brain Derived Neurotrophic Factor), es la neurotrofina más difundida y estudiada del Sistema Nervioso Central; regula la sobrevivencia, la diferenciación y la plasticidad neuronal.12 Estudios demuestran que las vías de señalización del BDNF se afectan en la EA; alterando así los procesos celulares de la memoria.13,14
La literatura referente a la EA plantea dos hipótesis en cuanto a los niveles de expresión del BDNF: que la disminución del BDNF afecta los mecanismos de neuroplasticidad10,15,16 o que su incremento es un intento regenerativo compensatorio en la EA preclínica.17 Estudios del BDNF en la EA, reportan una reducción inicial de 21-30 %, que se incrementa a 40 % en el estadio severo.16
En la actualidad, no existen tratamientos farmacológicos curativos para la EA, ni biomarcadores con un efecto modificador en el diagnóstico.3,10,14,18 Por ello, desde la hipótesis que plantea la reducción del BDNF en la EA; la presente investigación tiene como objetivo analizar en pacientes cubanos, la posible asociación entre las funciones cognitivas y los niveles séricos del BDNF.
Materiales y métodos
Diseño y población de estudio
El presente estudio es de tipo correlacional-transversal que incluyó senescentes atendidos en el Departamento Comunitario de Salud Mental, municipio San Antonio de los Baños, Cuba; de febrero-2015 hasta agosto-2019.
El grupo de estudio estuvo constituido por 64 personas con edad superior a 65 años, sin antecedentes patológicos personales o detección de: hipotiroidismo, anemia, hipovitaminosis B12 y trastornos psiquiátricos o neurológicos que repercutieran en el rendimiento cognitivo. Dicho grupo se dividió según la evaluación clínica en tres grupos: grupo Control n=16, grupo DCL, deterioro cognitivo leve n=27 y grupo EA n=21.
Evaluación clínica
En primer lugar, se explicaron los objetivos de la investigación y se obtuvo el consentimiento informado. A continuación, se realizó una entrevista semiestructurada, un examen neurológico y estudios complementarios hemáticos, imagenológicos entre otros. Para descartar otras causas de afectación cognitiva y complementar el diagnóstico clínico, se aplicaron instrumentos clínicos estandarizados: la escala de Depresión Geriátrica, (GDS, siglas del inglés Geriatric Depression Scale) y de Hamilton para la ansiedad; la escala Clínica de Demencia, (CDR, siglas del inglés Clinic Demetia Rating), el cuestionario de Actividad Funcional de Pfeffer, (PFAQ, siglas del inglés Pfeffer Functional Activities Questionnaire).
Para la obtención de las variables cognitivas se aplicó una batería de pruebas neuropsicológicas que incluyó: el examen Mínimo del Estado Mental, (MMSE, siglas del inglés Mini Mental State Examination);19 la prueba de aprendizaje de listas de palabras y recuerdo diferido (SELVT, siglas del inglés Spanish English Learning Verbal Test);20 la prueba de copia y recuerdo diferido de la Figura Compleja de Rey-Osterrieth;21 la prueba del trazo parte B-A (TMT, siglas del inglés Trial Making Test).21 la prueba de fluidez verbal semántica para la categoría animales y fonológica para la letra f; la prueba Dígito Spam Verbal y la de cubos de Corsi.
Al concluir el diagnóstico clínico, se estratificaron los diferentes grupos de estudio según los criterios diagnósticos de Trastorno neurocognitivo menor y mayor debido a EA, del Manual Diagnóstico y Estadístico de los Trastornos Psiquiátricos en su quinta edición, de la Asociación Americana de Psiquiatría (DSM-V, siglas del inglés Diagnostic Statistic Manual)22; del Instituto Nacional de Trastornos Comunicativos y Neurológicos e Infartos y la Asociación de Trastornos Relacionados a la EA, (NINCDS-ADRDA, siglas del inglés, National Institute of Neurological and Conmunicative Disorders and Stroke and AD Related Disorders Association)11 y la Clasificación Internacional de Enfermedades, edición No.10 (CIE-10).
Cuantificación sérica del BDNF
La cuantificación de los niveles de BDNF se obtuvo en suero de sangre total, extraída mediante punción venosa antecubital en la mañana y centrifugada a 1 800 rpm durante 10 minutos a temperatura ambiente; suero que se almacenó en tubos cónicos secos a -20 0C. El análisis del BDNF se realizó por el método inmunoenzimático, kit de ELISA (siglas del inglés Enzyme Linked Immunosorbent Assay) de doble sitio de anticuerpos, BDNF Emax Sistema de Inmunoensayo, Promega Emax, Madison, WI, USA. La concentración de BDNF se determinó por la intensidad del color a 450 nm utilizando un lector de microplaca SLT Spectra, SLT Instrumentos, Salzburg, Austria. Los valores se expresaron en ng/mL.
Análisis estadístico
Los datos se analizaron con el programa StatSoft Inc. 2011. STATISTICA, versión.10; se presentaron en medias y derivaciones estándar con un nivel de significación de p<.05. Desde un inicio, se comprobó la distribución normal de la muestra mediante la prueba de Kolmogorov-Smirnov. A continuación, se realizó la comparación de medias de las variables entre los grupos, a través de las pruebas de análisis de varianza de una sola vía y post hoc Dunnett. Para estimar la posible asociación entre el BDNF y los marcadores cognitivos, se halló el coeficiente de correlación de Pearson.
Consideraciones éticas
El estudio se llevó a cabo siguiendo los principios éticos de la Declaración de Helsinki.23) y se aprobó por el Comité de Ética del Sectorial de Salud Municipal de San Antonio de los Baños. Se obtuvo el consentimiento informado por escrito de los participantes bajo la tutela de un familiar, los criterios de voluntariedad y confidencialidad. A las personas excluidas, se les mantuvieron los beneficios de la atención médica del equipo de trabajo.
Resultados
Datos demográficos
La comparación de medias mediante la prueba de ANOVA de una vía, evidenció diferencias para la edad, pero no para los años de estudio ni el género. El grupo más añoso fue el EA (M=82,9) y el menos calificado (M=5,9); con gravedad de la demencia leve en 66,7 %, moderado en 14,3 % y severo en 19 % (Tabla 1).
Tabla 1 Caracterización demográfica según grupos de estudio
|
|
|
|
||
| Control | 16 | 9/7 | 73,5 |
8,8 |
| DCL*1 | 27 | 13/14 | 78,0 |
6,5 |
| EA*2 | 21 | 11/10 | 82,9 |
5,9 |
| Valor p | - | .5 | .001 | .08 |
Nota: *1DCL: Deterioro Cognitivo Leve; *2EA: enfermedad de Alzheimer; *3F/M: femenino y
masculino; *4M±DE: media más menos derivación estándar. ANOVA de una vía p˂.05.
Marcadores cognitivos
El análisis de comparación de grupos evidenció diferencias entre medias para todas las variables cognitivas, prueba de ANOVA de una vía y post hoc Dunnett p<.05. La diferencia más significativa la estableció el funcionamiento cognitivo global, MMSE; la memoria episódica, recuerdo diferido SELVT y copia Figura Compleja de Rey-Osterrieth; y la función ejecutiva, TMT-B-A, p<.001.19,20,21) El grupo EA fue el de mayor deterioro en todos los dominios cognitivos, (Tabla 2 y Figura 1).
Tabla 2 Comparación de medias y derivaciones estándares de variables cognitivas según grupos de estudio
|
|
|
|||
|---|---|---|---|---|
|
|
|
|||
| MMSE*5 | 27,8±1,5 | 24±0,7 | 20±23 | .001 |
| PALP-RI*6 | 35,8 |
3,8±3,9 | 15,6±4,1 | .01 |
| PALP-RD*6 | 10,1 |
6,1±1,2 | 1,5±1,3 | .001 |
| Fig Rey-RI*7 | 32,2 |
31,4±1,6 | 14,2±3,5 | .01 |
| Fig Rey-RD *7 | 17,1 |
10,8±2 | 2,8±3,4 | .001 |
| TMT B-A*8 | 60,6 |
115±27,9 | 176,6±20,2 | .001 |
| Dígitos progresión | 4,9 |
4,3±0,4 | 3±0,3 | .01 |
| Cubos de Corsi | 4,6 |
4,2±0,6 | 2,5±0,5 | .02 |
| FV Fonológica*9 | 8,2 |
7,5±2,3 | 5,1±0,8 | .01 |
| FV Semántica*9 | 14,1 |
12,6±2 | 6,5±1.5 | .03 |
Nota:*1M±DE: media±:derivación estándar; *2DCL: deterioro cognitivo leve;*3EA: enfermedad de Alzheimer;*4 valor p de ANOVA: análisis de la varianza (siglas del inglés: analysis of variance);*5MMSE:miniexamen del estado mental(siglas del inglés mini mental state examination); *6 PALP-RI y RD: prueba de aprendizaje de lista de palabras recuerdo inmediato y diferido;*7Fig Rey-RI y RD: prueba copia de Figura compleja de Rey recuerdo inmediato y diferido;*8TMT-B-A: Trial Making Test part B-A (siglas del inglés prueba del trazo partes A, B, B-A);*9 prueba de fluidez verbal fonológica y semántica
Prueba de ANOVA de una vía, p<.05.
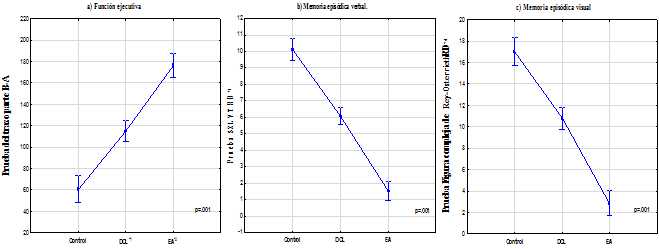 Nota: *1DCL: deterioro cognitivo leve; *2EA: enfermedad de Alzheimer; *3SELVT RD: Prueba de aprendizaje de listas de palabras y recuerdo diferido (siglas del inglés Spanish English Verbal Learning Test); *4Figura Compleja de Rey-Osterrieth Prueba y recuerdo diferido. ANOVA de una vía, p. 001.
Nota: *1DCL: deterioro cognitivo leve; *2EA: enfermedad de Alzheimer; *3SELVT RD: Prueba de aprendizaje de listas de palabras y recuerdo diferido (siglas del inglés Spanish English Verbal Learning Test); *4Figura Compleja de Rey-Osterrieth Prueba y recuerdo diferido. ANOVA de una vía, p. 001.Fig. 1 Comparación de medias y derivaciones estándares de la función ejecutiva, memoria episódica verbal y visual de los grupos de estudio.
Niveles séricos de BDNF
La comparación de medias de los grupos mostró diferencias muy significativas para la cuantificación de los niveles séricos de BDNF; p=.001, pruebas de ANOVA de una vía y post hoc Dunnett. El grupo con demencia EA (M±DE=16,5±2,8ng/mL) evidenció la menor media de BDNF, que contrastó con la del grupo DCL (M±DE=21,1±3,9 ng/mL) y el grupo control (M±DE=26,5±3,8 ng/mL). Fue más significativa la diferencia de medias entre el grupo control sano y el grupo de riesgo o DCL, p=.01; que entre los grupos DCL y EA, p=.05, Figura 2. Por otra parte, no se observaron diferencias de los niveles séricos del BDNF según el género, femenino de (M±DE=22,5±5,3ng/mL) y masculino de (M±DE=20,6±4,3ng/mL), p=.05.
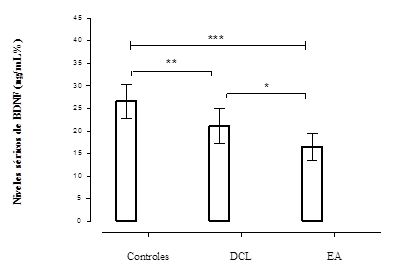 Nota: BDNF: factor neurotrófico derivado del cerebro (siglas del inglés Brain Derived Neurotrophic
Factor); DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; *p(.05, **p(.01 y ***p(. 001.
Nota: BDNF: factor neurotrófico derivado del cerebro (siglas del inglés Brain Derived Neurotrophic
Factor); DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; *p(.05, **p(.01 y ***p(. 001.Fig. 2 Niveles de séricos BDNF en los grupos estudiados, prueba t-student, p(.05.
Correlación entre los niveles séricos de BDNF y marcadores cognitivos
Para demostrar la asociación entre los niveles séricos de BDNF y los marcadores cognitivos en los grupos de estudio, se realizó la prueba de correlación de Pearson. En el grupo EA, correlacionaron con el BDNF las variables cognitivas funcionamiento cognitivo global r=.5; p=.02; la función ejecutiva r=-.51, p=.02; y la memoria episódica verbal r=.7; p=.001, Figura 3 b-d. Sin embargo, en el grupo DCL solo la función ejecutiva correlacionó con el BDNF, r=-.59, p=.001, Figura 3a; con un mayor efecto inclusive que en el grupo EA. La mayor correlación de todas se observó en el grupo EA, entre el BDNF y la memoria episódica verbal.
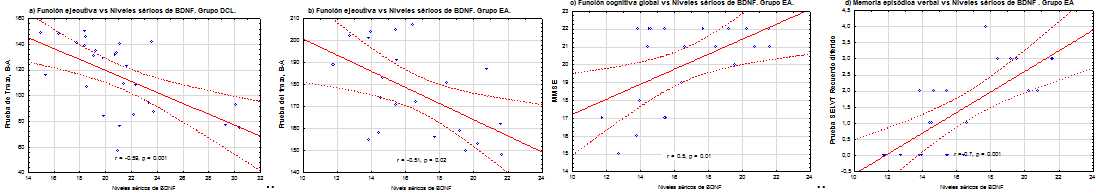 Nota: DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; MMSE:miniexamen del estado mental (siglas del inglés mini mental state examination); SELVT RD: Prueba de aprendizaje de listas de palabras recuerdo diferido (siglas del inglés Spanish English Verbal Learning Test); BDNF: factor neurotrófico derivado del cerebro (siglas del inglés Brain Derived Neurotrophic Factor)
Nota: DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; MMSE:miniexamen del estado mental (siglas del inglés mini mental state examination); SELVT RD: Prueba de aprendizaje de listas de palabras recuerdo diferido (siglas del inglés Spanish English Verbal Learning Test); BDNF: factor neurotrófico derivado del cerebro (siglas del inglés Brain Derived Neurotrophic Factor)Fig. 3 Análisis de correlación de Pearson entre los niveles séricos del BDNF y la función cognitiva global, la función ejecutiva y la memoria episódica verbal en el grupo EA; la función ejecutiva en el grupo DCL, p(. 01.
Discusión
El presente estudio muestra los primeros resultados obtenidos en Cuba de asociación del BDNF con marcadores cognitivos en la EA. Estos apoyan la hipótesis que plantea la expresión reducida del BDNF periférico en dicha enfermedad;15 y concuerdan con un meta-análisis de cincuenta estudios que señala la EA tardía, como estadio más significativo para dicha reducción.15 Otra investigación considera que la disminución del BDNF en la EA, se relaciona con su participación en los procesos de regulación epigenética.24 Amidfar y colaboradores plantean, que la disminución de la síntesis de BDNF ocurre debido a la agregación de Aβ cerebral.13
En contraposición, investigadores reportan el incremento de los niveles séricos de BDNF en la EA.17,25 Weinstein y colaboradores, revelan que este aumento puede alcanzar 33 %, como un posible factor protector ante la enfermedad.25 Mientras Angelucci y colaboradores, atribuyen la sobrerregulación de su producción en respuesta al acúmulo del péptido Aβ.17
Recientes estudios apoyan la potencialidad del BDNF sérico como biomarcador sanguíneo;10,14,18) Mori y colaboradores, demuestran la correlación positiva del factor con los niveles del Aβ42 del líquido cefalorraquídeo y la atrofia del lóbulo temporal medial.10) No obstante, los biomarcadores sanguíneos reconocidos en la EA son el Aβ42 del líquido cefaloraquídeo y la tau, su detección es muy costosa e invasiva.11 Por ello, se impone la búsqueda de marcadores neurobiológicos como el BDNF, para la intervención preclínica en la EA. Sin embargo, la variabilidad de los niveles séricos de BDNF entre los individuos dificulta el establecimiento de valores medios en la población sana.15 Quizás, una solución sería medir el rango de disminución del BDNF sérico de forma personalizada.
Correlación entre los niveles séricos de BDNF y marcadores cognitivos en la EA
La bibliografía internacional sugiere una asociación positiva entre los niveles séricos de BDNF y el funcionamiento cognitivo en la EA.10,15,16 En el trabajo actual, en el grupo con EA presentó la mayor correlación con el factor la memoria episódica verbal, seguido por el funcionamiento cognitivo global y la función ejecutiva. A diferencia de Seo y colaboradores, que señalan como posible predictor de la EA la asociación de la memoria episódica visuoespacial con el acúmulo de proteína tau.6 De forma análoga Hiroyuki y colaboradores, en 4 463 adultos mayores con DCL identificaron al BDNF como factor de riesgo de DCL asociado a la edad; pero en asociación con la memoria inmediata verbal y de trabajo.26) En el presente estudio en los sujetos de riesgo o DCL, solo se asoció el BDNF con la función ejecutiva y la edad. Por lo que se sugiere, el potencial efecto predictor en la EA de la asociación de los niveles séricos del BDNF con el desempeño del dominio ejecutivo.
A su vez, un estudio longitudinal de dos años señala la disminución significativa del BDNF sérico en individuos con DCL persistente.27 Laske y colaboradores, describen al BDNF sérico como un predictor de la rapidez evolutiva al deterioro cognitivo.28 Por otro lado, Jasmine y colaboradores, refieren la baja asociación de esta neurotrofina con el deterioro cognitivo en la EA en 912 individuos adultos mayores a lo largo de 10 años.29
Según un estudio, la pérdida sináptica tiene mayor correlación con el deterioro cognitivo que las patologías Aβ o tau en la EA.13 Es por ello que en dicha enfermedad, para restablecer el balance de la neurodegeneración a la neuroregeneración, la reparación sináptica mediada por el BDNF sería estrategia terapéutica a considerar.12,14. No obstante, el uso clínico de factores neurotróficos recombinantes es limitado por su pobre permeabilidad de la barrera hematoencefálica y severos efectos adversos.18
Por último, se señala como limitación del estudio el tamaño muestral no representativo; y se recomienda en futuros estudios el enfoque multidisciplinario del rol del BDNF en los procesos neurodegenerativos de la EA.
Conclusiones
Los resultados del presente estudio sugieren que la asociación de la disminución de los niveles séricos del BDNF al deterioro del funcionamiento cognitivo global, la memoria episódica verbal y la función ejecutiva en la EA son expresiones del desequilibrio de los procesos de plasticidad neuronal en esta enfermedad. Además, se señala como potencial biomarcador preclínico de neuroplasticidad en la EA, al dominio ejecutivo asociado al BDNF.














