INTRODUCCIÓN
La páprika (Capsicum annuum L.) es una planta anual herbácea, perteneciente a la familia Solanaceae, y se le atribuye un agradable sabor, además de poseer gran intensidad de olor y color. De esta manera, el cultivo de páprika es de gran importancia en la zona costera peruana, por su fácil adaptación al clima, lo cual se asocia también a su calidad (Vilca, 2008; Alarco y Patiño, 2008; Herrera y Seclén, 2017).
En la actualidad Perú se encuentra entre los mayores productores y exportadores de especies del género Capsicum a nivel mundial, y se reafirma como el segundo mayor exportador de páprika (AgrodataPerú, 2019). Dentro del gran número de cultivares de páprika que tiene el país, en la costa central peruana se tiene preferencia por la variedad ‘Papri King’, debido a que posee frutos de hasta 20 cm de longitud con un excelente e intenso color rojo y paredes delgadas que permiten un secado más rápido y sencillo con altos rendimientos por hectárea (Alarco y Patiño, 2008; Valerio, 2016). También, cabe destacar que el costo de producción suele ser muy elevado debido a que las semillas se germinan en almácigos, y esta etapa se considera crucial por ser muy susceptible al ataque de agentes fitopatógenos, lo que conlleva a pérdidas elevadas de no tomarse precauciones (Arias, 2015; Romero, 2018; Hernández et al., 2019).
Otro de los problemas que afecta la producción de páprika es la baja disponibilidad de semilla de calidad a bajos precios, lo cual incrementa los costos de producción y obliga a los productores a utilizar semilla de cultivos anteriores. Normalmente estas semillas han perdido su potencial de producción debido a que son el resultado de polinización cruzada que ocasiona una elevada heterosis en la descendencia (Pech et al., 2010; Arias, 2015).
En la búsqueda de alternativas para la obtención de líneas puras y libres de agentes patógenos, la biotecnología vegetal ha brindado las herramientas con el cultivo de tejidos vegetales. Esto ha permitido un mayor porcentaje de germinación de semillas que suelen ser muy difíciles de germinar o poseen un porcentaje muy reducido en condiciones normales. Además, las plántulas se encuentran en un medio de cultivo especial que le proporciona todos los nutrientes que necesita, y como el establecimiento de cultivos in vitro es de manera aséptica, permite que estén libres de cualquier microorganismo que pueda competir o perjudicarla (Sanatombi y Sharma, 2007).
En condiciones experimentales, la germinación varía según los diferentes parámetros físico-químicos (temperatura, humedad, luz y reguladores del crecimiento). El ácido giberélico (AG3) puede romper la latencia de las semillas y frecuentemente reemplaza la necesidad de estímulos ambientales, tales como luz y temperatura (Hernández, 2004; Valerio, 2016).
Por lo tanto, el objetivo de la presente investigación fue determinar el efecto de la luz y del ácido giberélico en la germinación in vitro de semillas de páprika (Capsicum annuum L.) cv. ‘Papri King’.
MATERIALES Y MÉTODOS
La presente investigación se llevó a cabo en las instalaciones del laboratorio de Biotecnología Vegetal de la Escuela Profesional de Biología con mención en Biotecnología, ubicado en la Universidad Nacional José Faustino Sánchez Carrión, Huacho, Lima, Perú.
Material vegetal
Se colectaron las semillas de páprika cv. ‘Papri King’ de un vivero especializado en cultivo de Capsicum a partir de almácigos en la ciudad de Barranca, Lima, Perú. Las semillas fueron lavadas y luego separadas en grupos de 30, las cuales se colocaron en bolsas de gasa y de esta manera fueron trasladadas a la cámara de flujo laminar, donde se les realizó el proceso de desinfección.
Desinfección de semillas
Las semillas fueron sumergidas en solución de alcohol al 70% (v/v) durante un minuto, luego fueron sometidas a cuatro diferentes tratamientos con variaciones en las concentraciones de hipoclorito de sodio (0.5, 1, 1.5 y 2% de NaClO) (v/v), durante 10 minutos en agitación constante. Posteriormente, se realizaron tres enjuagues con agua destilada estéril y finalmente se colocaron tres semillas por tubo de ensayo con medio de cultivo. Este procedimiento se realizó con el fin de establecer un protocolo de introducción de semillas de páprika cv. ‘Papri King’ a condiciones in vitro.
Medio de cultivo
El medio de cultivo empleado consistió en las sales descritas por Murashige y Skoog (1962), con 25 g l-1 de sacarosa, 7 g l-1 de agar agar y 1 ml l-1 de Tiamina, ajustado a un pH de 5.8. Luego se esterilizó en autoclave a una presión de 1.2 bar a 121 °C durante 20 minutos.
Establecimiento in vitro
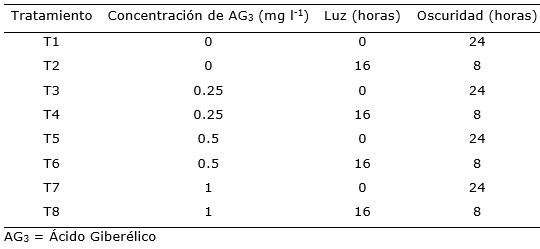
Se evaluaron ocho tratamientos con diferentes concentraciones de ácido giberélico (AG3) y fotoperiodo (Tabla 1). Todos los tratamientos fueron colocados en una cámara de crecimiento a una temperatura constante de 25 °C, con 75% de humedad e intensidad lumínica de 1500 lux.
Tabla 1. Tratamientos para la germinación in vitro de páprika (Capsicum annuum L.) cv. ‘Papri King’.
Diseño experimental, variables medidas y análisis estadístico
El experimento fue desarrollado en un diseño completamente al azar con arreglo factorial (4x2) para estudiar los ochos tratamientos de los cuales se establecieron treinta repeticiones.
Las variables que se evaluaron fueron el número de semillas contaminadas y el número de semillas germinadas. Con estos valores se calculó el porcentaje de contaminación y el porcentaje de germinación después de una y cuatro semanas de cultivo. Además, se midió la altura (cm) de las plántulas a las 4 semanas de cultivo.
Los datos obtenidos fueron analizados con el paquete estadístico Agricolae del software R versión 3.6.1, mediante análisis de varianza (ANOVA) y prueba de comparación de medias (Tukey, p≤ 0.05), previa comprobación de normalidad de los datos y homogeneidad de las varianzas.
RESULTADOS Y DISCUSIÓN
En el proceso de desinfección de las semillas de páprika cv. ‘Papri King’ los mejores resultados en la desinfección de las semillas se obtuvieron con los tratamientos 3 (1.5% NaOCl) y 4 (2% NaOCl) sin presencia de contaminantes microbianos ni daños por el desinfectante (Tabla 2). Estos resultados corroboraron la afirmación de Azofeifa (2009), de que se puede lograr una buena desinfección del material vegetal utilizando alcohol al 70% y solución de hipoclorito de sodio. Además, no fue necesario el uso de tratamientos fuertes como adicionar fungicidas o cloruro de mercurio, lo cual fue descrito por Sanatombi y Sharma (2007) para la desinfección de semillas de Capsicum chinense Jacq. cv. ‘Umorok’. Los tratamientos que presentaron contaminación fueron causados por hongos filamentosos.
Tabla 2. Efecto del hipoclorito de sodio en la desinfección de semillas de páprika (Capsicum annuum L.) cv. ‘Papri King’.

Tanto la adición de ácido giberélico como el fotoperiodo de 16 h luz incrementaron la germinación in vitro de semillas de páprika, con los mayores valores cuando ambos factores se combinaron (tratamientos 4, 6 y 8) con diferencias significativas entre ellos (Tabla 3). Las semillas en el medio de cultivo MS con la máxima concentración ácido giberélico ensayada (1 mg l-1) que se encontraban con fotoperiodo de 16 horas luz fueron las que mostraron mayor porcentaje de germinación, desde la primera semana. A las 4 semanas del establecimiento in vitro se alcanzó 97.8% (Tabla 3, Figura 1 a y b). Estos resultados se acercaron a los obtenidos por Sanatombi y Sharma (2007), quienes lograron la germinación in vitro de Capsicum chinense Jacq. cv. ‘Umorok’ en total oscuridad. Mientras, Gutierrez-Rosati y Vega (2016), alcanzaron de 96 a 100% de germinación in vitro de semillas de ‘ají mirasol’ (Capsicum baccatum cv. ‘Pendulum’) cuando emplearon soluciones de hipoclorito de sodio al 2 y 5% en la desinfección y luego las mantuvieron con un fotoperiodo de 16 horas de luz. De tal manera, la luz tiene el efecto de promover el aumento en la concentración de sustancias promotoras de la germinación, siendo requerida en muchas especies (Moreno-Jiménez et al., 2017). En este caso, en el tratamiento donde solo se aplicó fotoperiodo de 16 h luz (tratamiento 2) los resultados fueron superiores a cuando se empleó solo AG3 (tratamientos 3, 5 y 7). Este regulador del crecimiento se encuentra muy implicado en el control y germinación de gran variedad de especies (Hernández, 2004; Fraile-Robayo et al., 2012; Santacruz et al., 2014; Rodríguez et al., 2016).
Se tiene que resaltar que el alto porcentaje de germinación obtenido fue en solo cuatro semanas a diferencia de Gutierrez-Rosati y Vega (2016) que alcanzaron de 96 a 100% de germinación de ají mirasol, pero después de 10 semanas de la introducción in vitro de las semillas. Por lo tanto, al emplear medio de cultivo MS con ácido giberélico y en fotoperiodo de 16 horas luz, no solo se logró obtener porcentajes altos de germinación, sino también en menor tiempo.
Tabla 3. Efecto de diferentes concentraciones de AG3 y fotoperiodo en la germinación in vitro de semillas de páprika (Capsicum annuum L.) cv. ‘Papri King’, a la primera y cuarta semana de cultivo.
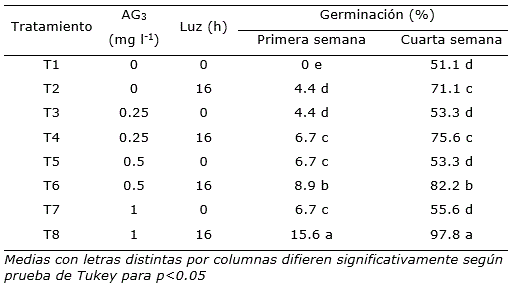

Figura 1. Plántulas de páprika (Capsicum annuum L.) cv. ‘Papri King’ originadas de semillas germinadas in vitro en medio de cultivo MS. a y b: con adición de ácido giberélico y fotoperiodo de 16 horas luz. c: oscuridad.
La altura de las plántulas fue mayor en los medios de cultivo en los cuales se adicionó ácido giberélico (Figura 2) y esto fue más notorio en las plántulas germinadas en oscuridad (Figura 1 c). Teniendo en cuenta que el ácido giberélico estimula la germinación in vitro de semillas (Rodríguez et al., 2016), promueve la división celular y además la elongación de los entrenudos, las plántulas crecen rápidamente pero al encontrarse en completa oscuridad la plántula crece aún más por su búsqueda de una fuente de luz. En el proceso se puede apreciar que estas plántulas carecen de pigmentación total o parcial. Por ello, las características de las plantas en general fueron superiores en los tratamientos con fotoperiodo de 16 h luz (Figura 1 a y b).
CONCLUSIONES
La presente investigación demostró que la adición de ácido giberélico en el medio cultivo MS y fotoperiodo de 16 horas luz favorecen la germinación in vitro de semillas de páprika cv. ‘Papri King’. Con fotoperiodo de 16 h y 1 mg l-1 se puede obtener 97.8% de germinación en cuatro semanas.















