INTRODUCCION
El níquel y el cobalto se encuentran entre los metales más utilizados en la industria moderna (Chen et al., 2020). El níquel metálico puro o sus compuestos se utilizan en el galvanizado de metales, en la fabricación de baterías alcalinas, monedas, productos de soldadura, imanes, contactos eléctricos y electrodos, intercambiadores de calor y prótesis quirúrgicas y dentales (Ghosh & Paul, 2016). En el caso del cobalto se emplea en los teléfonos móviles, en los automóviles eléctricos, además en las baterías recargables. Aleaciones de cobalto se emplean en las tecnologías armamentista (producción de municiones, rotores y hélices de helicópteros), en implantes ortopédicos, moldes de implantes dentales y quirúrgicos (Baran, 2018).
Las mayores reservas de níquel en la litosfera están contenidas en las lateritas (más del 70%), estos son minerales oxidados en el que el níquel se encuentra asociado con minerales de hierro férrico como la goetita (a-FeO.OH) (Hallberg et al., 2011). Cuba posee una de las mayores reservas de níquel y cobalto a nivel mundial, las que se ubican principalmente al noroeste de la isla, en Moa (Valcarce y Rojas, 2017). En esta región, se encuentra una industria minero- metalúrgica que explota la corteza ferroniquelífera para la extracción de níquel y cobalto. La mena laterítica ferruginosa que ingresa al proceso metalúrgico debe tener un contenido mínimo de 0,9 % (p/p) de níquel. En el caso de las menas con valores inferiores, se desechan y desde el punto de vista industrial constituyen las lateritas fuera de balance o escombros (Sánchez et al., 2014). Los escombros lateríticos están formados por óxidos de hierro y además presentan níquel, cobalto, cromo y aluminio. Estos se consideran pasivos ambientales mineros y tienen un impacto negativo en el medio ambiente (Ramírez et al., 2019). Estos residuales se sitúan en las cercanías de la propia mina y forman las conocidas escombreras las que, se estima, alcanzan volúmenes mayores de 90 x 106 t (Palacios & García, 2014).
El agotamiento de las reservas minerales a nivel mundial ha llevado a desarrollar estrategias para la explotación de los minerales de baja ley y los residuales de la industria minera y metalúrgica. En esta área, los métodos biotecnológicos han ganado gran interés demostrando mayor eficiencia con respecto a los métodos convencionales (Marrero et al., 2016). Estas estrategias consumen menos energía, son más económicos debido a que comprenden menores costos de inversión y son más amigables con el medio ambiente (Feng et al., 2019). La biolixiviación constituye uno de los procesos más utilizados en la biominería para el procesamiento de minerales (Yin et al., 2018), permite la solubilización de metales presentes en una mena o concentrado mineral mediante el acción directa o indirecta de microorganismos (Erhlich, 1981; Gentina & Acevedo, 2016).
La biolixiviación de minerales sulfurosos se aplica desde hace más de cinco décadas, principalmente en la minería del cobre para el procesamiento de minerales de baja ley (Oliveira et al., 2019). En esta área, los resultados a nivel de laboratorio, se han aplicado a escala industrial logrando recuperar cantidades significativas de metales a partir de minerales sulfurosos de baja ley (Tanaka, 2017; Yin et al., 2018).
En el caso de los minerales lateríticos son difíciles de procesar por vía biológica a través de un mecanismo oxidativo (Hallberg et al., 2011), por esta razón los estudios biotecnológicos en este campo aún permanecen a escala de laboratorio. Diferentes estrategias se aplican para la biolixiviación de níquel y cobalto de minerales oxidados entre estos se encuentran el empleo de hongos filamentosos los que excretan ácidos orgánicos como el ácido cítrico y el tartárico, considerados agentes lixiviantes (Coto et al., 2005; Coto et al., 2008; Ghosh & Paul, 2016; Petrus et al., 2018). Entre las desventajas de esta estrategia se listan la formación de un complejo metal- ácido orgánico muy estable y la biosorción de los metales por las biomasas fúngicas (Marrero et al., 2015a)
En las últimas décadas se fomenta el empleo de bacterias acidófilas quimiolitótrofas, principalmente Acidithiobacillus thiooxidans para el tratamiento de estos minerales (Hernández et al., 2009; Coto & Schippers, 2011). Esta bacteria como resultado de la oxidación de azufre elemental y otras especies reducidas del azufre produce el ácido sulfúrico, el que se reconoce como un excelente agente lixiviante, que ataca el mineral mediante un proceso de acidólisis (Hernández et al., 2009). También se aplican estrategias de disolución reductiva en condiciones de anaerobiosis donde se emplean bacterias acidófila como Acidithiobacillus ferrooxidans (Smith et al., 2017) y en condiciones aerobias con el empleo de Acidithiobacillus thiooxidans (Marrero et al., 2015 a,b). En este último enfoque, no se requiere el suministro de nitrógeno libre de oxígeno, para crear las condiciones anaerobias, por lo que representa una ventaja desde el punto de vista económico. En este sentido los estudios dirigidos al bioprocesamiento de escombros lateríticos empleando Acidithiobacillus thiooxidans y sus metabolitos constituyen una alternativa para el tratamiento de estos minerales, logrando su aprovechamiento integral y tributando con mejoras al medio ambiente. Teniendo en cuenta esto, el siguiente trabajó se trazó como objetivo: evaluar la solubilización de níquel y cobalto contenido en el escombro laterítico mediante el empleo la cepa Acidithiobacillus thiooxidans DSM 14887.
MATERIALES Y MÉTODOS
Microorganismo empleado
Se empleó la cepa Acidithiobacillus thiooxidans DSM 14887 de la Colección Alemana de Microorganismos y Cultivos Celulares (Deutsche Sammlung von Mikroorganismen und Zellkulturen, DSMZ). Esta cepa se conservó en agua ácida (pH 2,5) y en dimetilsulfóxido al 7% (v/v) a -20°C.
Escombro laterítico
El escombro laterítico que se utilizó en este estudio, proviene de la zona de explotación minera Camarioca norte Zona 12 (E-Zona 12) en la región de Moa, Holguín, Cuba. La composición química del escombro se presenta en la tabla 1.
Solubilización de Ni (II) y Co (II) contenido en el escombro laterítico mediante A. thiooxidans DSM 14887.
La solubilización de Ni (II) y Co (II) contenido en los escombros lateríticos se estudió en sistemas con diferentes densidades de pulpa del mineral. La cepa A. thiooxidans DSM 14887 se cultivó en un medio salino suplementado (pH 2,5) con 1% (p/v) de azufre elemental (Nancucheo et al., 2017), a 150 rpm, en zaranda orbital (IKA HS 501) 30°C, durante cinco días. Posteriormente, se adicionó el mineral laterítico (E-Zona 12) a diferentes densidades de pulpa: 5, 10 y 20% (p/v). Los cultivos se incubaron a 150 rpm-1, a 30°C, durante 30 días. En el caso del control abiótico se sustituyó el inóculo por agua ácida estéril (pH 2,5). La experiencia se realizó por triplicado. Se tomaron muestras periódicas (0, 2, 7, 10, 14, 21, 27 y 30 días) de los cultivos y se determinó: la concentración de sulfato; mediante el método turbidimétrico con BaCl2 (Alcaraz, 2004), el pH del medio, la concentración de Fe (II) y de Fe total mediante el método colorimétrico de la ferrozina (Stookey, 1970). La concentración de Ni (II) y Co (II) se determinó mediante el empleo de las tiras reactivas del estuche comercial MERCKOQUANT ®.
Evaluación del bioácido producido por A. thiooxidans DSM 14887 como agente lixiviante
La evaluación del bioácido bacteriano como agente lixiviante se realizó siguiendo la metodología de dos etapas aplicada por Coto et al. (2007). En la primera etapa se produjo el bioácido el que se obtuvo a través de un cultivo de la bacteria en medio salino suplementado con 1% (p/v) de azufre elemental, durante cinco días a 30°C y 150 rpm. Posteriormente el cultivo se centrifugó (centrífuga Hettich Universal Mikro 12-24) durante 10 minutos a 12 000 rpm. El sobrenadante se filtró a través de un filtro de nitrocelulosa de 0,2 μm y el filtrado contenía el ácido producido por la bacteria, el que se denominó biácido. En una segunda etapa se enfrentó 100 mL del bioácido al escombro laterítico a una concentración final de 10 % (p/v); en los controles abióticos el bioácido se sustituyó por 100 mL de medio salino y se incubaron a 30°C, 150 rpm en zaranda orbital (IKA HS 501), durante 30 días. La experiencia se realizó por triplicado. Se tomaron muestras en diferentes momentos (0, 2, 4, 14, 21, 28 y 30 días) y se determinó: pH del medio a través del pH metro (PHS-W series) y la concentración de níquel y cobalto en solución mediante las tiras reactivas del estuche comercial MERCKOQUANT ®.
Análisis biométricos.
A todos los datos se les realizaron de forma preliminar las pruebas de normalidad y de homogeneidad de varianza con el empleo de las pruebas de Shapiro Wilks y Levene, respectivamente. Una vez comprobadas las premisas se realizó un Análisis de varianza de clasificación simple seguido de una prueba de Tukey de comparación múltiple de medias. Para comparar los porcentajes de extracción todos los datos fueron transformados al logaritmo antes de realizar los análisis estadísticos. Para determinar las concentraciones de sulfato, de Fe (II) y Fe total respectivamente, se realizó una regresión lineal a partir de los datos obtenidos con las mediciones espectrofotométricas de una curva patrón para cada ion, utilizando sulfato de sodio y sulfato de Fe (II) respectivamente. Todos los análisis se realizaron con el empleo del programa STATISTICA versión 8.0.
RESULTADOS Y DISCUSIÓN
Solubilización de Ni (II) y Co (II) empleando A. thiooxidans DSM14887
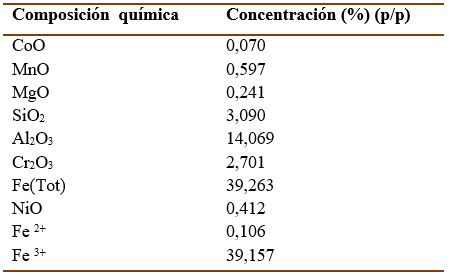
El pH del medio aumentó al adicionar el escombro laterítico, siendo más representativos en los sistemas con mayor densidad de pulpa del mineral (Figura 1A). Este parámetro continuó aumentando en los cultivos con 10 y 20% (p/v) de escombro, mientras en los cultivos con 5% (p/v) de mineral el pH disminuyó significativamente, registrándose el menor valor al terminar la experiencia. En el caso de los controles abióticos el pH aumentó en más de una unidad en los primeros dos días y posteriormente se mantuvo constante. Al concluir el experimento el pH de los cultivos con 5% (p/v) de escombro fue 1,5 mientras que el de los cultivos con 10 y 20% (p/v) fue 2,5 y 3,16 respectivamente. El aumento del pH en los primeros días se puede deber a la liberación de sustancias alcalinas del mineral y al carácter básico del escombro laterítico (Marrero et al., 2016).
En todos los tratamientos inoculados con la bacteria se detectó sulfato en el medio. La concentración de este ion (Figura 1B) fue mayor en los cultivos con 5% (p/v) de mineral, la que superó dos veces la concentración detectada en los cultivos con 10 y 20 % (p/v). A partir de los 21 días de incorporar el escombro a los cultivos, en los medios con mayor densidad de pulpa, la concentración de sulfato se mantuvo constante. En los controles abióticos la concentración de sulfato en el medio no fue significativa.
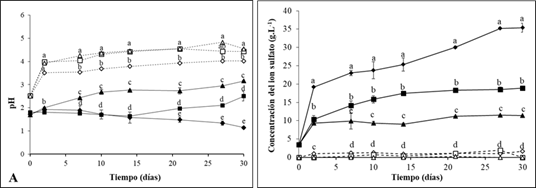
Fig. 1 Variación: (A) del pH y (B) de la concentración del ion sulfato en el medio salino inoculado con A. thiooxidans DSM14887 a diferentes concentraciones del escombro laterítico (♦5, ■10, ▲20% p/v) durante 30 días, a 30°C y 150 rpm. Controles abióticos (◊5, □10, ∆20% p/v). Las letras diferentes indican diferencias significativas entre los tratamientos, cada tiempo evaluado, Tukey (n=3, p<0,05).
El comportamiento en el pH y en la concentración del ion sulfato en el medio se debe a que A. thiooxidans utiliza el azufre elemental como fuente de energía y lo oxida a sulfato (ácido sulfúrico), esto provoca una disminución en la concentración hidrogeniónica del cultivo, por lo que la determinación del pH y la concentración de sulfato del medio constituyen dos parámetros que permiten monitorear el crecimiento bacteriano (Ciftci & Atick, 2017). El metabolismo del azufre en el género Acidithiobacillus continua en estudio (Yin et al., 2019, Cortés et al., 2020, Camacho et al., 2020 y se han identificado en los últimos años diferentes vías metabólicas y genes involucrados en las mismas (Cao et al., 2018; Zhan et al., 2019; Wang et al., 2019). El incremento de la densidad de pulpa del mineral en el sistema tuvo un efecto negativo en la oxidación del azufre. El aumento del pH pudo afectar el crecimiento de la bacteria, lo que se reflejó en la disminución de la oxidación del azufre.
En todos los tratamientos se detectó en el medio Fe (II). La concentración de este ion (Figura 2A) superó en más de dos veces la concentración de hierro férrico (Figura 2B) en los medios con 5 y 10% (p/v) de mineral. En sistemas con 20% (p/v) del mineral, las concentraciones de hierro ferroso y férrico no fueron apreciables. La mayor concentración de hierro ferroso se detectó en el medio con 10% (p/v) de densidad de pulpa. La concentración de hierro ferroso registrada en los cultivos con 5% y 10% (p/v) fue significativamente superior a la registrada en los respectivos controles abióticos, lo que indica que A. thiooxidans bioacelera la disolución reductiva del hierro férrico contenido en los minerales lateríticos.

Fig. 2 Variación de la concentración de (A) Fe (II) y de (B) Fe (III) en el medio salino inoculado con A. thiooxidans DSM14887 y diferentes concentraciones del escombro laterítico (♦5, ■10, ▲20% p/v) durante 30 días, a 30°C y 150 rpm. Controles abióticos (◊5, □10, ∆20% p/v). Las letras diferentes indican diferencias significativas entre los tratamientos, en cada tiempo evaluado, Tukey (n=3, p<0,05).
En todos los sistemas inoculados se detectó níquel y cobalto en solución, siendo los porcentajes de solubilización de cobalto superiores a los del níquel. Estos resultados pueden deberse a que el cobalto esta predominantemente asociado a manganeso-hierro, lo que significa que a medida que se reduce el hierro férrico a hierro ferroso se libera el cobalto a la solución. Mientras que el níquel está asociado a los geles de hierro, goetita y hematita (Palacios & García, 2014). En los controles abióticos no se detectó metales en solución (Figura 3).
El aumento de la densidad de pulpa tuvo un efecto negativo en el recobrado del metal. Los mayores porcentajes de recuperación del níquel y cobalto se registraron en los sistemas con 5 % (p/v) de escombro, en loa que se logró solubilizar el 71,4% del cobalto a los 14 días, mientras que para el níquel la mayor solubilización se detectó a los a los 27 días (48,5%). Estos valores superaron significativamente los porcentajes alcanzados en los medios con 10% (42,8% de Co y 24,2% de Ni) y 20% (21,4 % de Co y 10,9% de Ni) de escombro.
Este comportamiento puede deberse al aumento de la concentración de productos solubles disueltos como los metales. Aunque el níquel y el cobalto son esenciales para la célula a altas concentraciones son tóxicos para la célula (Das et al., 2019; Mahey et al., 2020), de ahí que inhiba el crecimiento microbiano y como consecuencia disminuye la solubilización de los metales (Pathak et al., 2017; Ciftci & Atick, 2017). Además, el aumento de la densidad de pulpa hace el medio más viscoso por lo que influye negativamente en la transferencia de oxígeno entre las células y el medio (Simate & Ndlou, 2008), asimismo, esto provoca el incremento de fuerza de rozamiento entre el mineral y la bacteria afectando su crecimiento (Das & Ghosh, 2018).
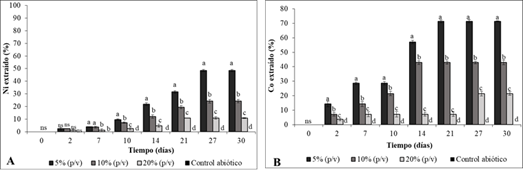
Fig. 3 Variación del porcentaje de solubilización de: níquel (A) y cobalto (B) en cultivos de A. thiooxidans DSM14887 y diferentes concentraciones del escombro laterítico (5, 10 y 20 % p/v), durante 30 días, a 30ºC y 150 rpm. Control abiótico: sin inocular. Las letras diferentes indican diferencias significativas entre los porcentajes de extracción de cada tratamiento, en cada tiempo evaluado, Tukey (n=3, p<0,05).
El efecto negativo del aumento en la densidad de pulpa se informó por Coto et al. (2008) quienes evaluaron la solubilización de Ni y Co a partir de la cola del proceso CARON mediante el empleo de A. thiooxidans en el medio 0K suplementado con azufre elemental (2% p/v) y diferentes densidades de pulpa (2,5%, 5%, 10% p/v). Los mayores porcentajes de extracción lo obtuvieron en presencia de 2,5% (p/v) del mineral. Este efecto también se refiere en el estudio de la biolixiviación de Mn a partir de un mineral oxidado de hierro- manganeso, proveniente de una mina de Orissa, en la India mediante una cepa de Bacillus sp. y diferentes densidades de pulpa del mineral (2-10% p/v). Los mejores porcentajes de extracción de Mn se lograron cuando se utilizó 2% (p/v) de densidad de pulpa del mineral (Das & Ghosh, 2018).
La solubilización de los metales contenidos en los minerales lateríticos empleando A. thiooxidans se debe a un mecanismo que combina la producción de ácido sulfúrico por la bacteria (acidólisis), con su capacidad bioacelerar la disolución reductiva del Fe (III) contenido en esos minerales (Marrero et al, 2015a; b). La disolución reductiva del Fe (III) contenido en los escombros lateríticos por A. thiooxidans se demostró por Marrero et al. (2016). Además, A. thiooxidans presenta un mecanismo de expresión constitutiva de reducción de hierro férrico en condiciones aerobias (Marrero et al., 2015a). En este estudio se evidenció que en los medios con 5 y 10% (p/v) del mineral la concentración de Fe (II) fue significativamente superior a la de Fe (III), evidenciando este mecanismo de disolución reductiva, no observándose en el sistema con 20% (p/v) (Figura 2), lo que indica que en esta concentración ocurre una inhibición del proceso. En la disolución reductiva las bacterias reducen el hierro férrico contenido en la fase mineral de la mena y permiten la liberación del metal que está asociado al mismo (Nancucheo et al., 2017). Los resultados registrados en este estudio permitieron determinar las mejores concentraciones del mineral para que ocurra el proceso de solubilización de los iones metálicos en presencia de la bacteria.
Solubilización de Ni (II) y Co (II) a partir del bioácido producido por la cepa A. thiooxidans DMS14887
Los resultados de la evaluación del bioácido en la solubilización de níquel y cobalto a partir de los minerales en estudio empleando 10% (p/v) de densidad de pulpa se presentan en la figura 4. El recobrado de los metales aumentó en el tiempo. En los controles abióticos no se detectó los metales evaluados en solución. Los porcentajes de extracción de Co (II) fueron significativamente superiores a los de Ni (II). A los 14 días se logró extraer la mayor concentración de cobalto (31,5%), mientras que la concentración de níquel se mantuvo constante en el medio a partir del cuarto día, obteniéndose 2% de solubilización de este metal.
El pH del medio aumentó en el tiempo, tanto en los medios con el bioácido como en los controles abióticos (Figura 4B), al concluir el experimento el pH del sistema con el bioácido fue de 2,47 mientras que el del control abiótico fue 4,02. A pesar de que estos resultados indican que el bioácido bacteriano permite la solubilización de Ni y Co, los porcentajes de solubilización estos fueron ocho y dos veces superiores, respectivamente, en presencia de la bacteria.
El ácido sulfúrico, producido como parte del metabolismo de la bacteria, se reconoce como un excelente agente lixiviante (Hernández et al., 2009). La biolixiviación en dos etapas con el empleo, en la segunda etapa, del sobrenadante libre de células puede mitigar el efecto tóxico del mineral. A la vez constituye una alternativa para el tratamiento de materiales y residuales tóxicos. Con esta estrategia se logró solubilizar más del 30% del Co y solo el 2% del Ni, estos valores son inferiores a los registrados en presencia de la bacteria, lo que resalta la importancia del microorganismo en el proceso de solubilización.

Fig. 4 Variación del (A) porcentaje de extracción de Ni y Co y (B) pH en los medios con el bioácido bacteriano y el escombro laterítico, incubados durante 30 días, a 30ºC y 150 rpm. Las letras diferentes indican diferencias significativas entre los porcentajes se solubilización, en cada tiempo evaluado Tukey (n=3, p<0,05).
Los resultados obtenidos en esta investigación están en correspondencia con los informados por Wu et al. (2018) quienes evaluaron la biolixiviación de cobre a partir de residuales de placas de circuitos impresos (printed circuit boards) empleando el bioácido producido por Leptospirillum ferriphilum y Sulfobacillus thermosulfidooxidans. Esto permitió el recobrado del 93,4% del cobre contenido en el material a los 9 días de incubación. Además, mediante este estudio se avalan los resultados referidos por Marrero et al. (2015a) en el tratamiento de colas del proceso CARON y escombros lateríticos (Marrero et al., 2016) respectivamente a la vez que resalta la efectividad de A. thiooxidans como agente lixiviante.
CONCLUSIONES
El empleo de A. thiooxidans DSM 14887 en un sistema con 5% (p/v) de densidad de pulpa del escombro permite altos recobrados de Ni y Co lo que constituye una excelente alternativa para el tratamiento de residuales minerales oxidados. La optimización de la densidad de pulpa es parámetro necesario para lograr el crecimiento del microorganismo y mejorar la eficiencia de la solubilización de los metales. El ácido producido por la bacteria permite la solubilización de níquel y cobalto del mineral, aunque los porcentajes de extracción son inferiores comparado con los sistemas en presencia de la bacteria, lo que destaca la importancia de la bacteria en el proceso de extracción.